家禽羽毛降解菌WYM39的分离鉴定及其产酶特性
2019-01-09文冰洁李晓霞兰新慧贾良辉
文冰洁, 李晓霞, 柯 欣, 兰新慧, 贾良辉, 颜 华
(西北农林科技大学生命科学学院,陕西杨凌 712100)
随着现代社会家禽消费量的不断增加,家禽加工厂的副产品——羽毛也在快速积累[1]。羽毛占成熟家禽活体质量的5%~7%[2]。一般家禽羽毛会被倾倒,被填埋或焚烧,造成土壤、水和空气的巨大污染,羽毛的积累不仅导致环境污染,也是羽毛资源的浪费[3]。羽毛的主要成分是角蛋白[4],角蛋白富含二硫键[5]和疏水侧链,使羽毛坚韧而耐化学腐蚀[6]。传统的降解羽毛的方法,如碱水解法和蒸汽高温高压水解法,不仅会破坏产物中的氨基酸[7],同时消耗大量能量、造成成本高等问题[8]。由于环保意识的增强,生物降解羽毛的方法越来越受到人们的关注[9]。角蛋白不能被常见的蛋白水解酶如胰蛋白酶、胃蛋白酶、木瓜蛋白酶等降解,但很容易被微生物产生的角蛋白酶水解[10]。细菌、放线菌、真菌等都可以产生角蛋白酶[11],以丝氨酸蛋白酶和金属蛋白酶为主,在较宽的温度范围和pH值范围内具有活性[12]。角蛋白酶作为特殊的酶,不仅可以用于饲料和肥料产业,还可扩展到洗涤剂产业、皮革工业和医药行业[4]。此外,角蛋白酶能灭活朊病毒,在此方面有应用潜力[13]。为了丰富角蛋白降解的菌株资源,提供生长快速、产酶量高、具应用潜力的菌株,同时拓展角蛋白酶的获得来源,为发现更高效的角蛋白酶奠定基础,笔者采用以鸡羽毛为唯一碳氮源的分离培养基,对从1处鸡圈采集的土样,经初筛和复筛,选择降解效果最为突出的1株菌(编号为WYM39),并对其进行16S rDNA分析及产酶条件和酶学特性的研究。
1 材料与方法
1.1 材料
1.1.1 土壤样品 2016年8月采集湖南省桑植竹林养鸡场羽毛堆积处地表5 cm的土壤,室内风干后储存于4 ℃。试验于2016年9月至2017年12月在西北农林科技大学生命科学学院放线菌分子生物学实验室进行。
1.1.2 培养基 羽毛粉培养基:羽毛粉10.0 g,K2HPO41.0 g,NaCl 0.5 g,KH2PO40.4 g,琼脂20.0 g,蒸馏水 1 000 mL,121 ℃灭菌25 min;牛奶培养基:脱脂奶粉5.0 g,琼脂20.0 g,蒸馏水1 000 mL,115 ℃灭菌20 min;液体羽毛培养基:整根的羽毛10.0 g,K2HPO41.0 g,NaCl 0.5 g,KH2PO40.4 g,蒸馏水1 000 mL,121 ℃灭菌25 min。
1.2 羽毛降解放线菌的分离
1.2.1 土壤样品的处理 称取(1.0±0.001) g土样置于 80 ℃ 干热消毒箱中处理2 h后,将其加入处理液[酵母膏 0.6 g,十二烷基硫酸钠(SDS)0.005 g,生理盐水10 mL,121 ℃ 灭菌25 min],30 ℃,150 r/min培养30 min。
1.2.2 使用羽毛粉培养基进行分离及牛奶培养基初筛 将“1.2.1”节中的处理液稀释为10-2、10-3、10-4、10-54个梯度,取稀释后的处理液100 μL分别涂布于羽毛粉培养基平板上,每个梯度设3个重复。将样品于28 ℃倒置培养,每天观察1次,挑取单菌落于牛奶培养基上,通过观察有无水解圈进行初筛。
1.2.3 使用液体羽毛培养基进行复筛 将初筛的菌株进行传代、纯化,纯化后接种于具有整根羽毛的液体羽毛培养基,将具有显著降解作用的菌株保藏于50%甘油中。综合其生长情况,挑选1株生长快、降解效果好的菌株(编号为WYM39)进行后续试验。
1.3 羽毛降解菌WYM39的鉴定
1.3.1 菌株形态特征扫描电镜观察 挑取菌株WYM39的孢子在羽毛粉培养基上划线接种,在划线处斜插入经过无菌处理的盖玻片,28 ℃恒温倒置培养,培养数天后用扫描电镜观察。
1.3.2 菌株16S rDNA测定 使用Kirby Mix法[14]提取菌株WYM39的总DNA,使用通用引物F27/R1522(引物F27序列5′-AGAGTTTGATCCTGGCTCAG-3′,引物R1522序列5′-AAGGAGGTGATCCAGCCGCA-3′)进行聚合酶链式反应(polymerase chain reaction,简称PCR)扩增,回收PCR产物连接pMD-18T载体,并转化至大肠杆菌DH5α感受态细胞中,选择阳性克隆,委托生工生物工程(上海)股份有限公司进行序列测定。将菌株WYM39的16S rDNA序列在美国国立生物技术信息中心(National Center for Biotechnology Information,简称NCBI)网站中进行局部对比基本检索工具(basic local alignment search tool,简称BLAST)分析,通过Mega 5.0,以Neibour-Joining方法构建系统发育树。
1.3.3 菌株生理生化特征 菌株生长温度、最适pH值、NaCl耐受性、唯一碳源、唯一氮源、明胶液化、脲酶、淀粉水解、牛奶凝固与胨化、产H2S和纤维素分解试验参照文献[15]。
1.4 羽毛降解菌WYM39产酶条件研究
1.4.1 酶活的测定 本试验使用酪蛋白[casein(Sigma)]作为底物进行菌株WYM39粗酶液的酶活测定,参照文献[16]进行酶活测定和酪氨酸标准曲线测定。定义40 ℃下1 min每释放1 μg酪氨酸,升高1个酶活单位。
1.4.2 培养时间对菌株WYM39产酶的影响 将菌株WYM39接种于液体羽毛培养基中,于30 ℃、150 r/min条件下分别培养12、24、36、48、60、72、84、96、108、120 h,以菌液上清为粗酶液测定酶活。
1.4.3 培养温度对菌株WYM39产酶的影响 菌株WYM39接种于液体羽毛培养基中,培养温度分别为20、25、30、35、40 ℃,150 r/min条件下培养96 h,取粗酶液测定酶活。
1.4.4 初始pH值对菌株WYM39产酶的影响 将菌株WYM39接种于初始pH值分别为5.0、5.5、6.0、6.5、7.0、7.5的液体羽毛培养基中,于30 ℃、150 r/min条件下培养96 h,取粗酶液测定酶活。
1.4.5 初始NaCl浓度对菌株WYM39产酶的影响 将菌株WYM39接种于初始pH值为7.0,初始NaCl浓度分别为0、10、20、30、40、50、60、70 mg/mL的液体羽毛培养基中,于 30 ℃、150 r/min条件下培养96 h,取粗酶液测定酶活。
1.5 对菌株WYM39酶学特性的初步研究
1.5.1 反应温度对酶活的影响 粗酶液与底物反应时,分别设置温度为30、40、50、60、70 ℃,测定并记录不同反应温度下的酶活。
1.5.2 反应pH值对酶活的影响 使用几种不同pH值的缓冲液配制pH值分别为6.0、6.5、7.0、7.5、8.0、8.5、9.0的反应底物,与粗酶液混合后于最适温度下反应,测定并记录不同pH值对酶活的影响[16]。
1.5.3 WYM39粗酶液的温度稳定性 将粗酶液于30、40、50、60、70 ℃条件下处理30 min后,在最适温度及最适pH值条件下测定酶活。
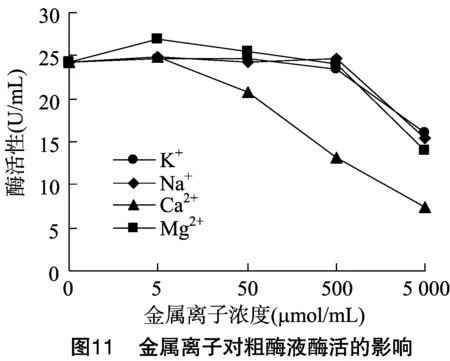
1.5.4 金属离子对酶活的影响 在1 mL粗酶液中分别加入5、50、500、5 000 μmol的K+、Na+、Ca2+、Mg2+,混合后在 30 ℃ 放置30 min后测定酶活。
1.5.5 化学试剂对酶活的影响 在1 mL粗酶液中分别加入1 mmol苯甲基磺酰氟(PMSF)、1 mmol乙二胺四乙酸(EDTA)、10 μLβ-巯基乙醇、10 μg十二烷基硫酸钠(SDS)、10 μL 异丙醇、10 μg二硫苏糖醇(DTT)、10 μL二甲基亚砜(DMSO),混合后在30 ℃放置30 min后测定蛋白酶活。
1.5.6 测定底物特异性 分别以可溶底物偶氮酪蛋白、酪蛋白;不可溶底物天青角蛋白、羽毛粉测定菌株WYM39粗酶液的酶活,不同底物的酶活测量方法参照文献[16]。
2 结果与分析
2.1 菌株的分离筛选及菌株WYM39角蛋白降解效果观察
将采自鸡圈地表的土样处理后稀释浓度为10-4倍涂布于羽毛粉培养基平板上,挑取能在其上生长的单菌落接种在牛奶培养基平板上,将能够在牛奶培养基上产生明显降解圈的菌株传代、纯化,接种于整根羽毛配制的液体羽毛培养基中,选择1株具有生长快、降解效果好等特点的菌株进行后续研究,将其编号为WYM39。菌株WYM39在接种量为1%、30 ℃、150 r/min培养4 d时,能将100 mL液体羽毛培养基中的1 g完整羽毛完全降解(图1)。

2.2 菌株WYM39的形态特征
菌株WYM39在羽毛粉培养基上28 ℃恒温培养96 h,扫描电镜观察结果如图2所示,基丝无隔不断裂,直径0.3~0.6 μm;孢子短杆状,大小0.7~1.2 μm。在牛奶培养基上28 ℃恒温培养72 h,能观察到明显降解圈,菌落呈圆形,有白色孢子气丝,基丝黄褐色。

2.3 菌株WYM39的16S rDNA序列测定及系统发育树构建
提取菌株WYM39基因组DNA后,使用通用引物F27/R1522扩增得到菌株WYM39的16S rDNA,进行序列测定。菌株WYM39的16S rDNA序列大小为1 517 bp,将其在NCBI网站中进行BLAST分析,通过Mega 5.0,以Neibour-Joining方法构建系统发育树(图3)。该菌株与中间型链霉菌(Streptomycesintermedius)的相似度最高,为99%。

2.4 菌株WYM39的生理生化特征
菌株WYM39不仅能利用葡萄糖等多种碳源,还能利用亮氨酸、甲硫氨酸等氮源,但不能利用天冬氨酸、谷氨酸。菌株WYM39可在含有150 mg/mL NaCl的培养基中生长,且能分解明胶、淀粉,还能使牛奶胨化,但不能降解纤维素,也不能产生脲酶和H2S。其具体生理生化特征见表1。
2.5 菌株WYM39的产酶条件研究
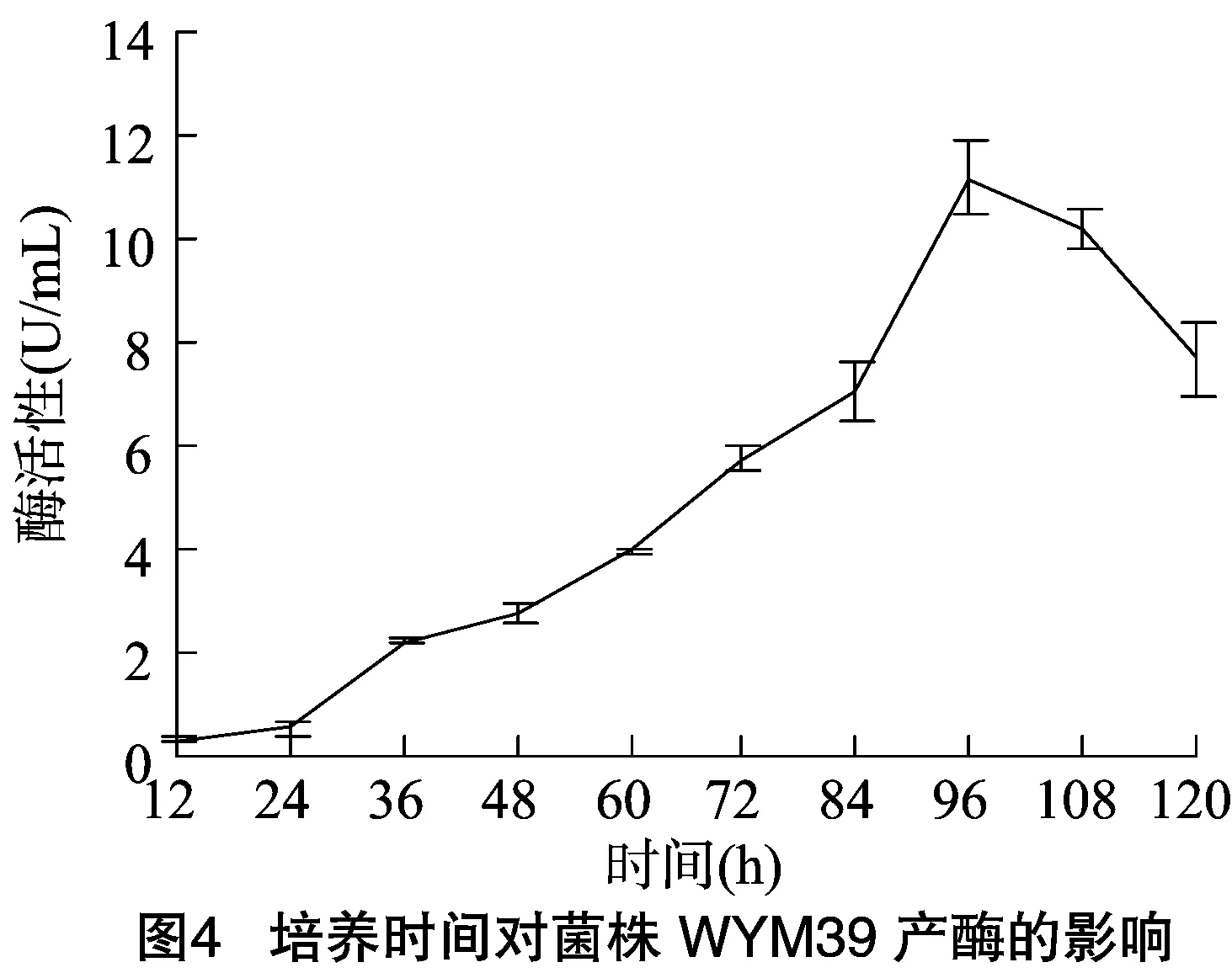
2.5.1 培养时间对菌株WYM39产酶的影响 如图4所示,在培养时间为96 h时,酶活性出现峰值。发酵前期是菌体生长的时间,后期由于营养物质(羽毛)被耗尽,酶活性降低,因此96 h是研究菌株WYM39产酶条件合适的培养时长。
2.5.2 培养温度对菌株WYM39产酶的影响 如图5所示,在培养温度为30 ℃时酶活性最高,培养温度低于25 ℃或高于35 ℃时,酶活性很低,说明30 ℃是研究菌株WYM39产酶条件合适的培养温度。

表1 菌株WYM39的生理生化特征
注:“-”表示阴性;“+”表示阳性。

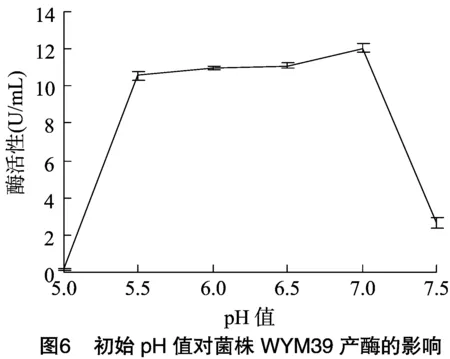
2.5.3 初始pH值对菌株WYM39产酶的影响 如图6所示,初始pH值在5.5~7.0时,酶活性在较高水平,在初始pH值为7.0时,酶活出现峰值,因此pH值为7.0是菌株WYM39产酶条件研究的合适初始pH值。
2.5.4 初始NaCl浓度对菌株WYM39产酶的影响 如图7所示,初始NaCl浓度为0时酶活性最高,随着初始NaCl浓度的升高,酶活逐渐降低,当NaCl浓度高于30 mg/mL后酶活降至极低水平,结合生理生化试验结果可知,菌株WYM39可在含有0~150 mg/mL NaCl的培养基中生长,但初始NaCl浓度为0是菌株WYM39产酶条件研究的合适初始NaCl浓度。
2.6 菌株WYM39粗酶液酶学特性研究
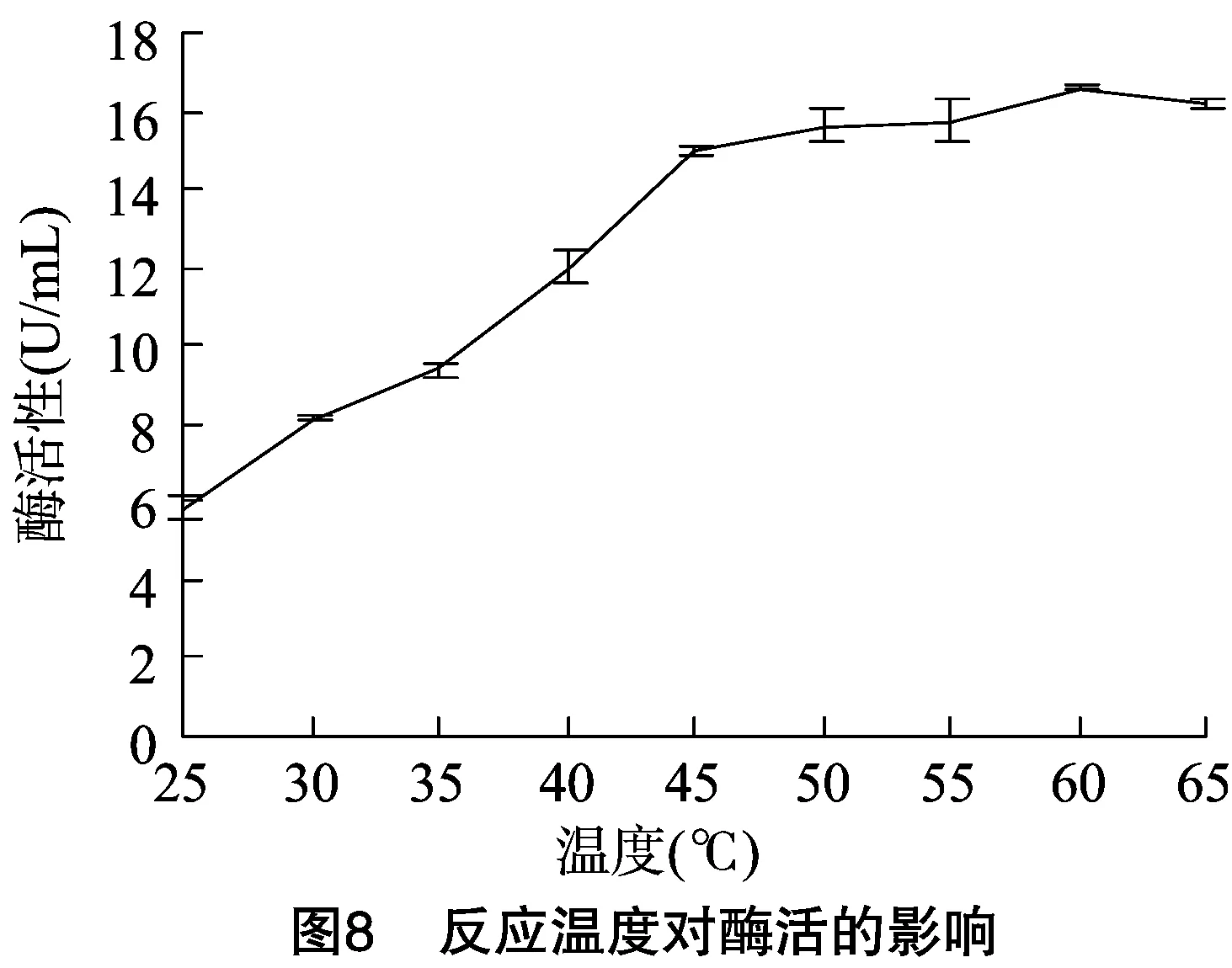
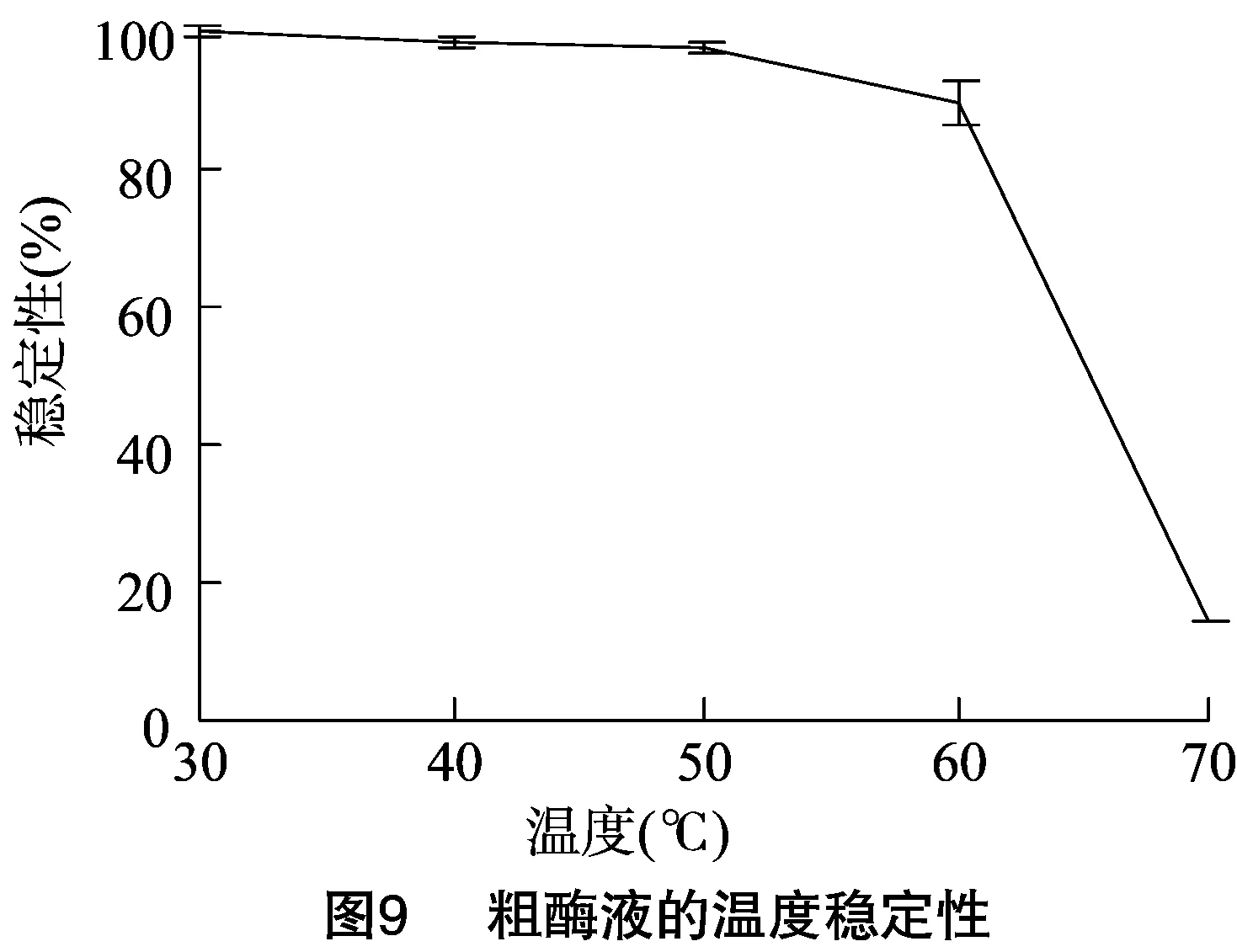
2.6.1 菌株WYM39粗酶液最佳反应温度和温度稳定性测定 如图8所示,该酶最适反应温度为60 ℃;温度稳定性测定试验结果如图9所示,该酶在60 ℃下30 min后仍保存89%的酶活性。
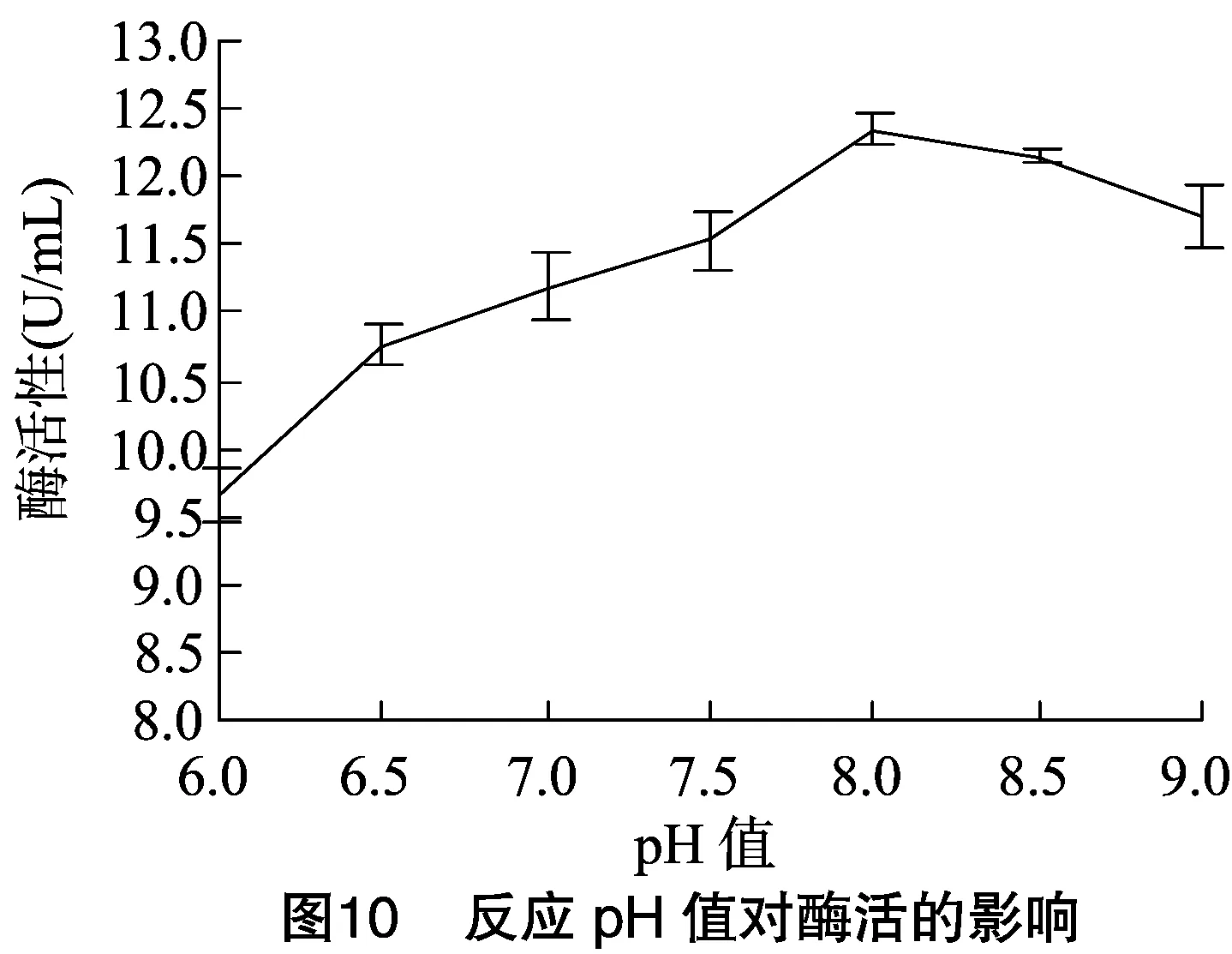
2.6.2 菌株WYM39粗酶液最佳反应pH值 如图10所示,粗酶液在反应pH值为8.0时酶活性最高,在pH值为7.5~9.0范围内能保持93%的酶活性。

2.6.3 化学试剂和金属离子对菌株WYM39粗酶液酶活的影响 如表2所示,和粗酶液的酶活性相比,PMSF、EDTA对粗酶液的酶活性具有抑制作用,而DTT、β-巯基乙醇、异丙醇、SDS、DMSO能够提高该酶的催化活性。
金属离子对菌株WYM39粗酶液影响试验结果如图11所示,K+、Na+、Ca2+、Mg2+在低浓度(5 μmol/mL)时对粗酶液的酶活性几乎没有影响,但在高浓度(5000μmol/mL)时对酶活有抑制作用,其中Ca2+的抑制作用最强。
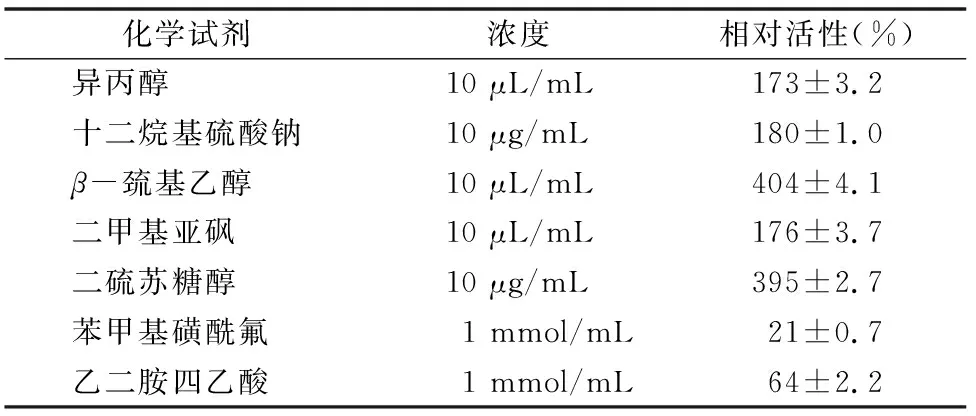
表2 化学试剂对粗酶液酶活力的影响
2.6.4 菌株WYM39粗酶液的底物特异性 如表3所示,粗酶液可以降解可溶的偶氮酪蛋白、酪蛋白,也可降解不可溶的羽毛和天青角蛋白。

表3 不同底物对粗酶液酶活的影响
3 讨论与结论
在接种量为1%、30 ℃、150 r/min条件下培养时,菌株WYM39能在4 d将100 mL以整根羽毛为唯一碳氮源的培养基中的1 g羽毛完全降解,对鸡羽毛有较强的降解能力。结合形态观察、生理生化特征、16S rDNA基因序列分析、基于16S rDNA基因序列构建的进化树,初步确定菌株WYM39为链霉菌属(Streptomyces)的1个菌株。当反应体系中的Ca2+达到50 μmol/mL或PMSF为1 mmol/mL时,粗酶液的活性被抑制,表明该酶属于丝氨酸蛋白酶。菌株WYM39的粗酶液在反应温度为60 ℃时酶活最高,并在经60 ℃处理30 min后仍能保存89%的酶活,有在高温下应用的潜力。在底物特异性试验的补充试验中发现,反应体系添加10 μL/mL的β-巯基乙醇后,降解羽毛粉和天青角蛋白时酶活分别从4.97和 2.57 U/mL 提升到12.6和7.2 U/mL,分别提高了1.5和1.8倍,说明还原剂的存在对角蛋白降解有重要作用。此外,本试验仅采用以羽毛为唯一碳氮源的液体培养基为发酵培养基,培养基配方单一,有通过优化培养基配方提高产酶能力的潜力。
