2,2′,4,4′,5-五溴联苯醚(BDE-99)对巴夫藻和塔玛亚历山大藻的致毒胁迫效应
2019-01-09王洪斌熊文超胡业庆谢冰倩李士虎
王洪斌, 成 群, 熊文超, 胡业庆, 谢冰倩, 李士虎
(1.淮海工学院海洋生命与水产学院,江苏连云港 222005; 2.江苏省海洋生物技术重点实验室,江苏连云港 222005)
2,2′,4,4′,5-五溴联苯醚(BDE-99)是一种多溴联苯醚(PBDEs),也是一种溴代阻燃剂。PBDEs拥有极为优异的阻燃性能、热稳定性等,因此被广泛用作电子电路、建筑家具、塑料制品、纺织等行业中。但是,这些产品在使用、焚烧和降解等过程中,不与PBDEs共价结合,这时PBDEs就会挥发到自然环境中[1-2],之后经过大自然的各类循环进入海洋,并最终在沉积物和生物体体内积累[3]。大量研究和实证表明,PBDEs的化学结构与多氯联苯(PCBs)极为相似,具有难降解、高脂溶性等特点,是一种新型的持久性有机污染物。2004年,欧洲部分国家已禁止八溴联苯醚等PBDEs的投放使用。2006年,欧盟颁布明令禁止欧盟各国在电子商品中使用多溴联苯醚[4]。
我国为发展中国家,每年使用多溴联苯醚用作阻燃剂等也十分多。随着PBDEs用量的增加,在大气、沉积物或污泥、鱼类、人体血液和脂肪组织、母乳等中均能检测到其存在,而在水、沉积物和生物体中含量最高的是以BDE-47、BDE-99、BDE-100为主的低溴联苯醚。
藻类作为海洋和陆地上的初级生产者,其价值在近几十年来被越来越多的研究人员和学者看重。关于藻类的研究更是不胜其数,其中微藻的生态价值已经渗透到工业、农业等各方面。BDE-99一旦进入水体,开始“入侵”的对象就是浮游藻类。在“侵入”后便在食物链中传播,进入水体和人体,从而危害生物体健康。
本研究选用常见的巴夫藻(Pavlocaviridis)和塔玛亚历山大藻(Alexandriumtamarense)为供试材料,以它们的生长量等为检测参数,分析塔玛亚历山大藻和巴夫藻对不同浓度梯度BDE-99的致毒胁迫的响应,从而研究BDE-99对海洋微藻的毒性效应,以期证明多环芳烃化合物会对水环境带来严重的破坏性,揭示海洋微藻在水环境污染治理及修复中的潜在应用价值。
1 材料与方法
1.1 试验材料
巴夫藻和塔玛亚历山大藻藻种均由淮海工学院海洋生命与水产学院藻类实验室保存;本试验中所用海水均取于江苏省连云港市连岛海域涨潮时,海水盐度为31.00‰~32.00‰,经醋酸纤维素薄膜过滤后,于121 ℃高压灭菌 20 min 后备用;BDE-99购自上海源叶生物有限公司(纯度为98%);二甲基甲酰胺(DMF)购自生工生物工程(上海)股份有限公司;酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、过氧化氢酶(CAT)和丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所;微藻培养采用通用的f/2营养液(自配);其他化学试剂均为分析纯。
1.2 试验方法
1.2.1 微藻培养及微藻细胞破碎 在250 mL锥形瓶中加入150 mL f/2营养液和10 mL藻种,混合均匀,置于光照培养箱中进行封闭式培养,光照度为3 000 lx,培养温度为(22±1) ℃,光—暗周期为12 h—12 h。培养过程中每天定时摇动3次,摇瓶过程中随机调换位置,以免光照不均匀。
量取20 mL待测藻液,于5 000 r/min离心10 min,弃上清,将沉淀物加入10 mL 0.05 mol/L磷酸缓冲液(pH值为 7.8)中,采用超声波破碎藻细胞(破碎条件:功率为195 W,超声波工作时间为3 s,间歇时间为7 s,超声波破碎强度为65%,总工作时间为10 min),镜检无完整细胞后,于 5 000 r/min 离心10 min,取上清液用于检测ACP、AKP、CAT活性及MDA含量。
1.2.2 DMF对微藻生长量的影响 BDE-99溶液用DMF配制,BDE-99母液浓度为5 μg/mL,使用时根据需要稀释;在研究BDE-99对海洋微藻的影响时,可能会受到DMF的干扰。在藻类生长至对数生长期时,分别在巴夫藻、塔玛亚历山大藻试验组中加入0、50、100、200、400、800 μL DMF溶液;用吸光度法(检测波长为680 nm)检测其生长量,24 h测定1次,直至120 h,试验设置3个平行。
1.2.3 BDE-99对微藻生长量的影响 在微藻对数期添加不同浓度梯度的BDE-99,根据文献[5],分别在巴夫藻和塔玛亚历山大藻试验组中加入0、50、100、200、400、800 μL BDE-99的DMF溶液,对应浓度分别为0、1.67、3.34、6.68、13.36、26.72 μg/L;用吸光度法(检测波长为680 nm)检测其生长量,24 h测定1次,直至120 h,试验设置3个平行。
1.2.4 ACP、AKP、CAT活性和MDA含量的测定 在微藻对数期分别添加0、6.68 μg/L浓度的BDE-99,对其ACP、AKP、CAT活性和MDA含量进行测定,时间间隔为24 h,直至120 h,试验设置3个平行。ACP、AKP、CAT活性和MDA含量的测定按照试剂盒的说明书进行。
2 结果与分析
2.1 DMF对2种海洋微藻生长量的影响
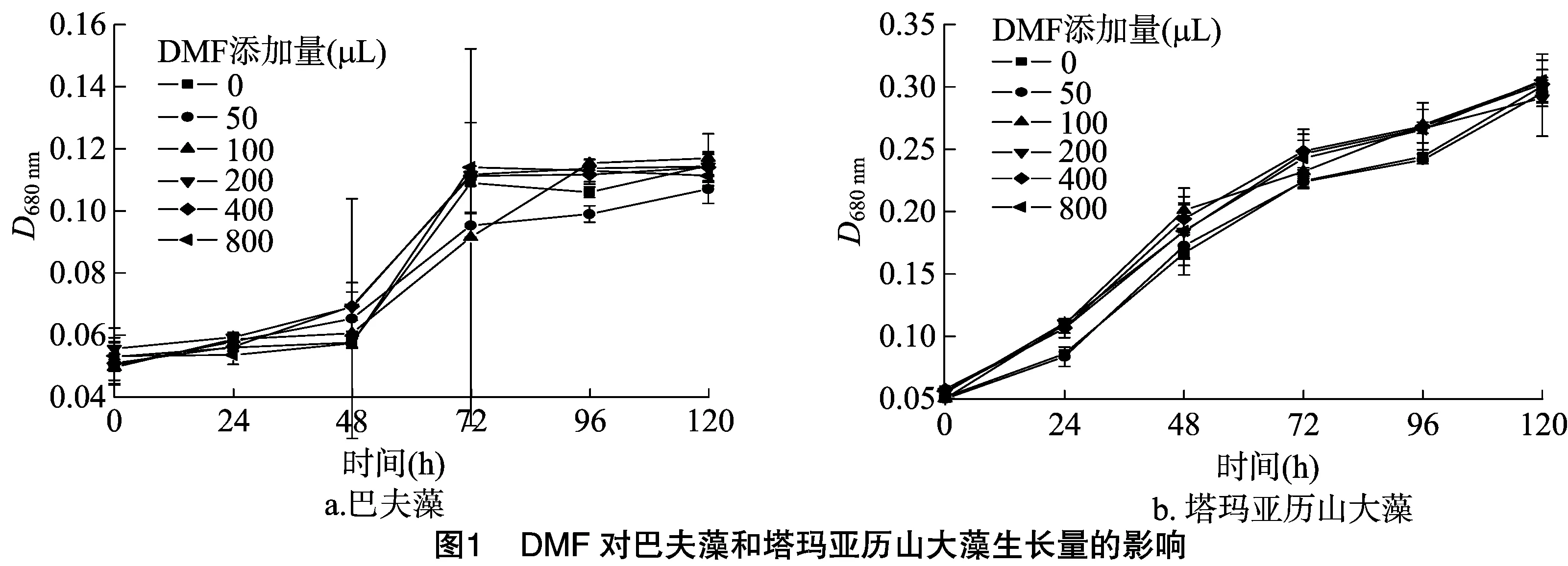
由图1可以看出,2种海洋微藻的生长量均呈现快速增长的趋势,DMF各添加量试验组与对照组的生长量几乎相等,增长趋势一致,可见DMF添加量增加对巴夫藻及塔玛亚历山大藻的生长没有抑制作用,DMF作为BDE-99溶剂对本研究结果无明显影响。
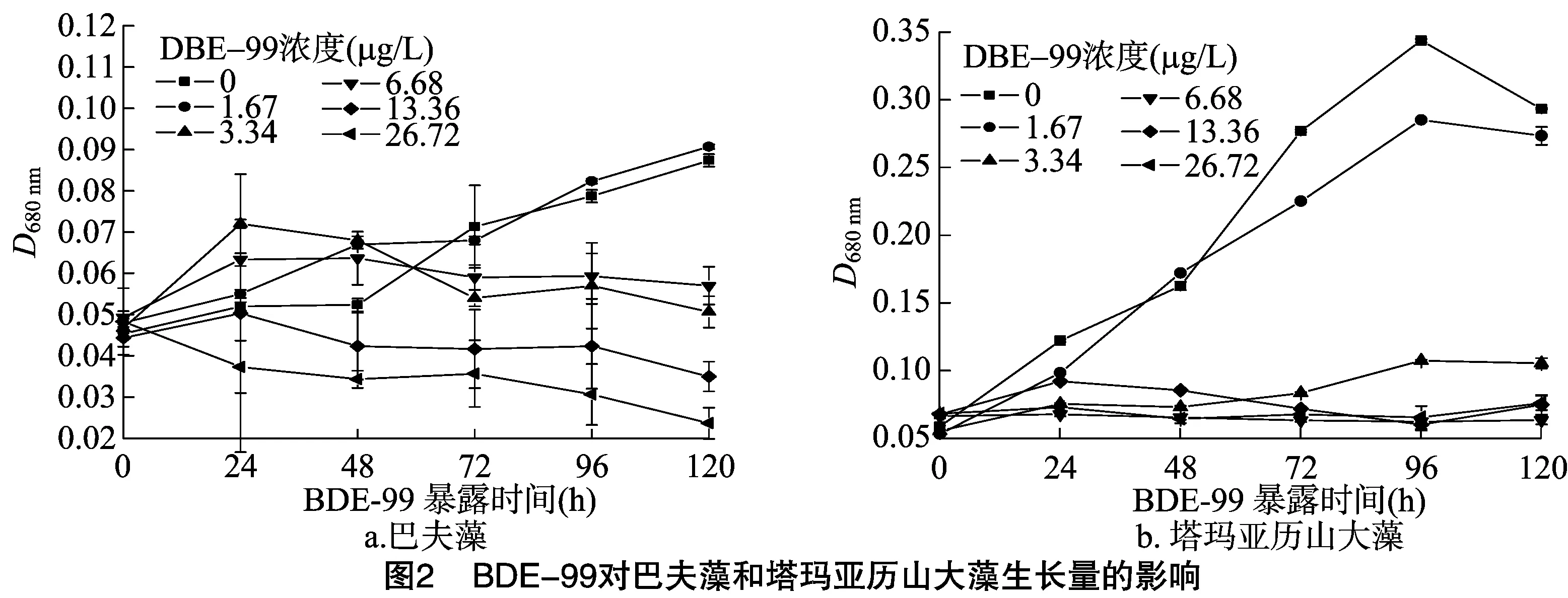
2.2 BDE-99对2种海洋微藻生长量的影响
如图2所示,随着处理时间增加,1.67 μg/L BDE-99试验组的巴夫藻生长得最好,说明低浓度的BDE-99对巴夫藻有一定的刺激生长作用,120 h 时 26.72 μg/L BDE-99试验组的巴夫藻生长受到最大抑制,抑制率为73%,与对照组相比,经t检验分析,差异极显著(P<0.01)。除1.67 μg/L BDE-99试验组外,BDE-99对巴夫藻的抑制作用具有明显的剂量效应。随着BDE-99浓度的增加,对塔玛亚历山大藻生长的抑制强度增大。与巴夫藻不同的是,除了1.67 μg/L BDE-99试验组外,其他各个浓度试验组对塔玛亚历山大藻生长的抑制作用均很强,3.34、6.68、13.36、26.72 μg/L BDE-99 试验组对塔玛亚历山大藻生长抑制率分别为64%、78%、74%、74%,与对照组相比,经t检验分析,差异极显著(P<0.01)。
2.3 BDE-99对2种海洋微藻CAT活性的影响
按照第1.2.4节的方法,添加6.68 μg/L浓度的BDE-99处理2种微藻,0~120 h后的CAT活性变化见图3。可以看出,在同一时间条件下,BDE-99对2种微藻CAT活性的影响有差异,巴夫藻CAT活性在处理24 h后开始升高,96 h达到最高值,与对照组相比,增加了47%,经t检验分析,差异显著(P<0.05),120 h后几乎恢复至对照组水平;对于塔玛亚历山大藻,在同一时间条件下,自用BDE-99处理后24 h起,CAT活性即有增加,增加趋势同巴夫藻,96 h达最高值,与对照组相比,增加31%,经t检验分析,差异显著(P<0.05),120 h恢复至对照组水平,略低于对照组。
2.4 BDE-99对2种海洋微藻AKP活性的影响
按照第1.2.4节的方法,用BDE-99处理2种微藻,0~120 h后AKP的活性变化见图4。 可以看出, 随着BDE-99暴露时间的增加,巴夫藻、塔玛亚历山大藻的AKP活性先逐渐升高,巴夫藻的AKP活性于BDE-99处理72 h后达最高值,与对照组相比,升高43%,经t检验分析,差异显著(P<0.05),以后逐渐降低,处理120 h后恢复至对照组水平;塔玛亚历山大藻的AKP活性变化趋势同巴夫藻,AKP活性在处理后48 h达到最大值,与对照组相比,升高40%,经t检验分析,差异显著(P<0.05),处理48 h以后逐渐降低,处理后120 h恢复至对照组水平。


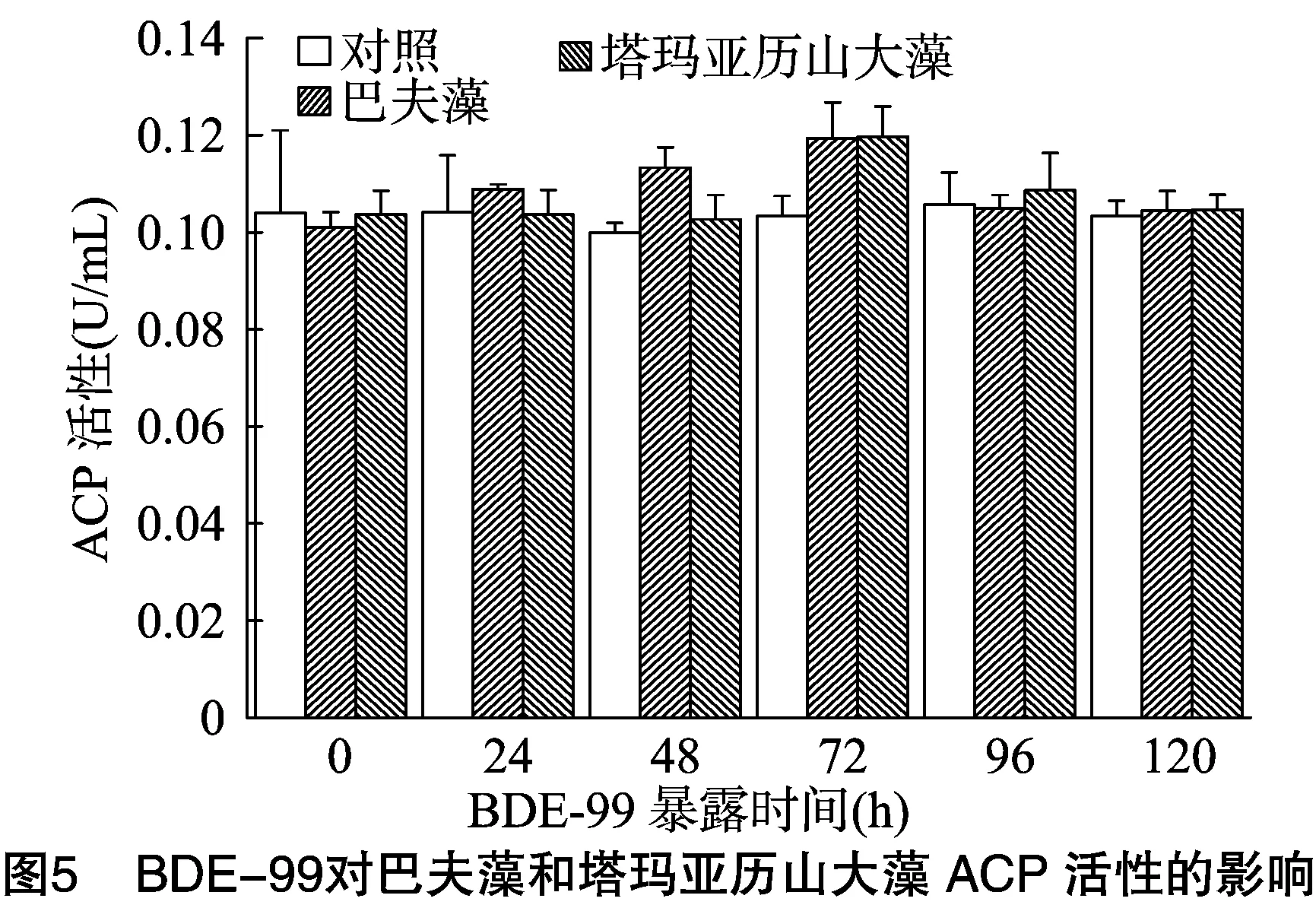
2.5 BDE-99对2种海洋微藻ACP活性的影响
用BDE-99处理2种微藻0~120 h的ACP活性变化见图5。可以看出,随着BDE-99暴露时间的增加,2种微藻的ACP活性变化趋势不明显,巴夫藻、塔玛亚历山大藻的ACP活性均于BDE-99处理72 h达到最高值,与对照组相比,升高15%,经t检验分析,差异不显著,以后逐渐降低,120 h后恢复至对照组水平。
2.6 BDE-99对2种海洋微藻MDA含量的影响
用BDE-99处理2种微藻0~120 h的MDA含量变化见图6。可以看出,随着培养时间的增加,2种微藻的MDA含量整体上逐渐升高,特别是塔玛亚历山大藻的升高趋势非常明显,巴夫藻则在120 h达最高值,与对照组相比,提高56%,经t检验分析,差异极显著(P<0.01);塔玛亚历山大藻同样在BDE-99处理后120 h达最高值,与对照组相比,提高95%,经t检验分析,差异极显著(P<0.01)。

3 讨论
胡恒等进行了BDE-99等5种PBDEs对亚心型扁藻和盐生杜氏藻的毒性试验,结果显示:对照组的2种微藻生长较好,当加入不同浓度的BDE-99后,2种微藻的生长均受到不同程度的抑制,高浓度的BDE-99等抑制盐生杜氏藻生长的作用特别明显[6]。BDE-99等对盐生杜氏藻的生长呈现特殊的“兴奋作用”[7-8]。在本研究中,BDE-99对2种海洋微藻的致毒胁迫也呈现出类似结果,低浓度(1.67 μg/L)的BDE-99对2种微藻均有刺激生长作用,高浓度的BDE-99有强烈的抑制作用并具有明显的剂量效应,26.72 μg/L BDE-99 的试验组对巴夫藻、塔玛亚历山大藻生长的抑制率分别为73%、74%。2种微藻对BDE-99处理表现出相似的时间-剂量效应:随着BDE-99浓度的增大,抑制作用显著增强。绿色巴夫藻表现为随着处理浓度的增大,出现缓慢生长的趋势,波动性较大,抑制作用较低。由此可见,BDE-99对各种海洋微藻的致毒胁迫效应存在种属差异。
本研究设计添加固定浓度(6.68 μg/L)BDE-99处理2种微藻,随着培养时间的递增,2种微藻的ACP活性变化趋势不明显,巴夫藻和塔玛亚历山大藻的ACP的活性均于处理后72 h达到最高值,与对照组相比,分别提高18%、15%。随着BDE-99暴露时间的增加,巴夫藻、塔玛亚历山大藻的AKP活性逐渐升高,巴夫藻于BDE-99处理后72 h达到最高值,与对照组相比提高了43%,塔玛亚历山大藻的AKP活性变化趋势同巴夫藻,AKP活性在BDE-99处理后48 h达到最大值,与对照组相比,提高了40%。在同一时间条件下,BDE-99对2种微藻CAT活性的影响有差异,处理后96 h巴夫藻、塔玛亚历山大藻的CAT活性分别增加47%、31%;2种微藻体内的CAT活性增加与BDE99的暴露时间呈正相关趋势,CAT活性在高位持续至处理后96 h,ACP、AKP、CAT活性的变化反而说明2种海洋微藻对BDE-99的致毒胁迫产生应激响应,在短时间内刺激ACP、AKP和CAT活性升高,特别是CAT活性的剧烈变化程度明显,结果与生长量的变化一致。
张智华等指出,小新月菱形藻的CAT活性和MDA含量在蒽菲芘作用下会有不同程度的升高,细胞损伤加剧[9]。任加云等指出,进入生物体中的污染物在分解代谢过程中能够形成多种中间产物,并产生大量活性氧物质,造成生物体的氧化损伤,一些抗氧化防御系统能够转化超氧阴离子自由基,从而使得机体免受损伤[10-11]。在本研究中,用BDE-99胁迫2种微藻,结果显示,2种微藻MDA含量随着BDE-99暴露时间的增加而升高,特别是塔玛亚历山大藻的升高趋势非常明显,巴夫藻在处理后120 h达到最高值,与对照组相比,提高了56%,经t检验分析,差异极显著(P<0.01);塔玛亚历山大藻同样在处理后120 h达到最高值,与对照组相比,提高了95%,经t检验分析,差异极显著(P<0.01)。本研究结果显示,塔玛亚历山大藻对BDE-99的响应较巴夫藻强烈,与上述生长量变化结果一致。本研究设定时间为120 h,由于BDE-99对巴夫藻和塔玛亚历山大藻致毒效应较强,120 h后由于藻体本身的活性减弱,死亡率加剧而导致MDA含量仍然维持在高位。王丽平等也指出,荧蒽胁迫对藻细胞的膜脂质过氧化作用有明显增强的迹象,藻细胞的MDA含量对荧蒽毒性较为敏感,是个潜在的有价值的参考指标[5]。
本研究从浮游藻类的视角,通过研究绿色巴夫藻和塔玛亚历山大藻的生长、部分抗氧化酶活性及MDA含量对 BDE-99 的致毒胁迫的响应,旨在揭示多环芳烃化合物对水环境污染的重要性,并研究了海洋微藻在水环境污染治理及修复中的潜在应用价值。
