1株邻苯二甲酸二丁酯降解内生菌的分离鉴定及降解特性
2019-01-09柴阳阳程江峰余向阳
柴阳阳, 程江峰, 余向阳
(1.青岛科技大学海洋科学与生物工程学院,山东青岛 266042; 2.江苏省农业科学院农产品质量安全与营养研究所,江苏南京 210014)
邻苯二甲酸酯(phthalate ester,PAEs)又称酞酸酯,被普遍应用于保鲜膜、胶水、药品、服装、化妆品等产品的生产中[1-2]。由于大多数PAEs以范德华力或氢键的方式结合到塑料制品中,所以在塑料制品的生产使用过程中很容易释放到环境中,目前在大气、土壤、河流、食品、生物中都有检出,已经成为一种严重的污染物[3-4]。邻苯二甲酸二丁酯(DBP)作为塑化剂中一种重要的增塑剂,对人体以及其他生物具有致畸、致癌、致突变的作用,引起了我国、美国和欧盟的重视,被列为优先控制的污染物[5]。
近几年来,由于DBP的普遍使用,环境中到处都能检测到DBP的残留,给人类健康生活带来了隐患[6]。环境中DBP的水解、光解速度特别慢,而一些微生物可以代谢DBP,半衰期仅为1~3 d,因此,微生物降解被认为是治理DBP污染的主要途径[7]。Xu等报道了1株假单胞菌B-1在10 mg/L DBP浓度条件下4 d能降解96%的DBP[8]。Li等在2006年发现1株红球菌,对100 mg/L DBP降解率达55%[9]。金雷等分离到的H-2在3 d内对100 mg/L DBP的降解率达87.6%[10]。当前,国内外已有大量DBP降解菌的报道,如节杆菌(Arthrobactersp.)、假单胞菌(Pseudomonassp.)、抗辐射菌(Deinococcussp.)、红球菌(Rhodococcussp.)、分枝杆菌(Mycobacteriumsp.)、大头茶菌(Gordoniasp.)、农杆菌(Agrobacteriumsp.)等[11-17],目前,所发现的DBP降解菌主要集中在体外降解,而对植物内生菌的报道尚未发现。
笔者从污染土壤的植株中分离获得1株植物内生菌HBT4,采用生理生化试验以及16S rDNA分析鉴定菌种,测定其对DBP的降解特性及影响因素,旨在为进一步研究内生菌对植株中DBP的降解及增强植株的抗逆性和治理环境污染提供借鉴和材料。
1 材料与方法
1.1 材料
1.1.1 供试植株 酸模(RumexacetosaL.)采自江苏省农业科学院内被塑化剂污染的试验田中。
1.1.2 主要试剂 邻苯二甲酸二丁酯(上海麦克林生化科技有限公司,含量>98.5%);分析纯乙酸乙酯(成都市科龙化工试剂厂);色谱纯乙腈(德国Darmstadt);细菌DNA提取试剂盒(美国OMEGA公司);16S rDNA序列扩增引物由生工生物工程(上海)股份有限公司合成;2×TaqPCR Master Mix由DBI Bioscience公司提供。
1.1.3 培养基 无机盐液体培养基(1 L):0.4 g MgSO4·7H2O,0.2 g FeSO4·7H2O,0.2 g K2HPO4,0.2 g(NH4)2SO4,0.08 g CaSO4,用去离子水定容至1 000 mL,pH值为7.0~7.2。
LB液体培养基(1 L):牛肉膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g。固体培养基分别在上述液体培养基中加琼脂15~20 g/L,pH值为7.0。
1.1.4 仪器设备 MX-F型漩涡混合器及D1008型离心机(SCILOGEX公司),Life Pro基因扩增仪(杭州博日科技有限公司),DYY-6C型电泳仪(北京市六一仪器厂),STARTER 2100型实验室pH计(奥豪斯仪器有限公司),a-1506型紫外分光光度计(上海奥析科学仪器有限公司),Agilent Technologies 1200高效液相色谱仪(美国安捷伦科技公司)。
1.2 DBP降解菌的筛选与纯化
分别将植株的根、茎、叶用自来水冲洗干净,自然风干后进行表面消毒,先用75%乙醇浸泡2~3 min,再用1%NaClO漂洗2~5 min,然后用无菌水清洗3次,收集最后1次无菌水的冲洗液,吸取100 μL涂布至空白LB平板中,放置在 30 ℃ 条件下倒置培养3 d,检查表面消毒是否彻底。将表面消毒的植物样品于灭菌研钵内研磨,将汁液浓度分别稀释至10-2、10-3、10-4、10-5、10-6,分别吸取100 μL汁液均匀涂布于LB平板上,并将所得菌株进行分离纯化。然后分别将菌株接种于一定浓度DBP无机盐培养液中,37 ℃、150 r/min摇床培养,定时测定DBP的残留浓度,选取降解率高的细菌保存待用。
1.3 分离菌株的鉴定
1.3.1 生理生化测定 菌株形态以及生理生化特性测定参照东秀珠等的《常见细菌系统鉴定手册》[18]。
1.3.2 细菌16S rDNA的测序与系统发育树的构建 菌株基因组的鉴定采用16S rDNA序列分析的方法,首先用试剂盒法提取细菌的基因组DNA作为模板,利用16S rDNA通用引物进行PCR扩增,正向引物为27F(5′-AGAGTTTGATCMTG GCTCAG-3′),反向引物为1492R(5′-GGTTACCTTGTTACG ACTT-3′)。PCR反应体系为2×TaqPCR Mix 10 μL,引物27F与1 492R各0.5 μL,DNA模板4 μL,双蒸水5 μL。
PCR反应条件:95 ℃预变性5 min;95 ℃变性1 min,56 ℃ 退火1 min,72 ℃延伸2 min,30次循环;72 ℃延伸 10 min;4 ℃保存。PCR产物的纯化和测序由生工生物工程(上海)股份有限公司完成,引物为27F与1492R,测序方式为双向测序。将测序结果同GenBank数据库中的基因序列进行BLAST比对以获得相似性较高的相关菌株,用MEGA 6.06软件进行多序列比对,构建系统进化树。
1.4 生长曲线测定
挑取斜面菌种接种于100 mL富集培养液中,37 ℃、150 r/min 振荡培养,定时采样测D600 nm。
1.5 菌株的降解特性研究
1.5.1 菌株对DBP的降解及生长规律 将分离纯化后的菌株接种于富集培养基中,在37 ℃、150 r/min下避光培养 24 h,将菌株的菌液离心分离获取菌体,再用0.85%无菌生理盐水冲洗3次,调整菌液D600 nm为1.0。然后将 1 mL 上述菌液接种到50 mL无机盐培养基(DBP含量为10 mg/L)中,测定初始D600 nm和DBP含量,于37 ℃、150 r/min摇床培养,并设置1组不加入菌液的无机盐培养基作为对照,每个处理重复3次。分不同时间取样测定D600 nm及DBP残留量。
1.5.2 DBP高效降解菌的降解条件优化
1.5.2.1 温度 将菌株的菌液离心分离获取菌体,再用无菌生理盐水冲洗3次,调整菌液D600 nm为1.0。吸取1 mL分别接种到50 mL无机盐培养基(DBP含量为10 mg/L)中,在温度分别为25、30、35、40 ℃的摇床于150 r/min培养3 d,以不加菌作为对照,用高效液相色谱法(high performance liquid chromatography,HPLC)测定DBP的含量,同时用紫外分光光度计测定D600 nm。所有试验数据均为3次重复的平均值,数据采用Excel 2013软件进行分析处理。
1.5.2.2 pH值 用1 mol/L NaOH或1 mol/L HCl调节无机盐培养基的pH值分别为4、5、6、7、8、9,灭菌后添加DBP至其质量浓度为10 mg/L,按2%接菌量接入D600 nm=1.0的菌悬液,于37 ℃、150 r/min摇床培养3 d,取样测定培养液中DBP的残留量和D600 nm。每个处理重复3次。
1.5.2.3 接菌量 于无机盐培养基中分别按0.5%、2%、5%、10%的接菌量接入菌悬液。添加DBP至其质量浓度为10 mg/L,调节培养液的pH值为7.0~7.2,于37 ℃、150 r/min 下避光培养,分别于接菌初始和0.5、1、2、3 d取样测定培养液中DBP残留量。每个处理重复3次。
1.5.2.4 DBP初始浓度 将无机盐培养基中DBP的初始质量浓度分别设为2、5、10、20、50 mg/L,按2%的接菌量接入D600 nm=1.0的菌悬液,于37 ℃、150 r/min摇床培养5 d,取样测定培养液中DBP的残留量和D600 nm。每个处理重复3次。
1.6 DBP的提取分析方法
采用高效液相色谱法向待测溶液中加入等量的乙酸乙酯,于180 r/min摇床振荡萃取30 min,静置分层后,吸取 2 mL 上清液于10 mL玻璃离心管中,氮气吹干后用色谱纯乙腈定容至4 mL(稀释2倍),过0.22 μm有机相滤膜后上机测定。
HPLC条件:色谱柱为ZORBA×SB-C18柱(4.6 mm×250 mm,5 μm);流动相V乙腈∶V水=90 ∶10;流速为 1.0 mL/min;检测波长为225 nm;柱温为室温;进样量为 20 μL;在上述条件下DBP的保留时间为4.9~5.0 min。
在上述条件下,溶液中DBP的回收率在92.3%~94.7%。
2 结果与分析
2.1 DBP降解菌的分离筛选
经过分离筛选得到1株DBP降解菌,该菌株能够以DBP为唯一碳源生长良好,命名为HBT4。该菌株呈半透明、杆状,中间有凸起,表面褶皱不规则,质地黏稠、边缘整齐;随着培养时间的延长,菌落呈现白色、表面干燥、扁平、边缘整齐。
2.2 菌种鉴定
利用16S rDNA通用引物,以菌株HBT4 DNA为模板PCR扩增,测序得到长度为1 440 bp的16S rDNA基因片段,在NCBI(美国国立生物技术信息中心网站)上经BLAST同源性比对,发现该菌株HBT4(NCBI登录号为MF351990)基因序列与芽孢杆菌属相似度达99%,构建的系统发育树如图1所示,菌株HBT4与Bacillussiamensisstrain PD-A10亲缘关系最近。结合生理生化试验结果(表1)初步鉴定菌株HBT4为暹罗芽孢杆菌(Bacillussiamensis)。
2.3 生长曲线测定
如图2所示,菌株HBT4在LB液体培养基中滞留4 h后进入对数生长期,对数生长期持续约6 h,随后生长速度有所减缓,到20 h时菌株HBT4达到生长高峰,进入稳定期。生长曲线符合微生物生长规律。
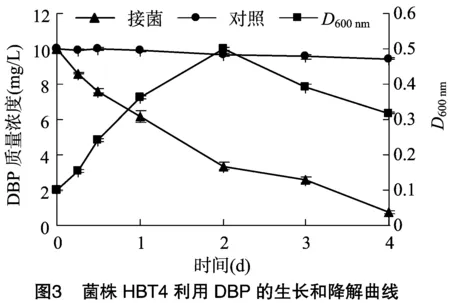
2.4 菌株HBT4对DBP的降解特性及生长状况
由图3可知,以2%的接菌量接入HBT4,在10 mg/L DBP为唯一碳源的无机盐培养基中,菌株HBT4以DBP为唯一碳源和能源生长繁殖,在培养2 d时达到生长高峰,其对DBP的降解率达到65.15%,至培养4 d时,DBP的残留量为 0.76 mg/L,降解率达到91.9%,而在未接菌的处理中,DBP降解率仅为 5.7%。在2~4 d期间,随着大量DBP被降解利用,菌株逐渐进入衰退期,菌株数量减少,主要原因可能是由于DBP的减少以及菌株自身代谢废物的累积导致菌株的生存环境恶化,抑制了菌株的生长繁殖。


表1 菌株HBT4的生理生化特性
注:“+”表示结果呈阳性;“-”表示结果呈阴性。

2.5 HBT4对DBP的降解条件优化
2.5.1 温度的影响 由图4可知,菌株HBT4对DBP的降解效果随着温度的升高而升高,到达最高值以后随着温度升高而降低,最适生长温度为35 ℃,降解率达到87.23%,温度过高过低都会影响菌株的生长及降解活性。这与张颖等关于温度对菌株降解DBP的影响中的结果[19]是一致的,最适温度是35 ℃,过高过低都抑制了菌株的生长和降解效率。

2.5.2 pH值的影响 由图5可知,在pH值为4.0~9.0时,菌株HBT4的生长量先随pH值的升高而升高,在到达最适pH值后,菌株生长量随pH值的继续升高而降低。适合菌株培养的pH值为6.0~8.0,其中pH值为7.0时,DBP降解效果最明显,降解率达78.32%。当pH值为4.0时,菌株几乎不能生长,DBP的降解率不足10%。pH值过高或过低都会影响菌株的生长,同时也会抑制酶活性,影响DBP的降解。
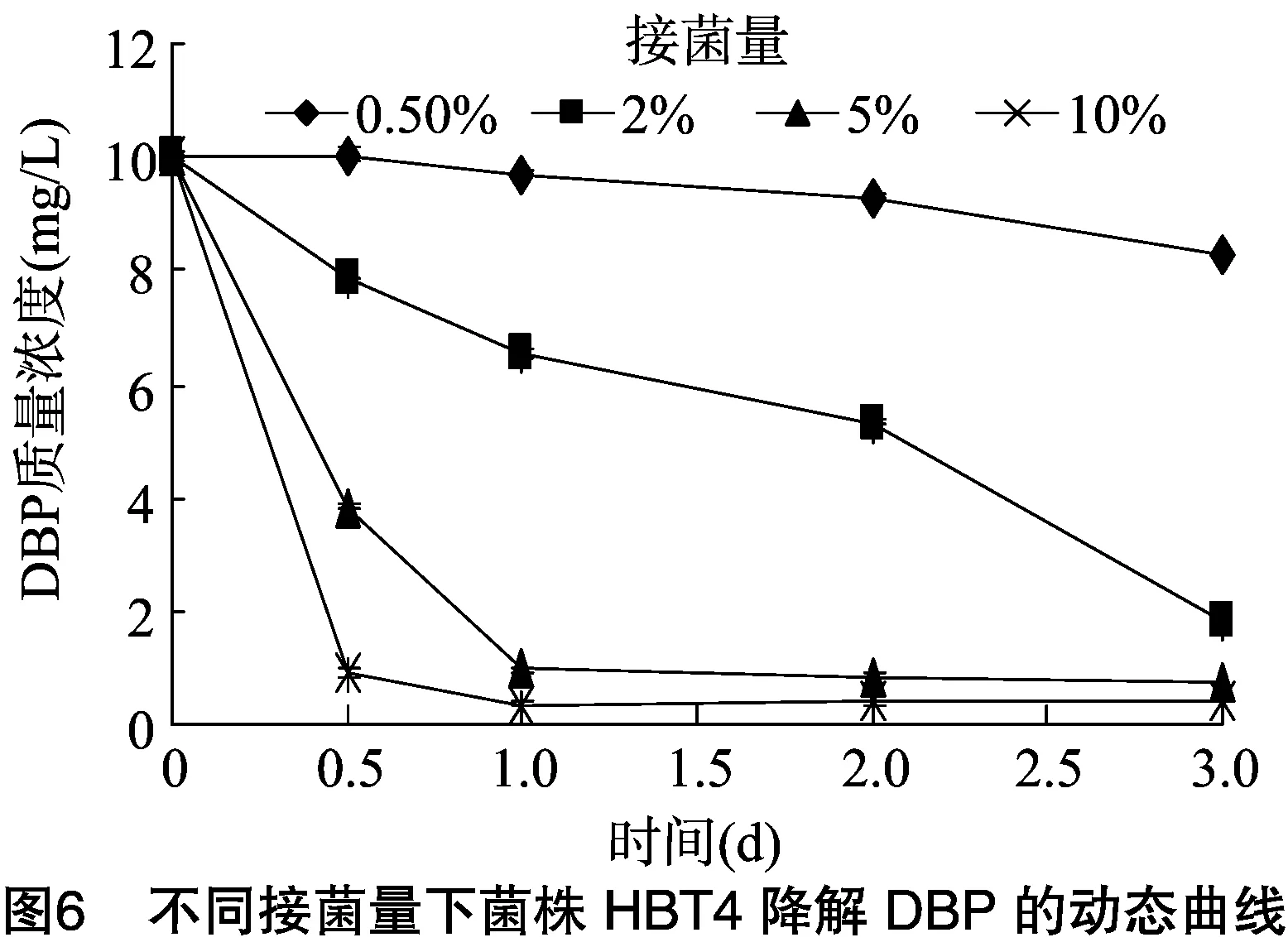
2.5.3 接菌量的影响 由图6可知,在DBP浓度均为 10 mg/L 的培养基中,随着初始接菌量的增加,DBP的降解速率明显提高。在接菌量为0.05%时,菌株HBT4的滞留期延长,DBP的降解速度缓慢,在培养3 d时降解率也只有16.9%,接菌量在2%、5%、10%时,培养3 d的降解率分别为81.8%、92.7%、96.2%。由此表明,随着接菌量的增加,DBP降解速率逐渐增加,并且随着底物浓度的不断降低,降解速率变缓。
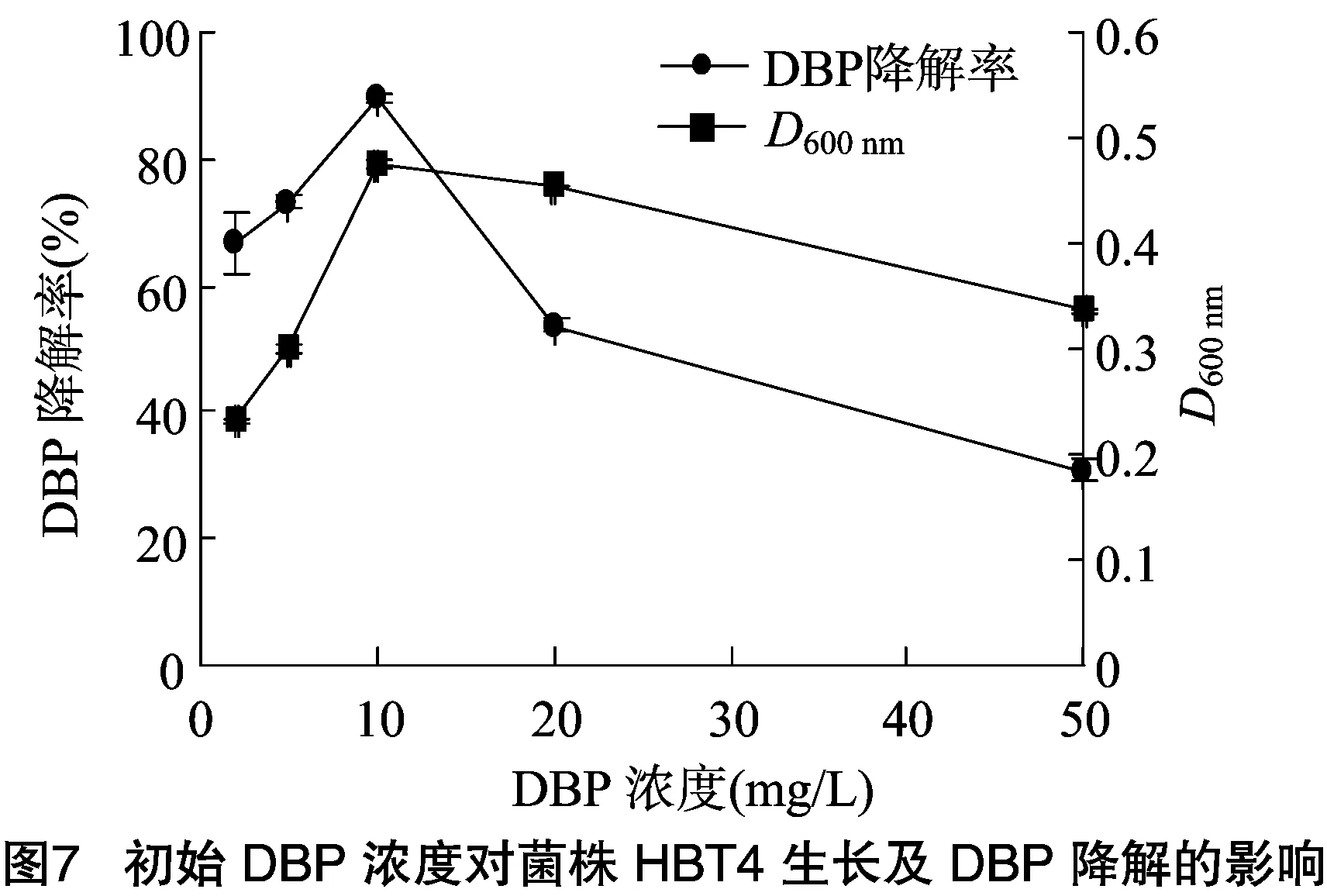
2.5.4 DBP初始浓度的影响 由图7可知,随着初始底物浓度的增加,生长曲线和降解曲线都呈现先增加后降低的趋势。

底物浓度为2、5 mg/L时,由于浓度较低,导致菌株不能大量生长繁殖,从而影响了DBP的降解率,降解率分别为 67.01%、73.19%;底物浓度为10 mg/L时,降解率达到最大值,为89.33%;当底物浓度大于10 mg/L时,由于底物初始浓度较大,对应的降解率随着底物浓度增加而降低;当底物浓度为50 mg/L时,菌株仍可以生长,但生长受到抑制,降解率最低,为30.9%。
3 结论与讨论
本研究从污染土壤的酸模植株中分离到1株降解DBP的内生菌HBT4,经生理生化指标及16S rDNA同源性比对,初步鉴定该菌株为暹罗芽孢杆菌(Bacillussiamensis)。菌株HBT4的生长和降解DBP的最适条件为温度35 ℃,pH值 7.0,底物浓度10 mg/L,同时加大接菌量能明显提高降解效率。已有相关报道表明,Bacillussiamensis能分泌表面活性剂至发酵液,具有生防菌的作用[20]。本研究首次报道了植物内生菌Bacillussiamensis具有DBP的降解功能,进一步丰富了该菌株在环境污染治理方面的用途。
相对于已报道的DBP降解菌[8-10],本研究分离的内生菌HBT4对高浓度DBP的降解效率偏低,这可能与该菌株所在植株中DBP浓度较低、环境对菌株的胁迫压力较小有关。但植物内生菌与宿主植株之间存在复杂的关系。一些植物内生菌具有抑制和杀灭许多病原微生物、促进植株生长、增强宿主植物抗逆境、抗病虫害等作用[21-22],而在重金属污染严重的土壤中植物内生菌能够提高植物对重金属的吸附量,具有促进植物修复的作用[23-24]。如今,利用植物内生菌治理环境污染已成为研究热点,Lodewyckx等利用植物内生菌可以加速根际污染物质的降解,使植物可以自我修复[25];Chen等利用内生菌提高了水生植物对污染水源的修复效率[26]。HBT4是一株性能良好的DBP降解菌,在消除食品塑料垃圾的PAEs残留污染方面具有独特的应用潜力。同时关于植物内生细菌HBT4在植物体内的定殖以及其在植物体内代谢塑化剂及适应塑化剂污染中的作用还需进一步研究。
