时间和密度对公猪精子活力和运动参数的影响
2019-01-09陈永霞杨剑波吴井生
郭 苹, 陈永霞, 马 静, 杨剑波, 邢 军, 吴井生
(1.江苏农林职业技术学院,江苏句容 212400; 2.江苏省句容市畜牧兽医总站,江苏句容 212400;3.江苏省句容市动物疫病预防控制中心,江苏句容 212400)
精液品质检查是评价公猪种用价值最基本也是最重要的检查方法,检查结果能直接或间接反映公猪的生殖机能状况、利用年限、饲养管理水平、母猪受胎率等情况,因此精液品质检查是猪人工授精技术过程中的一个重要环节,也是保证母猪受胎率的一个重要技术手段,能直接影响到后代的数量、质量和猪场的经济效益[1]。
猪的精液品质检查指标主要包括精液量、密度、活力、pH值等,采用的方法主要是肉眼估测、人工计数等,存在检测时间长、准确性不高、检测指标少等问题[2]。人类的精液品质检查发展迅速,技术成熟,方法可行,设备先进。本试验参照《人类精液检查与处理实验室手册》(第五版)[3],将精子活动力分为前向运动(PR)、非前向运动(NP)和不活动(IM)3个类别,精子活力一般用前向运动的精子百分率表示,精子活动率则用前向运动和非前向运动的精子(PR+NP)百分率来表示。
本试验采用计算机辅助精子分析(CASA)系统进行检测,检测精子运动参数,分析采精后不同时间节点以及不同密度对精子活力、精子活动率、精子运动速度等指标的影响,以期为精液品质检查时间节点和精液稀释时间间隔等研究提供理论依据,同时也为后续的精液处理奠定基础。
1 材料与方法
1.1 试验材料
本试验所用种公猪均来自江苏农林职业技术学院种猪场,其中:长白猪(L)3头、大白猪(Y)3头、杜洛克猪(D)4头、巴克夏猪(B)2头、梅山猪(M)6头,均为成年种公猪(28~38月龄)。每头种公猪每周采精2次,固定采精时间和采精员。试验时间为2016年11月至2017年7月,试验地点为江苏农林职业技术学院种猪场实验室。
1.2 精液采集和指标测定
公猪精液的采集用手握法进行;在采精过程中,弃去前后段精清,收集中段富含精子部分,用4层灭菌纱布过滤精液,采完精后,立即吸取10 μL精液,放入2 μL观察池(标准计数板,8个观察池。每个观察池22 μL,池高20 μm),置于负相差显微镜下观察和检测。
采用西班牙CASA系统进行精液质量分析。测定的主要指标:精子活力指标有PR、NP;精子运动速度指标有曲线速率(VCL)、直线速率(VSL)和平均轨道速率(VAP);精子运动方式指标有线性(LIN)、直向(STR)、摆动(WOB)、头侧摆振幅(ALH)、交打频率(BCF)。检测时,要求精子总数不低于500个。
1.3 分组方式和数据统计
1.3.1 分组方式 时间分组按照精液采集后0、10、20、30、60 min进行,采集的精液放入37 ℃恒温箱中,一直放到检测完毕;密度按照1.0亿个/mL及以下、1.0亿~1.5亿个/mL、1.5亿~2.0亿个/mL、2.0亿个/mL 以上进行分组,分别记作D1、D2、D3、D4组。
1.3.2 数据统计 采用SPSS 19.0软件中GLM程序对各项数据进行方差分析,差异显著或极显著时采用LSD法进行多重比较,结果表示为边际均值±标准差。
2 结果与分析
2.1 时间和密度对精子活力和活动率的影响
在不同时间下,精子平均活力变化情况见表1。前向运动精子比例和精子活动率在采精后即检测时最高,分别为(50.29±2.22)%、(92.29±2.49)%,随后,精子活力下降。10 min后,精子活力和精子活动率分别为(44.70±2.17)%、(86.87±2.43)%,与采精时相比差异不显著(P>0.05)。20 min 后,与0 min时差异达到极显著水平(P<0.01)。与0 min 相比,60 min时的精子活力、活动率降幅分别为29.91%、16.48%。非前向运动精子比例在0~60 min之间变化不明显,差异不显著(P>0.05)。在0~60 min之间,PR和 PR+NP的变化呈现下降趋势,NP变化趋于平稳,变化幅度不大。
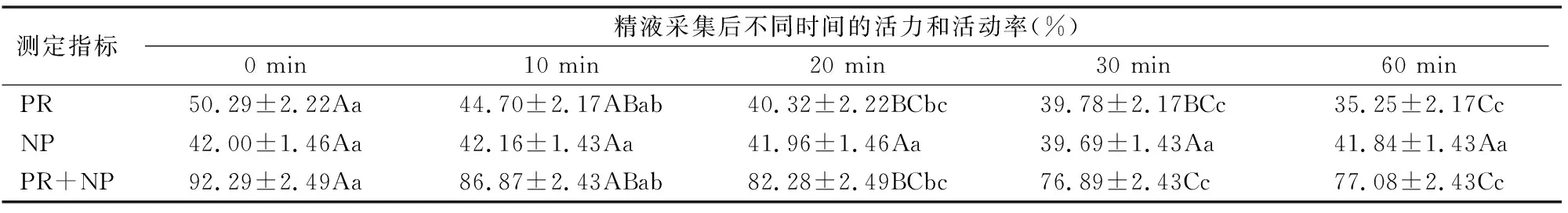
表1 不同时间下精子平均活力和活动率检测结果
注:同行数据后标有不同大写字母、小写字母分别表示在0.01、0.05水平上差异显著。下表(除表8)同。
在比较不同时间下精子平均活力变化情况的基础上,分析了不同原精密度下PR和PR+NP比例变化趋势。由表2可知,在不同原精密度下,PR比例随时间变化大体上均表现为下降趋势,60 min时与采精时相比,D1组下降幅度最大,为23.15百分点,D4组下降幅度最小,为4.34百分点;D1组中,采精后0 min与10 min时精子活力相比,差异不显著(P>0.05),但与20、30、60 min时相比,差异显著或极显著(P<0.05或P<0.01);D4组中,采精后0 min时的PR比例在所有密度组别中最高,为(56.68±3.36)%,60 min后的比例为(52.34±3.36)%。

表2 不同原精密度下PR比例变化结果
由表3可知,精子的活动率在不同密度组别中大体上均随时间表现为下降趋势,其中,D1组别的下降幅度最大,D4组别下降幅度最小,D2和D4组别中,各时间点精子总的活力检测结果差异不显著(P>0.05)。
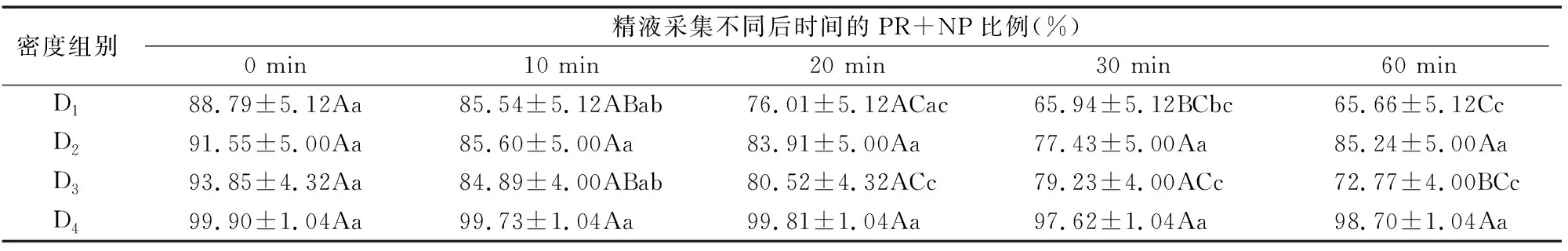
表3 不同原精密度下PR+NP比例变化结果
2.2 时间和密度对精子运动速度的影响
由表4可知,VCL、VSL、VAP等精子运动速度指标均随时间呈现下降现象。在VCL方面,采精0 min时最大,为(50.52±1.73) μm/s,10 min后降至(45.65±1.68) μm/s,但两者间差异不显著(P>0.05),之后继续下降,20 min后降至(43.93±1.73) μm/s,与采精0 min时差异达到极显著水平(P<0.01),60 min后降至(38.85±1.68) μm/s,降幅达 23.10%。在VSL方面,采精0 min时最大,为(16.46±0.60) μm/s,与10 min时相比差异不显著(P>0.05),与采精 20 min 时相比,差异显著(P<0.05),与30、60 min时相比,差异极显著(P<0.01)。在VAP方面,采精0 min时最大,为(27.80±0.95) μm/s,10 min后降至(25.74±0.92) μm/s,差异不显著(P>0.05),与20、30 min时相比,差异显著(P<0.05),与60 min时相比,差异极显著(P<0.01)。

表4 不同时间下精子运动速度检测结果
根据不同时间下精子运动速度和显著性检验结果分析了不同精子密度下VCL、VSL、VAP的时间变化规律,具体结果见表5、表6、表7。
由表5可知,就VCL而言,总的趋势是,无论在哪种密度下,VCL随时间的延长而降低,只是降低幅度不同而已;D2组在各时间节点的平均VCL差异不显著(P>0.05);D4组在60 min时的平均VCL高于其他密度级别不同时间节点的水平。

表5 不同原精密度不同时间精子VCL检测结果
由表6可知,就VSL而言,也呈现随时间增加而降低的现象,D4密度级别平均VSL普遍高于其他密度级别同一时间节点的水平;D2组各时间节点的平均VSL差异不显著(P>0.05);D1组中,采精后0 min时检测的平均VSL水平高于 60 min 时的水平,两者间差异达到极显著水平(P<0.01);D3组中,0 min时的水平显著高于60 min时的水平(P<0.05),但两者与其他各时间节点的差异均不显著(P>0.05)。

表6 不同原精密度不同时间节点下精子VSL检测结果
由表7可知,就VAP而言,D1组中,0 min时的平均VAP水平极显著高于60 min时的水平(P<0.01);D2组中,各时间节点间差异不显著(P>0.05);D3组中,0 min时的水平显著高于60 min时的水平(P<0.05),但两者与其他时间节点水平间差异不显著(P>0.05);D4组中,0 min时的水平最高,为(43.39±3.70) μm/s,显著高于60 min时的(31.07 ±3.70) μm/s(P<0.05)。

表7 不同原精密度不同时间节点下精子VAP检测结果
2.3 时间和密度对精子运动方式的影响
由表8可知,在LIN、STR、WOB、ALH和BCF中,LIN、STR和WOB变化较平缓,上下波动幅度较小;ALH在各时间节点都表现出下降的趋势,但不明显,0~60 min间下降 0.184 μm,降幅为6.73%,差异不显著(P>0.05);在BCF中,0 min 时检测水平最高,为(6.059±0.197) Hz,之后呈现明显下降趋势,至60 min时下降了1.201 Hz,降幅为19.82%,差异极显著(P<0.01),0 min时与20、30 min时比较,差异极显著(P<0.01)。

表8 不同时间下精子其他运动参数检测结果
注:同列数据后不同大、小写字母分别表示在0.01、0.05水平上差异显著。
由表9可知,在不同原精密度不同时间节点下精子BCF检测结果总体呈现下降趋势,D2和D4组中各时间节点水平间差异不显著(P>0.05),采精后60 min时与采精时相比降幅分别为9.53%、13.38%,D1和D3组的下降幅度分别为28.72%、20.89%,与0 min间的差异均达到极显著水平(P<0.01)。
3 讨论
本试验采用CASA系统检测猪精子运动参数,该系统在人类精液检测中已被广泛使用,相对于常规精液分析而言,具有客观性强、准确性高、重复性好等优点,适合用于临床精液标本的检测[4-5],一般30 s内就能完成1个样本的检测。

表9 不同原精密度不同时间节点下精子BCF检测结果
精液标本从采集到分析的时间间隔是影响精液检测结果准确性的重要因素,也是检测前质量控制的重要环节[6]。在人类精液检测上,为确保检验结果的准确性,提供更有价值的参考数据给临床,让各实验室之间的检验结果更具可比性,精液标本从采集到分析的时间间隔应严格控制[7-9],推荐的时间间隔为30 min。根据GB/T 25172—2010《猪常温精液生产与保存技术规范》中的规定,精液采集后应尽快稀释,放置时间不超过15 min。
关于检测时间对精液品质影响的报道,张将等研究认为,精子浓度和圆细胞浓度在精液液化后15、30、45、60、90、120 min 较稳定,精子活力及活动率在30 min内也较稳定,30 min 后精子活力显著下降,45 min后精子活动力也显著下降,精子活力及精子活动率均与检测时间呈负相关[6];邵永等研究表明,30、60、90 min检测的精子活力及活动率均分别显著低于20 min时检测的活力及活动率[10];潘锋等研究显示,15、30、60 min内精子活力及活动率显著下降[11];蒲江波等研究认为,人类精子最佳检测时间为完全液化后的1 h,随着时间的延长,精子的PR和PR+NP均明显下降,下降的主要原因是精子能源供给不足[12],精子活力下降不是呈直线式而是波浪式[12-14]。陈碧等研究了取精后至冷冻前的间隔时间对精子冷冻复苏效果的影响,结果表明精液取出15、30 min后进行冻存的精子复苏率显著高于60 min的[15]。
本研究结果显示,精子活力和精子活动率大体上均表现为随时间延长而降低的趋势,在20 min时均极显著低于 0 min 的检测水平,60 min时两者的检测水平降幅分别达29.91%、16.48%。在不同密度级别下,60 min后精子活力检测结果降幅不一,D1组中达45.45%,D4组中仅为7.66%,60 min 后精子活动率检测结果降幅亦不一,D1组中达 26.05%,D4组中为1.20%。结果表明,密度大的精液缓冲能力强,精子活力降幅小,密度小的精液缓冲能力弱,精子活力降幅大。
VCL、VSL和VAP是以精子头部为参照物,测定其单位时间内精子头部移动距离或相对位移,可以反映精子的运动能力,LIN、STR、WOB、ALH、BCF等指标可以用来反映精子运动方式,所以认为精液在体外放置时间延长不仅降低精子的运动能力,又可以影响其运动方式[10]。
邵永等研究了精液留取后不同时间对精子运动参数的影响,结果显示,BCF在30 min时显著高于20 min时,90 min时VCL显著低于20、30 min时,30、60、90 min时的STR与 20 min 时相比显著降低,90 min时的VAP、VSL分别显著低于20 min时的[10]。
本研究中,VCL、VSL和VAP等精子运动速度指标整体均呈现随精液离体时间延长而下降现象;在VCL方面,精液采集时(0 min)的VCL水平极显著高于20、30、60 min时,在VSL方面,0 min的VSL水平显著高于20 min时,极显著高于精液采集后30、60 min时,在VAP方面,0 min时的VAP水平显著高于20、30 min时,极显著高于60 min时。在LIN、STR、WOB、ALH和BCF中,LIN、STR和WOB变化较平缓,上下波动幅度较小,在ALH中,各时间节点表现出下降的趋势,但不明显,差异不显著(P>0.05),在BCF中,0 min时检测水平最高,为(6.059±0.197) Hz,之后呈现明显下降趋势,至60 min时下降1.201 Hz,降幅为19.82%,差异极显著(P<0.01),0 min 时与20、30 min时比较,差异极显著(P<0.01)。
随着时间的延长,精子细胞脱水,pH值发生改变,渗透压的变化及温度的变化均会造成精子活力、活动率、运动参数等降低,尤其是精浆果糖浓度的降低、丝氨酸蛋白酶活性的改变以及精子DNA的损伤等可能因素的影响,是造成精子活力、活动率和运动参数改变的重要因素[13-15]。
4 结论
本试验中,精子活力(PR)、精子活动率(PR+NP)、VCL、VSL和VAP等精子运动速度指标均表现为随时间延长而降低的趋势,密度大的精液缓冲能力强,精子活力和运动参数降幅小,密度小的精液缓冲能力弱,精子活力和运动参数降幅大,精液品质检查和精液稀释等工作最好在采精后10 min内完成。
