白花蛇舌草ISSR反应体系的建立与优化
2019-01-09高慧新严炯艺王明杰
高慧新, 严炯艺, 王明杰, 田 慧
(广西中医药大学,广西南宁 530200)
白花蛇舌草(HedyotisdiffusaWilld.)为茜草科耳草属植物,常于夏秋采集,洗净,鲜用或晒干[1]。白花蛇舌草产于我国广东、香港、广西、海南、安徽、云南等省(区),多见于水田、田埂和湿润的旷地,始载于《广西中药志》[2]。中医认为其味苦、甘,具有清热解毒、利尿消肿的功效,壮医认为其味苦、甜,可用于通龙路、解热毒、除湿毒、散结消肿[1]。白花蛇舌草的主要成分为有萜类、黄酮类、蒽醌类、甾醇类等,有抗癌、抗氧化和抗炎等作用,临床上常用于治疗多种癌症[3],且效果良好,是一味常用的中药材。
随着分子标记快速发展,越来越多的学者利用分子标记对物种遗传分化进行研究。常见的分子标记有随机引物扩增DNA多态性(random amplified polymorphism DNA,RAPD)、扩增片段长度多态性(amplified fragrment length polymorhism,AFLP)、限制性片段长度多态性(restriction fragment length polymorphism,RFLP)、简单重复序列标记(simple sequence repeat,SSR)、简单重复序列间标记技术(inter-simple sequence repeat,ISSR)等几类。ISSR是由加拿大学者Zietkiewicz等于1994年在PCR的基础上创建的分子标记技术[4],其以微卫星重复序列为引物,通常为16~18个碱基序列,由1~4个碱基组成的串联重复序列和几个非重复的锚定碱基组成,提高了PCR扩增反应的专一性。同时ISSR分子标记具有多态性高、重复高、稳定性好、操作方便及成本低等优点,被视为理想的遗传标记方法[5]。
ISSR-PCR反应易受多种因素的影响,本试验利用单因素结合正交设计的方法,旨在建立适合于白花蛇舌草ISSR-PCR反应的最佳体系,为白花蛇舌草种质资源遗传多态性的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验材料 白花蛇舌草新鲜叶片采自广西中医药大学仙葫校区,并由广西中医药大学中药鉴定教研室主任田慧教授鉴定为茜草科耳草属植物白花蛇舌草(HedyotisdiffusaWilld.)。
1.1.2 试剂与仪器 新型植物基因组DNA提取试剂盒、TaqDNA聚合酶、dNTPs、DNA Marker(D2000)、5×TBE均购自天根生化科技(北京)有限公司;琼脂糖(西班牙);GelRed核酸染料(美国);其他所用试剂均为国产分析纯。ISSR-PCR引物由生工生物工程(上海)股份有限公司合成。
Eppendorf移液枪(德国艾本德生命科学公司),电子分析天平(BSA224S,北京赛多利斯科学仪器有限公司),超纯水机(MILIPORE ZMQS 5001,法国MILIPORE公司),旋涡混合器(XW-80A,上海青浦滬西仪器厂),高速冷冻离心机(SIGMA Sartorius,德国赛默飞世尔公司),紫外分光光度计[UV1780岛津企业管理(中国)有限公司],梯度PCR仪(T100,美国Bio-Rad公司),电泳仪(美国Bio-Rad公司),凝胶成像系统(Gel DocTMXR+,美国Bio-Rad公司)。
1.2 方法
1.2.1 白花蛇舌草植物总DNA的提取 根据新型植物基因组DNA提取试剂盒的操作步骤对试验材料进行植物总DNA的提取,并采用琼脂糖电泳及紫外分光光度法检测总DNA的纯度及浓度,将其稀释至40 ng/μL备用。
1.2.2 单因素条件考察 查阅相关文献[5-7],设定该试验ISSR-PCR基本反应体系组成为总体积20 μL,TaqDNA聚合酶1.0 U,DNA模板量40 ng,dNTPs浓度0.225 mmol/L,引物浓度0.5 μmol/L,Mg2+浓度2.0 mmol/L,10×Taqbuffer 2.0 μL,其余用ddH2O补齐。扩增程序:95 ℃预变性 5 min;95 ℃变性30 s,退火30 s(退火温度由引物Tm值决定),72 ℃延伸2 min,30个循坏;最后72 ℃延伸5 min,4 ℃保存。以初步筛选出的引物UBC826(ACACACACACACA CACC)作为单因素试验及正交试验的引物。对影响白花蛇舌草ISSR-PCR反应体系的5个因素:TaqDNA聚合酶用量、DNA模板量、dNTPs浓度、引物浓度、Mg2+浓度分别设置6个水平浓度梯度,采取控制单一因素变量的方法,初步确定该因素对 ISSR-PCR 的影响。各因素水平如表1所示。将PCR所得产物置于1%琼脂糖凝胶中,75 V电压电泳50 min。使用凝胶成像系统观察并采集图像。
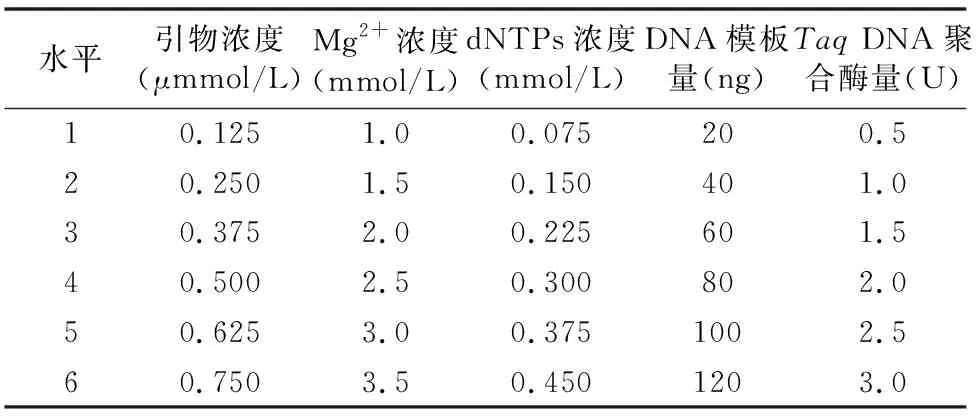
表1 白花蛇舌草ISSR-PCR单因素试验设计
1.2.3 正交试验设计 根据单因素试验的结果,确定各因素的正交试验水平,见表2。采用L16(45)正交试验设计,根据单因素试验结果分别确定5个相关因素的4个水平,共16个处理组,见表3。其基础反应体系和反应程序与单因素试验所用体系和程序均一致。
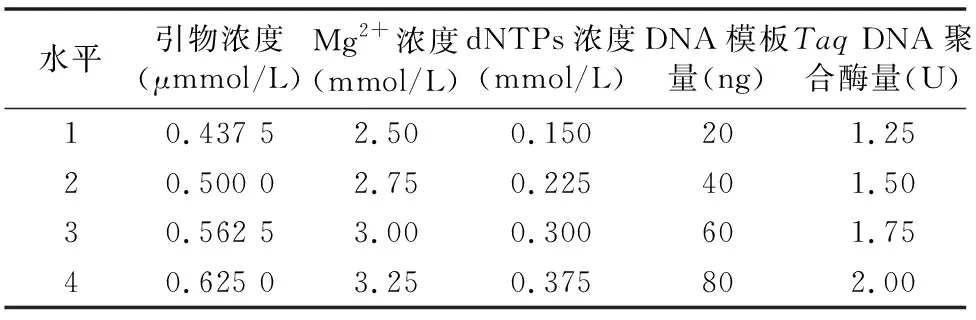
表2 白花蛇舌草ISSR-PCR正交试验水平
1.2.4 退火温度的优化 利用PCR,以UBC826引物的Tm值(52±5) ℃为范围,由PCR仪自动生成8个温度梯度:57.0、56.2、55.0、53.2、50.9、48.9、47.7、47.0 ℃。
2 结果与分析
2.1 DNA提取结果
通过琼脂糖凝胶电泳及紫外分光光度法检测,本试验所提取白花蛇舌草DNA条带清晰、明亮、无拖尾;DNA样品的D260 nm/D280 nm=1.83,介于1.80~2.0之间,说明DNA样品的纯度较高,能满足后续试验的需要。
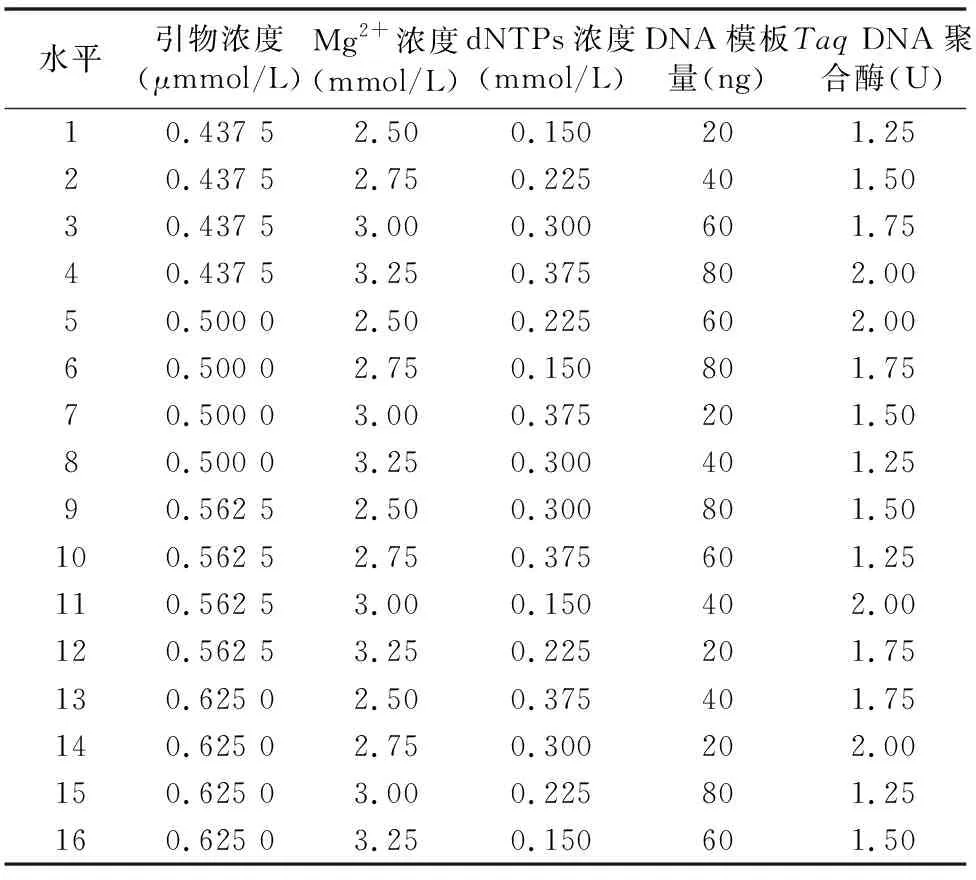
表3 白花蛇舌草ISSR-PCR正交试验设计
2.2 单因素试验结果
由图1可知,引物浓度在0.500~0.625 μmmol/L时,扩增出的条带数多且较为清晰明亮;浓度降低时,条带暗淡,条数减少;浓度增大时,条带异常明亮,粘连在一起,特异性降低。由图2可知,当Mg2+浓度为1.0~2.0 mmol/L时,扩增的条带少,且不清晰,当浓度为2.5 mmol/L时,条带逐渐增多,当浓度为3.5 mmol/L时,扩增条带亮度降低。由于Mg2+是TaqDNA聚合酶的辅助因子,其浓度影响TaqDNA聚合酶的活性,又兼在保证特异性条带和清晰度的情况下,确定ISSR体系中Mg2+浓度2.50~3.25 mmol/L。由图3可知,dNTPs浓度在0.150~0.375 mmol/L时,条带清晰明亮,特异性强,浓度增大时,条带数减少,亮度降低。由图4可知,DNA量在20、40、60、80、100 ng时,条带均清晰明亮,特异性强,但考虑到试验成本,故确定正交试验中DNA量的范围是20~80 ng。由图5可知,TaqDNA聚合酶量在1.5~2.0 U时,条带相对清晰明亮,无拖尾,特异性强。
2.3 正交试验结果
由图6可知,依照遗传多样性分析要求,对正交试验PCR结果依次打分, 结果中条带稳定、清晰、丰富的最佳产物记为16分, 最差的记为1分。编号1~16打分结果依次为 2、12、12、10、3、9、10、9、14、16、7、13、11、12、7、1。根据打分结果算出每个因素同水平下的均值和极差,见表4。


2.4 退火温度的优化结果
由图7可知,当退火温度为56.2~57.0℃时,扩增条带少,部分条带缺失;退火温度为50.9~53.2 ℃时,扩增条带少且模糊,亮度较低;退火温度在47.0~48.9 ℃时,由于温度过低导致扩增条带背景弥漫,难以分辨,当退火温度为55.0 ℃时,条带数目多且清晰明亮,因此确定55.0 ℃为UBC826号引物的最佳退火温度。


表4 各因素水平下的均值和极差
3 讨论与结论
影响白花蛇舌草扩增反应效果的主要因素包括引物浓度、dNTPs浓度、DNA模板量、Mg2+浓度、TaqDNA聚合酶量等。在本试验中,dNTPs浓度对扩增反应的影响最大,dNTPs浓度过高可加快反应速度,同时也增加碱基的错误掺入率和试验成本;反之,低浓度的dNTPs会导致反应速度的下降,但可提高试验的精确性。由于dNTPs可能与Mg2+结合,因此应注意dNTPs浓度和Mg2+浓度之间的关系。如果dNTPs的浓度达到1 mmol/L,则会抑制TaqDNA聚合酶的活性。引物浓度偏高会引起错配和非特异性产物增加、引物之间易形成二聚体,浓度太低又可能得不到扩增结果或产量过低。最佳的Mg2+浓度对于不同的引物和模板都不相同,较高的浓度可以增加产量,但也会增加非特异性扩增,降低忠实度。TaqDNA聚合酶量过高,会引起非特异性产物的扩增;浓度过低则合成产物量减少,得不到预期的PCR产物产量。
本试验运用单因素结合正交设计的方法,首先确定各因素用量或浓度的有效范围,再利用正交设计进行优化组合,确立了白花蛇舌草的最佳20 μL ISSR-PCR反应体系:引物浓度0.562 5 μmol/L,Mg2+浓度2.75 mmol/L,dNTPs浓度 0.375 mmol/L,DNA模板60 ng,TaqDNA聚合酶1.25 U,2.0 μL 10×TaqBuffer,其余用ddH2O补齐,为以后开展白花蛇舌草ISSR多态性的相关研究奠定了基础。
