基于色质联用技术的丝织品染料分析新方法
2019-01-08蔡碧莹罗曦芸徐志珍夏玮张文清
蔡碧莹 罗曦芸 徐志珍 夏玮 张文清


摘要: 文章选用古代常用于染色的六种植物,针对丝织品的染色方法展开研究,扩充建立红、黄、紫色多组颜色的检测体系,最终用于鉴定出土丝织品文物上植物染料的组成成分。为解决丝织品文物丰富颜色的分析问题,文章建立了基于自建精确质量数据库的方法,使用四级杆飞行时间串联质谱(UHPLC-QTOF-MS),对植物染料的化学成分进行快速鉴定,并探究同位素模式对鉴定结果的影响,增强鉴定结果的准确度和可信性。实验结果显示,文章所建立的数据库可以解决大量出土文物的植物染料鉴定问题,对文物的修复和文化的继承都具有十分重要的意义。
关键词: 丝织品文物;植物染料;染料颜色;色质联用;分子数据库
中图分类号: TS193.62 文献标志碼: A 文章编号: 1001-7003(2019)06-0012-07 引用页码: 061103
Abstract: Six plants which were commonly used for dyeing in ancient times were chosen to study the dyeing method of silk fabrics, and red, yellow and purple testing system was established to identify the compositions of plant dyes on the unearthed silk fabric relics. To solve the problem of rich color analysis of silk fabric relics, the precise quality database was established, and UHPLC-QTOF-MS was used to fast identify the chemical compositions of plant dyes. Meanwhile, the influence of isotope mode on the identification result was explored to enhance the accuracy and credibility of identification results. The experimental results showed that the database established in this study could solve the problem of plant dyes identification on unearthed cultural relics, which is of great significance to the restoration and inheritance of cultural relics.
Key words: silk fabric relics; plant dyes; dye color; UHPLC-QTOF-MS; molecular database
红色,是中国的传统颜色,也是人们最钟爱和崇尚的色彩之一,茜草、红花、苏木作为中国古代红色植物染料具有悠久的历史[1-3]。黄色,在中国传统文化里代表帝王之色[4],姜黄、槐米为古代染制黄色的主要植物染料。紫色,在中国古代是一种极其重要的颜色,常为宫廷所用[5],紫草为古代染制紫色的主要植物染料。古代丝织品文物植物染料的科学检测鉴定是中国纺织品科技考古和鉴定工作的重点,明确染色文物染料的种类和植物来源,对文物清洗、修复、复制都有着十分重要的作用。
超高效液相色谱-四级杆-飞行时间串联质谱(UHPLC-QTOF-MS)集合UHPLC快速高效的分离优势[6]和QTOF质谱高分辨、能采集大量物质信息等特点[7]于一体,既适用于与在线精确质量数据库联用,以开发物质的快速筛选和鉴定方法,又可提供全扫描模式下和数据库匹配的一级质谱母离子的进一步碎片信息。因此,对于复杂成分的分离鉴定具有操作简便、准确高效的优势,广泛应用于植物染料和其他复杂物质的化学成分定性分析中[8-9]。
基于异常珍贵的纺织品文物可供萃取分析的染料纤维极为稀少、含量极低的情况,本实验采用模拟古代染色方法染制红色、黄色、紫色真丝织物,并利用自建精确质量数据库对真丝织物剥色液成分进行分析,从而确定各染料染色真丝织物的有效成分,为实际文物染料成分的定性分析和染料植物的归属奠定基础。
1 实 验
1.1 材料与仪器
材料:100%桑蚕丝电力纺(杭州米赛丝绸有限公司),无水乙醇、甲醇、甲酸、乙腈均为色谱纯(上海赛默飞世尔科技有限公司),碳酸钾、柠檬酸、氢氧化钠、明矾(分析纯)、芦丁(纯度>95%)、茜草素(纯度>98%)、卢西定(纯度>99%)、巴西苏木素(纯度>98%)、姜黄素(纯度>98%)、紫草素(纯度>98%)均购自国药集团化学试剂有限公司。茜草、红花、苏木、姜黄、槐米、紫草(上海奥淼中药材有限公司),文物样品(上海博物馆文物保护科技中心)。
仪器:Agilent 1290 UHPLC-6530QTOF-MS/MS(安捷伦科技(中国)有限公司),USC-502型超声仪和DK-S24型电热恒温水浴锅(上海精宏实验设备有限公司),AE24型分析天平(梅特勒-托利多中国),MTN-2800W水浴氮吹仪(赛默飞世尔科技(中国)有限公司),WKZ-4型中药粉碎机(青州市精诚医药装备制造有限公司),Master-S15 UVF超纯水仪(上海和泰仪器有限公司),Coloreye XTH手提式色差仪(上海爱色丽有限公司)。
1.2 染色样品的制备
染色前将桑蚕丝织物在75℃中性水中浸泡20min,并持续搅拌,去掉织物表面可能存在的工业添加物质,用蒸馏水清洗晾干。将染料植物粉碎成20~60目粉末,以增加植物染料与提取溶剂的接触面积,提高提取率[10-12]。
将10g的槐米浸泡在无水乙醇和去离子水(1 ︰ 1)的100mL混合液中,置于室温下浸泡24h。将浸泡后的混合物过滤,除去杂质和沉淀物,即得到澄清黄色植物提取液。茜草、苏木、姜黄、紫草的提取方法同槐米。姜黄、槐米、紫草采用直接染色法,将织物在相应的植物提取液中室温浸泡12h,水洗晾干后即得到染色织物。茜草、苏木采用明矾前媒染法,先将织物浸泡在2g/L的明矾水溶液中,媒染温度为45℃,时间20min,水洗晾干后在相应的茜草、苏木植物提取液中室温浸泡12h,水洗晾干后即得到茜草、苏木染色织物。
将10g红花加到15℃以下的500mL冷水中,揉搓捣烂后,于阴冷处放置12h,绞挤弃去滤液,再加入500mL冷水揉搓,放置30min,重复若干次后过滤得除去黄色素的红花。在红花中加入40mL冷水和04g碳酸钾,充分搅拌揉搓,放置30min后,用纱布袋过滤得到黄褐色提取液。重复操作2~3次,合并提取液。对提取液边搅拌边加入柠檬酸中和,使之为中性。将桑蚕丝织物置于该中性提取液中,染色温度35℃,染色时间30min。染色后水洗,将其放入含有0.5g/L柠檬酸的水中发色20min,水洗晾干后即得到红花染色织物。
1.3 染色样品的处理
采用D65(标准日光,色温为6500K)光源单方向(45°)照明,同一环境下用色差仪测定染色丝织品的色度值,L、a、b值由Coloreye XTH手提式色差仪采集记录,并计算不同批次染色织物的色差值(ΔE),ΔE=[(ΔL)2+(Δa)2+(Δb)2]1/2。
准确称取染色丝织品样品各(10±1)mg置于10mL离心管中,茜草、紅花、苏木、紫草染色后的织物加入1mL甲醇 ︰ 丙酮 ︰ 乙酸(2 ︰ 2 ︰ 1)剥色溶液,姜黄、槐米染色后的织物加入1mL甲醇 ︰ 乙酸(1 ︰ 1)剥色溶液,80℃超声提取50min。将剥色提取液氮吹至完全吹干,再加甲醇复溶到150μL,用1mL注射器吸取剥色提取液,用0.22μm有机相滤头过滤后进行色谱分析。
1.4 精确质量数据库的建立
将60种植物染料成分的分子式和名称整理成表,保存成csv格式的文件。将该文件导入Agilent MassHunter (Version B.06.00, Agilent, USA) 高级质谱处理软件的个人物质数据库及图书馆(Personal Compound Database and Library, PCDL)模块中,软件可自动计算其相对分子质量(精确到小数点后四位),即生成了精确质量数据库(accurate-mass database),用于一级质谱中的分子式匹配。此外,一级质谱中所得到的各物质的保留时间可以继续导入PCDL,以增强后续二级质谱的针对性。
1.5 LC-MS分析条件
1.5.1 UHPLC参数
色谱柱:Agilent Extend C18 UHPLC reversed-phase column (2.1mm×50mm,1.8μm),柱温30℃,流速0.25mL/min,进样量1μL;流动相:A路为0.1%甲酸的水溶液,B路为乙腈溶液。梯度洗脱程序:0~9min,A路比例由95%下降到5%;9~10.3min,A路比例为5%;10.3~10.5min,A路比例由5%上升到95%;检测波长280nm。
1.5.2 QTOF参数
采用QTOF模式的负离子模式扫描(ESI-)采集样品的一级质谱数据,优化好的质谱参数如下:雾化气温350℃,雾化器流速10L/min,雾化气压30psig,毛细管电压3000V,毛细管出口电压150V,扫描范围50~1000amu。内标校正离子:m/z 112.9859 和1033.9881,对分析结果进行实时质量校正。目标二级离子模式(Targeted MS/MS)的碰撞电压值,依据目标离子碎裂的难易程度设定为20eV和30eV。
2 结果与分析
2.1 染色结果
CIELAB色空间是由国际照明委员会(CIE)建立的一种色彩空间,由反映色彩范围的三通道组成[13]。在该空间中L为明度,L值越大表示颜色越白,L值越小表示颜色越黑;a、b为色度坐标,其中a为正值表示颜色偏红,a为负值表示颜色偏绿;b值为正值表示颜色偏黄,b值为负值表示颜色偏蓝。不同批次所染织物的颜色特征值和显色效果如表1所示,其色差变化值均小于1.5个NBS色差单位,目测难以发现色差,说明染色方法重复性较高。在红色织物中,红花染制的织物色度值a最高,茜草媒染后的织物偏橙黄色,苏木媒染后的织物为深红色。在黄色织物中,姜黄上色效果最明显,b值达到81.67,槐米染制的织物为嫩黄色。
2.2 染料成分的分析
2.2.1 剥色提取液的鉴定过程
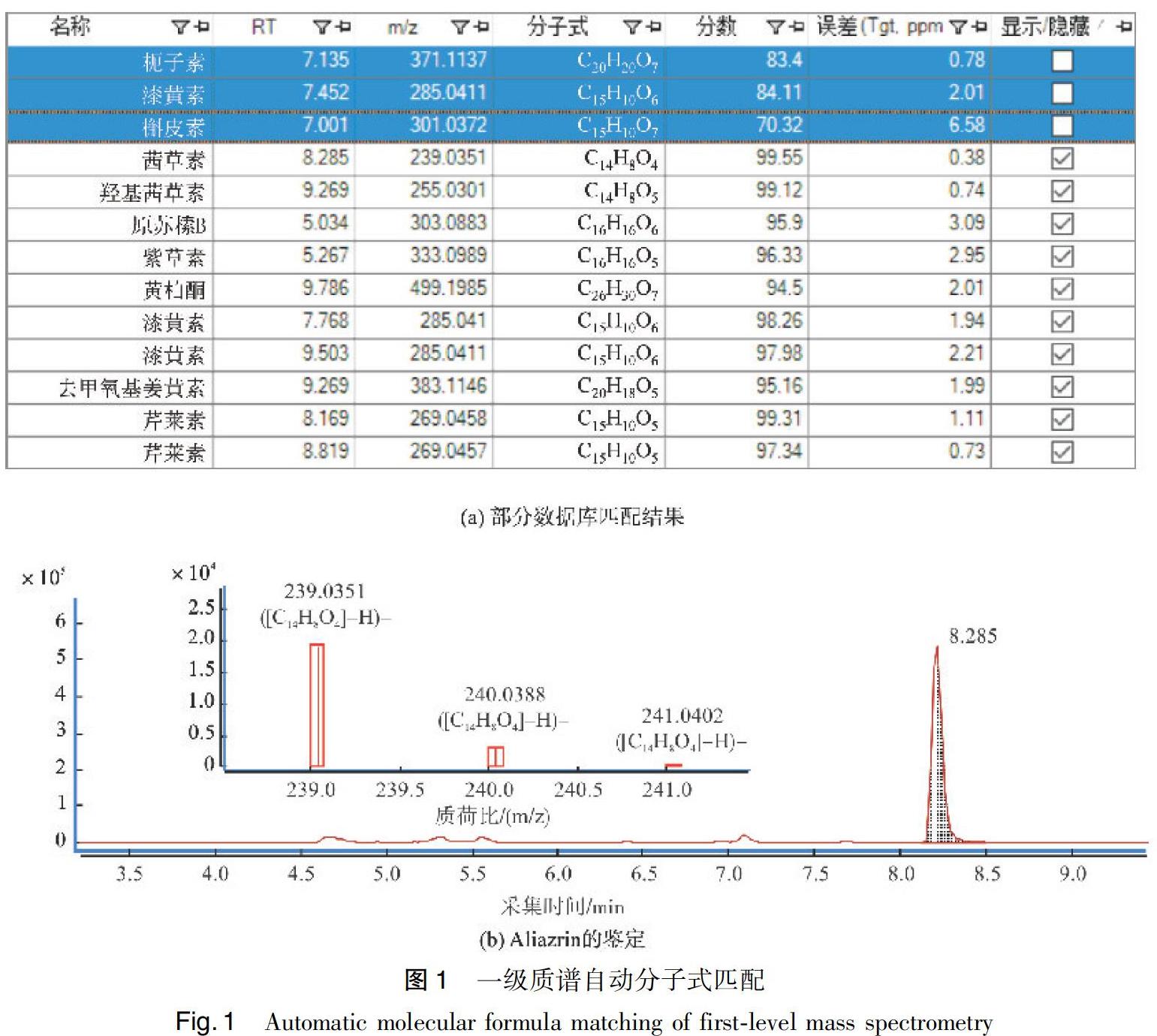
取各染色丝织品剥色液的混合液,进行色谱条件优化。该过程不同于普通液相色谱:在不同液相条件下,分别进行一级质谱自动分子式匹配,匹配色谱峰数量最多的色谱条件即为最优条件。使用优化好的色谱条件分离后,首先进行一级质谱自动分子式匹配。由于大部分染料成分在负离子模式下均可获得较好的电离,故选用负离子模式,使用m/z 1129859和1033.9881的两个内标校正离子,对分析结果进行实时质量校正;并设定分数值小于60.0的分子不执行匹配。共匹配到28种物质,选取分数高于85.0的物质共16种,进一步进行二级质谱匹配。
将各分子离子峰的测定m/z值、一级质谱模式下的保留时间和误差时间(设定为0.5min,即原保留时间±0.5min的保留时间范围内,捕捉到的设定质量数的分子离子均可被进一步碰撞,以避免保留时间漂移造成漏检)保存成csv格式的文件,导入MassHunter,即为二级质谱数据库,QTOF可自动按照该数据库提供的母离子质荷比及保留时间范围等信息,碰撞指定离子,得到它们的子离子信息。将每一种物质的子离子按照碎裂规律进行归类,并将其m/z值与文献、数据库和标准品对照,实现染色样品剥色液中各物质的结构鉴定。以Aliazrin为例,其分数值为99.55(图1(a)),使用提取离子流图模式,可得到其色谱图,进一步施加碰撞能量,产生子离子(图1(b)),将其与文献值和标准品的一级和二级质谱数据对照,确定其为Aliazrin。
2.2.2 关于同位素模式和分数值的讨论
为保证数据库匹配结果的可靠性,需要进一步对匹配结果进行筛查。由于天然同位素的存在,负离子模式下的质谱图除分子离子峰A外,还会出现多种同位素离子峰,对应的m/z值分别为A+1、A+2等。因此,在同位素模式下,一个分子离子峰的同位素离子丰度和几个同位素离子峰的峰间距理论值可以成为判定其分子结构的重要依据。
数据库匹配的得分数由三个因素决定:质量数(即得到的分子离子峰的m/z值是否符合理论值),同位素丰度(即得到的同位素离子的丰度是否符合理论计算值)及同位素峰间距(即得到的同位素离子的峰间距是否符合理论计算值)。分数值由以上三个因素加权计算得到,范围在0~100,分数越高,一级匹配的准确度越高。通常情况下,分数超过60分,则表明匹配得到的分子式是正确的。比如,在对Brazilin(结构见图2,分子式为C16H14O5)的一级质谱鉴定过程中,其理论[M—H]-的m/z值为285.0768,实际测定值为285.0767,相差仅0.0001(一般在高分辨质谱中,测定值与理论值相差小于0.0010才能认为质量数匹配),表明得到的分子离子峰的m/z值符合理论值;同位素的丰度和间距均在软件的预测范围内。测定结果在质量数、同位素丰度和同位素间距这三个方面匹配程度均非常高,因此加权得到的分数值也非常高,达到了99.10,表明分子式匹配结果是正确的,可以进行后续的二级质谱测定。
2.2.3 剥色液成分鉴定结果
得到的二级质谱碎片信息与文献和质谱数据库网站(Chemspider, http://www.chemspider.com/)进行对比,以实现各物质的鉴定。部分物质通过标准品的UHPLC保留时间、一级质谱和二级质譜碎片m/z加以证实。经过标准品比对及文献对照,一共鉴定出10种物质,它们的保留时间、[M—H]-精确质量数、特征子离子碎片、分子式和分数值见表2。
2.2.4 实际文物鉴定结果
古代样品在成分未知的情况下,不可能选用对染料最合适的剥色溶剂。但根据颜色可做出初步判断,根据样品纤维表观颜色为红色,最终采用同苏木等红色丝布的剥色方法,样品处理方法见1.3。经过数据库的匹配分析,实际文物样品中含有茜草染制丝织物的特征染料成分羟基茜草素(Purpurin)和茜草素(Aliazrin),且匹配分数高达98.94%和98.85%,推断染料植物为茜草。由于此次可供液质分析的文物样品纤维十分稀少,一级质谱信号强度低仅为102,不宜进行后续二级质谱分析,但通过数据库的匹配可筛选出特征染料成分,从而进一步推断染料植物。
3 结 论
1)与分析植物染料提取液相比,采用自染色自剥色的方法更接近实际文物的分析过程。通过对染色丝织品中植物染料成分进行准确鉴定,可使染料分析形成更完整的体系,以解决更多出土文物的植物染料鉴定问题,为后续研究奠定基础。
2)与传统液质联用方法相比,本文基于自建精确质量数据库并采用高分辨质谱软件下的同位素模式,通过给出特征同位素分布,可大大缩小假设的原子组成范围,从而增强了鉴定结果的准确度和可信度。即使在严重缺乏标准品的情况下,也可基本保证分子式匹配结果的正确性,进一步减小后续的结构鉴定和物质筛选的难度。对于类似体系,如其他植物提取物的快速鉴定,也同样具有一定的普适性和应用价值。
参考文献:
[1]FORD L, RAYNER C M, BLACKBURN R S. Degradation of lucidin: new insights into the fate of this natural pigment present in Dyers madder (Rubia tinctorum L) during the extraction of textile artefacts [J]. Dyes and Pigments, 2018, 154: 290-295.
[2]LOMBARDI L, SERAFINI I, GUISO M, et al. A new approach to the mild extraction of madder dyes from lake and textile [J]. Microchemical Journal, 2016, 126: 373-380.
[3]徐方圆, 吴来明, 施超欧, 等. 博物馆照明对苏木染色丝绸的影响研究[J]. 文物保护与考古科学, 2017, 29(1): 8-13.
XU Fangyuan, WU Laiming, SHI Chaoou, et al. The effect of museum lighting on fading of Caesalpinia sappan dyed silk [J]. Sciences of Conservation and Archaeology, 2017, 29(1): 8-13.
[4]吕海霞, 徐雪萍, 徐方圆, 等.染色丝织品的植物染料提取工艺优化[J]. 丝绸, 2017, 54(1): 1-8.
L Haixia, XU Xueping, XU Fangyuan, et al. Optimization of plant dye extraction process of dyed silk fabrics[J]. Journal of Silk, 2017, 54(1): 1-8.
[5]LUCA E D, REDAELLI M, ZAFFINO C, et al. A SERS and HPLC study of traditional dyes from native Chinese plants [J]. Vibrational Spectroscopy, 2018, 95: 62-67.
[6]HAN J, WANROOIJ J, BOMMEL M V, et al. Characterisation of chemical components for identifying historical Chinese textile dyes by ultra high performance liquid chromatography-photodiode array-electrospray ionisation mass spectrometer [J]. Journal of Chromatography A, 2017, 1479(6): 87-96.
[7]ZHOU J, YI H, ZHAO Z X, et al. Simultaneous qualitative and quantitative evaluation of Ilex kudingcha C J tseng by using UPLC and UHPLC-qTOF-MS/MS [J]. Journal of Pharmaceutical and Biomedical Analysis, 2018, 155(5): 15-26.
[8]SINGH J, JAYAPRAKASHA G K, PATIL B S, et al. An optimized solvent extraction and characterization of unidentified flavonoid glucuronide derivatives from spinach by UHPLC-HR-QTOF-MS [J]. Talanta, 2018, 188(1): 763-771.
[9]ZHU L X, XU J, ZHANG S J, et al. Qualitatively and quantitatively comparing secondary metabolites in three medicinal parts derived from Poria cocos (Schw) Wolf using UHPLC-QTOF-MS/MS-based chemical profiling [J]. Journal of Pharmaceutical and Biomedical Analysis, 2018, 150(20): 278-286.
[10]崔巖, 刘元风, 郑嵘. 蜀锦的红花染色工艺研究[J]. 丝绸, 2016, 53(10): 23-27.
CUI Yan, LIU Yuanfeng, ZHENG Rong. Research on safflower dyeing technology of Shu brocade[J]. Journal of Silk, 2016, 53(10): 23-27.
[11]吴国辉. 植物染料的分类及提取研究[J]. 染整技术, 2017, 39(3): 7-9.
WU Guohui. Research of classification and extraction of plant dyestuff[J]. Textile Dyeing and Finishing Journal, 2017, 39(3): 7-9.
[12]韩婧, 张晓梅. 模拟古代丝织品上天然染料剥色研究[J]. 文物保护与考古科学, 2012, 24(1): 5-11.
HAN Jing, ZHANG Xiaomei. Studies on the extraction of dyes on ancient textiles [J]. Sciences of Conservation and Archaeology, 2012, 24(1): 5-11.
[13]MCGRATH J R, BECK M, HILL M. Replicating red: analysis of ceramic slip color with CIELAB color data [J]. Journal of Archaeological Science: Reports, 2017, 14: 432-438.
