联合检测EGR-1与HER-2在卵巢癌中的表达及意义*
2019-01-08柯灿灿缪振忠王芬
柯灿灿,缪振忠,王芬
(1.南昌大学,南昌 330006;2.南昌大学第一附属医院妇产科,南昌 330006)
卵巢癌是女性生殖系统肿瘤中死亡率最高的恶性肿瘤[1]。2015年我国约有52100例女性被确诊为卵巢癌,约22500例女性死于卵巢癌[2]。近些年来,我们在卵巢癌的治疗方面取得诸多进展,但晚期卵巢癌患者5年生存率并没有得到有效提高,一直徘徊在30%[3]左右,其最主要的原因在于缺乏早期有效的筛查手段,导致大多数患者确诊时已为晚期。因此,如何提高卵巢癌的早期诊断成为了改善卵巢癌患者预后最有效的途径[4]。肿瘤标志物在肿瘤的诊断、肿瘤病人病情监测以及判断肿瘤预后的方向有着十分重要的作用,近年来,肿瘤标志物的发现依然是肿瘤学者的研究热点[5]。
HER-2为人表皮生长因子受体家族成员之一,它是其它家族成员的共受体,可形成同源或异源二聚体,从而启动一系列信号转导通路,激活酪氨酸激酶活性启动一系列信号转导通路介导细胞的增殖、分化、抗凋亡等过程从而参与多种肿瘤的发生,这一论点已被国内外广泛公认[6]。目前已知Her-2基因扩增和蛋白过表达能帮助判断HER-2阳性乳腺癌、胃癌患者的预后情况[7]。有研究表明,Her-2可作为卵巢癌的1个独立预后因素,Her-2的高表达与卵巢癌的预后呈负相关[8]。但也有研究表明Her-2的过表达与卵巢癌的预后无相关性[9]。本研究可进一步证实Her-2与卵巢癌预后的关系。
早期生长反应因子1(EGR-1)是一种早期生长反应基因,属于转录因子锌指蛋白家族成员。它可以在几分钟内激活一系列信号通路,其活性在数小时内即衰退。渗透压改变、热休克、缺氧、DNA损伤、辐射损伤等应激都会刺激EGR-1的表达。EGR-1通过多种通路调节细胞的增殖、分化和凋亡。但是,目前关于EGR-1在卵巢癌中的发生、发展中起到什么样的作用还未有明确的报道。本研究运用免疫组化的方式检测EGR-1蛋白在卵巢癌的表达情况,探讨EGR-1在卵巢癌的发生、发展的过程中的作用与意义。
1 资料与方法
1.1 研究对象 选取2012年1月到2013年6月80例在南昌大学第一附属医院进行卵巢癌手术的病例,病例临床、病理资料均完整,术前未进行过化疗、放疗和细胞因子等治疗,未合并有其他肿瘤或严重合并症(高血压、糖尿病,其他急慢性疾病等)作为研究组C组。80例OC病人(浆液性癌51例、粘液性癌21例、其他类型的8例)的临床病理资料:患者年龄35~78岁,中位年龄56岁,根据国际妇产科联盟(FIGO)分期:Ⅰ-Ⅱ期23例,Ⅲ-Ⅳ期57例;按照组织学分级为高分化9例,中分化29例,低分化42;有淋巴转移57例,无淋巴转移23例。根据取材的标准,对照组选40例因妇科良性疾病需切除或活检所取得的卵巢良性肿瘤组织为B组,同样选取20例正常的卵巢组织为A组,所有患者都经排除未患有其他恶性肿瘤或合并其他系统急慢性疾病。
1.2 实验主要试剂与试验方法 主要试剂:兔抗人EGR-1多克隆抗体和兔抗人HER-2多克隆抗体购自美国ABclonal公司进口,浓缩DAB试剂盒购自北京中杉金桥生物公司。
实验方法:将已经收集好的石蜡包埋的组织标本,逐个放置于切片机上,将蜡块与刀刃的位置和角度调好之后,制成5μm,边缘整齐平整的组织切片2张,而且卵巢癌患者蜡块要求每个组织切片中均含有瘤巢。免疫组化的操作步骤按照说明书进行烤片脱水、脱蜡、水化-高温高压抗原热修复-滴加一抗-4°C冰箱中保存过夜-放入PBS缓冲液中清洗后滴加二抗-DBA染色-苏木精复染、分化返蓝——脱水、封片。其中一抗中抗EGR-1抗体稀释浓度为1:100;抗HER-2抗体稀释浓度为 1:150。
1.3 HER-2、EGR-1的免疫组织化学染色结果判定 HER-2的阳性结果主要定位于细胞膜或者细胞浆内,其阳性反应表现棕黄色。根据细胞核或者细胞浆染色的深浅以及染色的范围来进行判定,结果判定如下:⑴按照阳性细胞百分数:阴性则0分,阳性细胞≤5%计1分,6%-50%记2分,50%-75%计3分,>75%则4分。⑵按照切片染色强弱来评分:棕褐色表现3分,棕黄色表现2分,淡黄色表现计1分,无色记录0分。免疫组化阳性分4个等级 (计算方法:⑴⑵):0-2分表现为-(阴),3-4分为+,5-8分为++,9-12分为+++。
EGR-1的阳性结果主要存在于细胞核,棕色颗粒显色位于细胞核才是阳性。根据细胞核染色的深浅以及染色的范围等情况来进行综合的判定。⑴按照阳性细胞百分数:阳性细胞≤25%计1分,25%-50%记2分,50%-75%计3分,>75%则 4分。⑵按照染色染色强度评分标准:细胞不着色记1分;细胞着色稍稍高于背景色记2分;细胞着色强度高于背景色记3分;细胞核着色呈深褐色,明显高于背景色记4分。最终的染色指数为该标本染色阳性细胞百分与染色强度两者的乘积,以染色指数来判定免疫组化的结果:评分为1-2分属于低表达,评分3-16分是高表达。
1.4 随访 研究组患者临床、病理及基本资料齐全建档。所有患者出院后进行随访,手术后第1年,对患者每3个月随访1次;术后第2年每4-6个月1次。截止日期2018年3月,随访期如果患者出现死亡或消失联系不上者则终止随访。
1.5 统计学方法 采用SPSS 20.0统计软件对结果进行统计,计数数据运用χ2检验,5年生存率采用Kaplan-Meier进行分析该二者表达对OC患者预后影响。
2 结果
2.1 HER-2蛋白在3组中的表达 在80例OC患者、40例良性卵巢肿瘤组织、20例正常卵巢组织的石蜡组织切片中,HER-2蛋白表达阳性率分别为 42.5%(34/80)、0.25%(1/40)、0.00%(0/20), 卵巢癌患者与良性卵巢组织以及正常卵巢组织表达有明显的差异,有统计学意义(P<0.05)(如表 1),而良性卵巢组织和正常卵巢组织表达差异(P>0.05)。
2.2 EGR-1蛋白在3组中的表达 在80例卵巢癌患者、40例良性卵巢肿瘤组织、20例正常卵巢组织的石蜡组织切片中,EGR-1均产生表达,但是EGR-1在其中的低表达率分别为 60%(48/80)、10%(4/40)、15%(3/20), 差异有统计学意义 (P<0.05)。 见表 2。
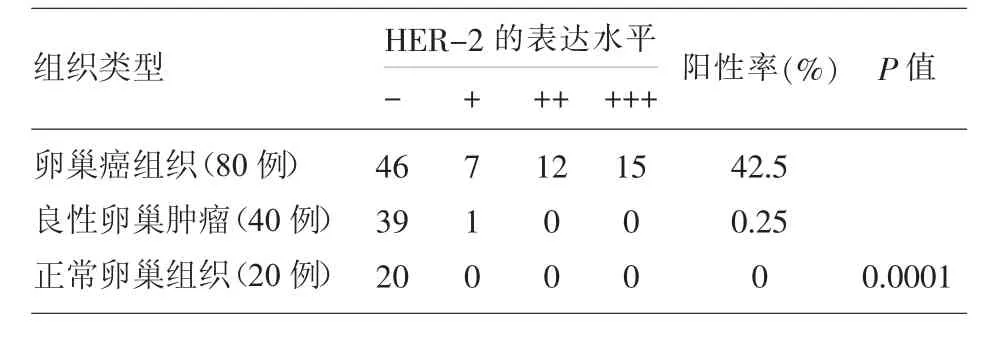
表1 HER-2蛋白在EOC及正常卵巢组织中的表达

表2 EGR-1在EOC及正常卵巢组织中的表达
2.3 HER-2在OC中的表达与临床病理指标间的关系 在OC中,HER-2蛋白阳性率表达组间比较,根据数据统计,HER-2的阳性率的表达均与卵巢癌的FIGO分期、淋巴节是否转移有关 (P<0.05),但是与年龄、病理类型、病理分级无关(P>0.05)。见表 3。
2.4 EGR-1在OC中的表达与临床病理指标间的关系 在OC中,EGR-1蛋白的高低表达组间比较,根据数据统计,EGR-1的低表达率与卵巢癌的FIGO分期、组织分化程度、淋巴节是否转移有关 (P<0.05),但与年龄、病理类型无关(P>0.05)。 见表 4。
2.5 HER-2与EGR-1与OC患者预后的关系 对80例卵巢癌患者随访时间60月,中位随访时间为52月,受访的OC患者5年总生存率是46.1%,中位生存时间是52.8个月。根据Kaplan-Meier生存曲线分析,HER-2阳性表达患者其5年生存率低于阴性表达患者,(20.7%VS 47.8%,P=0.004)。EGR-1低表达患者其5年生存率为20.1%,高表达者为52.6%,组间比较差异有意义(P=0.005)。而HER-2(+)EGR-1低表达组的5年生存率(18.18%)与HER-2(-)EGR-1高表达组的表达组5年生存率(80%)相比,组间差异有统计学意义(P≤0.05),说明HER-2表达以及EGR-1表达的高低可能与预后相关。
3 讨论
卵巢癌是女性最常见的恶性肿瘤之一,死亡率居于妇科恶性肿瘤首位,严重威胁女性健康[10]。卵巢癌起病隐匿,临床上缺乏早期筛查手段,发病人群缺乏特异性,导致70%的患者确诊时已属卵巢癌晚期,而晚期患者5年生存率往往不足30%,但是早期卵巢癌患者5年生存率能够达到90%[1]。因此,寻找卵巢癌的早期肿瘤标记物是改善患者预后的关键。
3.1 HER-2与卵巢癌 HER-2癌基因是一种促癌基因,一般情况下HER-2只会在胎儿时期有表达,但是成年以后,在极少组织内发现其在低的水平表达于细胞表面,正常组织仅可测到少量的HER-2/neu基因,正常情况下,不会导致肿瘤的发生。而有些因为内或者外界因素原因的刺激下,HER-2/neu基因可能还会转化为活性癌基因,从而导致正常细胞的迅速分裂,过度增殖,良性肿瘤中无HER-2过表达,HER-2基因在恶性肿瘤的发生和发展过程中起重要的作用甚至向恶性转化如肺腺癌,乳腺癌,卵巢癌等癌症中存在过度表达[11,12]。
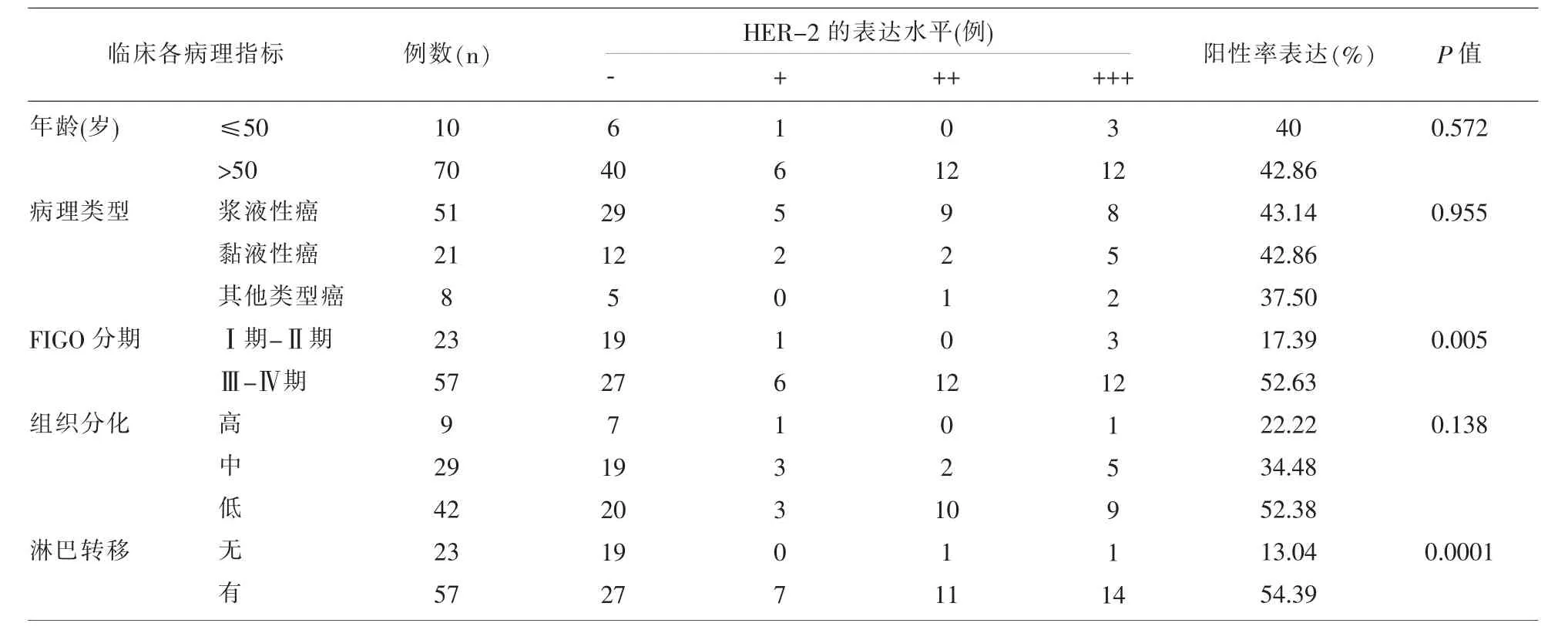
表3 HER-2在OC中的表达与临床各指标之间的关系
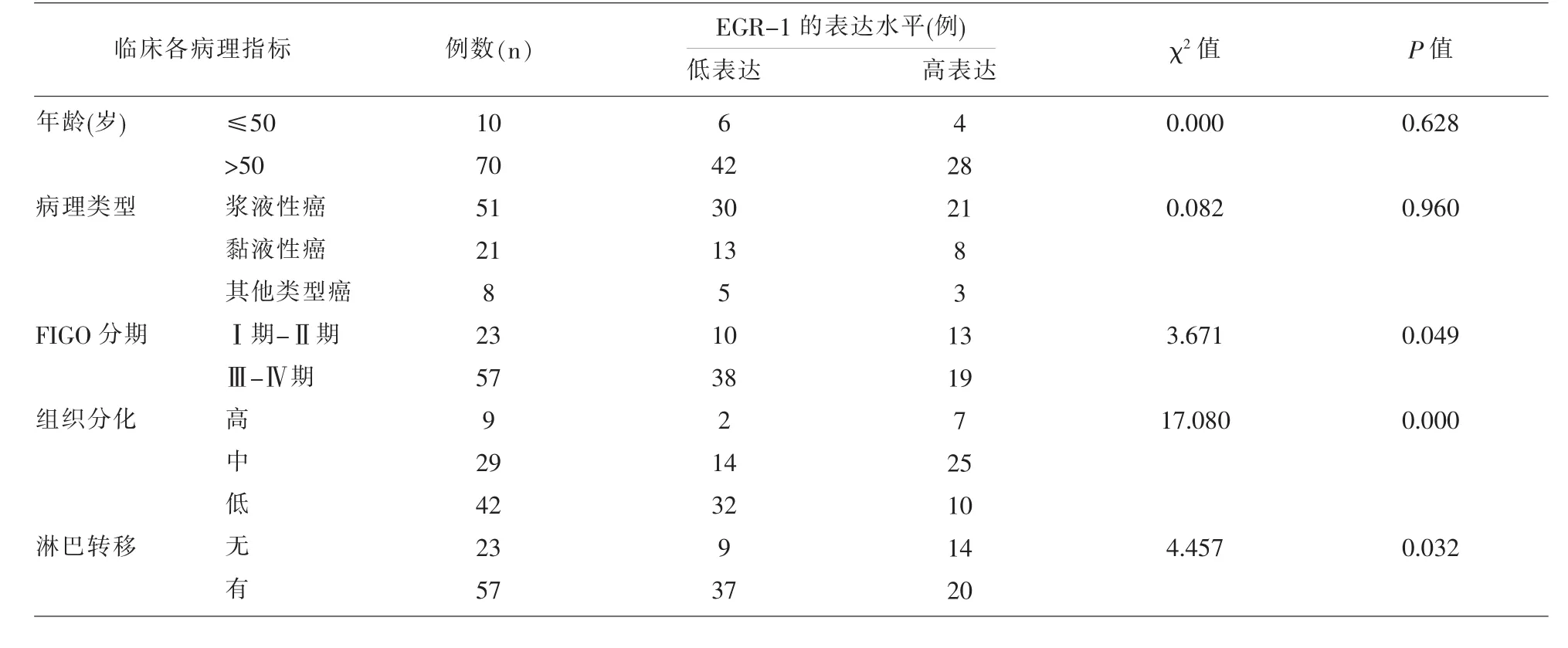
表4 EGR-1在OC中的表达与临床各指标之间的关系

HER-2与临床病理特征以及预后的关系研究结论有很多的不一致。刘云春[13]、李明玉[14]等研究中都表示HER-2蛋白过表达与卵巢癌的FIGO分期、有无淋巴结转移有关,而与组织学的分级、病理学类型没有相关性。但是也有另外一些学者主张[15]的研究结果不支持以上结论,他们认为HER-2与临床病理特征没有相关性。
本研究表明,HER-2的表达随着FIGO分期增高其阳性表达率逐渐增高,HER-2蛋白的表达与卵巢癌患者是否出现淋巴转移有关,出现淋巴结转移,其表达增高,提示其恶性程度高以及患者不良预后。但是其阳性表达与年龄、组织病理分化程度、临床病理类型无关。
3.2 EGR-1与卵巢癌 EGR-1属于即刻早期基因家族成员之一,是一种含有特殊的3个锌指结构的转录因子,该基因定位于5q31,长2.1kb,编码3.3kb成熟的mRNA。EGR-1基因编码的EGR-1蛋白包含DNA结合域、抑制结构域和活化结构域这三个部分。EGR-1的DNA结合域是在锌离子的存在下,锌指结构与DNA序列中的富含GC区 (CGCCCCGC)结合,从而发挥转录调控作用。NGFI-A结合蛋白1或2可以通过与EGR-1的抑制结构域结合从而引起EGR-1生物活性的抑制[16]。
EGR-1能够在血清、胰岛素、内皮素、维甲酸等多种调控因子的作用下发生转录。在参与调控细胞的生长、损伤、修复相关多种基因的表达的过程中同时也受多种因素调控,如电离辐射、缺氧神等[17]。EGR-1基因表达的功能主要在接受外界信号刺激后,基因表达的产物在细胞内的信号传递,通过信号通路的级联反应从而调控下游靶基因的表达,实现相关的生物学功能[18]。
细胞的正常生长以及分化均与EGR-1基因的激活紧密相关,而正常细胞的失分化是肿瘤发生发展的过程中的重要环节。研究发现,EGR-1蛋白结合位点位于含有多种生长因子基因和原癌基因的启动子区域中,因此,EGR-1基因的激活与肿瘤的发生可能有关。Ronski等[19]研究表明,EGR-1在绝大多数的肿瘤中都呈现低水平的表达,例如肺癌、纤维肉瘤及平滑肉瘤、甲状腺癌、胶质母细胞瘤、乳腺癌等,在人恶性骨髓瘤和ER阴性乳腺癌中EGR-1基因甚至是无表达的,对于这些肿瘤来说,EGR-1可能起到抑制肿瘤细胞生长的作用。在乳腺癌细胞中EGR-1是呈低表达状态的,但是在服用他莫昔芬治疗后EGR-1与正常乳腺组织的表达水平没有统计学的差异[20]。Levin等[21]研究发现,非小细胞肺癌组织中EGR-1表达量明显是低于癌旁组织,这个结果提示EGR-1表达的下调与肺癌发生是有密切关系的。既往的实验研究也已经证实了EGR-1可以抑制多种肿瘤细胞的生长,如肝癌、乳腺癌、纤维肉瘤、胶质母细胞瘤、食管癌等[19]。从以上的研究推断。所以我们可以推断,EGR-1可能是这些肿瘤的抑制基因。
本研究我们发现EGR-1在卵巢癌组织中的表达与FIGO分期,分化程度以及淋巴结转移有关,FIGO分期越高,分化程度越低,伴有淋巴结转移,EGR-1表达越低;而与年龄和病理分型无关。这说明EGR-1在卵巢癌中扮演着抑制基因的角色。
EGR-1基因与肿瘤的关系颇为复杂,它与癌基因和抑癌基因的关系、对靶基因调节的分子机制等尚未完全清楚,对放射诱导后相关基因表达变化以及对放射敏感性的影响国内外研究较少,对这些问题的不断深入研究和解决将对真正实现肿瘤个体化放疗将产生重大影响,使广大患者通过基因检测就可预测放疗疗效成为可能。
本研究运用免疫组化的方法检测HER-2,EGR-1在卵巢癌的表达情况,后期实验可以联合检测HER-2,EGR-1在血清中与组织中的表达,观察其是否可以成为新的卵巢癌的肿瘤标记物,为卵巢癌的早期诊断提供新的方法。
