棕鞭藻及其培养滤液对铜绿微囊藻生长及生理特性的影响
2019-01-07施军琼杨燕君董聪聪张红波吴忠兴
施军琼 杨燕君 董聪聪 张红波 吴忠兴
(西南大学三峡库区生态环境教育部重点实验室, 重庆市三峡库区植物生态与资源重点实验室, 重庆 400715)
近年来, 随着水体富营养化的加剧, 国内外许多湖泊均出现了大量的蓝藻水华。蓝藻水华的发生不仅导致水体透明度下降, 水质恶化, 产生异味,对水体的多种用水功能和观赏功能造成严重损害[1]。关于蓝藻水华发生过程和机制的研究已有大量的报道[2—4], 然而, 迄今为止的蓝藻水华的发生机理研究仍未能清楚地阐释。
浮游植物种群或群落的变化不仅与外界环境因素有关, 而且还与其周边的其他生物种群有着密不可分的作用与联系。大量研究表明, 种间关系是决定微藻群落形成的多样性和稳定性的主要因素[5,6]。Pratt[7]研究发现硅藻骨条藻(Skeletonema costatum)引起的赤潮和黄藻金黄滑盘藻(Olisthodiscus luteus)的赤潮交替发生原因是骨条藻的滤液有促进金黄滑盘藻增殖的作用, 而金黄滑盘藻的滤液却明显地阻碍了骨条藻的增殖。对Scandinavian水体调查发现, 小定鞭金藻(Prymnesium parvum)经常在春季硅藻赤潮之后、蓝绿藻赤潮之前暴发[8]。Fistarol等[9]通过模拟实验发现小定鞭金藻的滤液能在几天之内改变赤潮群落的结构, 表明小定鞭金藻滤液可能存在化感作用使群落出现由硅藻向蓝绿藻演替的现象。因此, 研究微藻的化感作用对种群结构的形成、稳定以及水华藻种的演替具有重要的生态学意义。
棕鞭藻(Ochromonas)属于金藻纲 (Chrysophyceae)、棕鞭藻科 (Ochromonadaceae)、棕鞭藻属。研究已经表明其能够抑制微囊藻和蛋白核小球藻的生长[10—14], 但对其化感的研究未见报道。因此,本论文对分离的棕鞭藻及其培养液对微囊藻的生长及生理特性的影响展开研究, 旨在了解棕鞭藻对微囊藻的生长、繁殖的生态效应, 为揭示生态系统中生物之间的复杂关系提供一定的理论依据, 也为微囊藻水华的形成和控制提供参考。
1 材料与方法
1.1 藻种来源和培养条件
铜绿微囊藻FACHB-905(Microcystis aeruginosaFACHB-905)来自中国科学院水生生物研究所淡水藻种库。棕鞭藻(Ochromonassp.)分离于重庆北碚一公园形成微囊藻水华的水体。藻种在光强为25 μE/(m2.s), 温度为(25±1)℃, 光周期为L∶D=12h∶12h的BG11完全培养基[15]中培养至对数期进行共培养和滤液实验。
1.2 实验设计
实验分为共培养和滤液培养2部分。在共培养实验中, 棕鞭藻细胞密度保持不变, 为0.5×106个/L,微囊藻细胞密度分别设置为2.13×106、0.5×106和0.125×106个/L, 使得棕鞭藻和微囊藻接种比例为1∶4、1∶1和4∶1。按比例接种到250 mL的锥形瓶中,在25℃、光周期L∶D=12h∶12h条件下混合培养, 单独培养的棕鞭藻和微囊藻作为对照, 每天取样, 用浮游植物计数框对两种藻的密度进行统计, 实验处理4d。
滤液培养: 棕鞭藻按照1×105个/L初始密度, 在25℃、光周期L∶D=12h∶12h条件下, 培养至稳定期后, 过滤, 去除棕鞭藻, 然后把棕鞭藻培养液用孔径0.22 μm的GC微孔滤膜抽滤, 得到的即为棕鞭藻无细胞培养滤液。取铜绿微囊藻80 mL置于250 mL锥形瓶中, 试验处理组添加30 mL棕鞭藻培养滤液,对照组添加30 mL BG11 培养基, 保持培养液总体积为150 mL。试验组和对照组藻密度在试验起始时无显著差异(P> 0.05)。置于光照培养箱中, 实验处理7d。培养条件同上, 所有操作过程均在无菌状态下进行。
1.3 微囊藻粗酶液制备
取各处理藻样30 mL, 在4℃, 10000 r/min冷冻离心7min, 去上清液后, 加入1 mL的磷酸缓冲溶液(PBS pH 7.0), 液氮研磨, 再用PBS定容至3.0 mL,4℃离心, 上层清液即为酶液, 酶液用来测定丙二醛、过氧化氢酶活性及可溶性蛋白等指标。
1.4 丙二醛(Malondialdehyde, MDA)含量及过氧化氢酶(Catalase, CAT)的活性测定
膜脂过氧化的产物之一丙二醛(MDA), 其浓度的变化常作为脂质过氧化指标, 表示细胞膜脂过氧化过程和对逆境条件反应的强弱, 以每毫克蛋白MDA含量为单位[16]。过氧化氢酶采用钼酸铵法,结果以每毫克蛋白质使反应体系在1h内在365 nm的吸收值下降0.1为1个酶活单位表示[17]。
1.5 可溶性蛋白含量及胞外多糖(Extracellular polysaccharides, EPS)测定
可溶性蛋白含量测定含量采用考马斯亮蓝结合法测定[18]。胞外多糖的测定采用苯酚-硫酸法[19]。
1.6 细胞计数
每天定时取出1 mL均匀的培养液, 用5%甲醛固定, 并在显微镜下细胞数通过浮游植物计数框在Olympus CX41显微镜进行计数, 平行计数3—5 次,每次误差<15%, 取平均值作为其细胞数。
1.7 数据统计
所有实验重复3次, 数据中的“±”表示标准偏差(SD)。显著性检验由Origin 6.1 (Microcal Software Inc.)的Statistic程序进行one way-ANOVA统计,P<0.05时表示差异显著,P<0.01时表示差异极其显著。
2 结果
2.1 共培养过程棕鞭藻与微囊藻的种群动态
分离到的鞭毛藻类, 藻体不透明, 具有2个色素体, 片状、周生, 色素体淡黄色; 球形、椭圆形或卵形, 具有2根不等长的鞭毛, 从细胞顶部伸出; 长鞭毛25—37 μm, 平均28 μm左右, 短鞭毛7—12 μm, 平均9 μm左右。一般藻细胞直径为15—25 μm, 平均20 μm, 个体大小因吞噬物的多少和不同变化较大。在靠近鞭毛基部, 有一个伸缩泡(图 1A)。因此,将其归为金藻门(Chrysophyta)、金藻纲(Chrysophyceae)、色金藻目(Chromulinales)、棕鞭藻科(Ochromonadaceae)、棕鞭藻属(Ochromonas)。当该藻与微囊藻共同培养, 能够大量摄食微囊藻, 一个棕囊藻细胞内甚至可以发现7—8个微囊藻细胞(图 1B)。
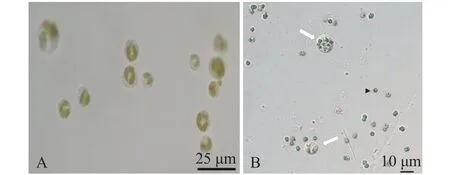
图 1 摄食微囊藻前后的棕鞭藻形态Fig. 1 The morphology of Ochromonas sp. before and after grazing Microcystis aeruginosa
当按3种不同细胞密度比例(1∶4、1∶1和4∶1)培养微囊藻和棕鞭藻, 连续培养 4d, 每天计数 1次, 统计微囊藻和棕鞭藻的种群动态变化, 并绘制种群动态变化曲线 (图 2)。从图中可以看出, 棕鞭藻共培养时的生长状况都比单独培养的对照组好, 而微囊藻共培养后生长状况较差, 细胞密度到第4天时降到最低值。

图 2 不同接种密度对微囊藻和棕鞭藻细胞数的影响Fig. 2 The effect of different inoculated density on both Microcystis and Ochromonas
当棕鞭藻与微囊藻的细胞密度比为 1∶1 时( 图2A) , 4d后, 对照组微囊藻和棕鞭藻细胞数分别从0.5×106和0.5×106个/L增加到1.87×106和0.79×106个/L, 增加了约3.7和1.6倍。在共培养条件下, 微囊藻细胞数迅速降低, 由原来的0.5×106个/L下降到0(P<0.01); 而棕鞭藻细胞数则显著增加, 由原来的0.5×106个/L增加到1.43×106个/L, 增加了约2.9倍(P<0. 05)。当棕鞭藻与微囊藻的细胞密度比为 1∶4时(图 2B) , 4d后, 对照组微囊藻和棕鞭藻细胞数增加了约3.5和1.6倍。在共培养条件下, 微囊藻细胞数先增加后迅速降低, 到第2天达到最高值 (P<0.05); 而棕鞭藻细胞数则显著增加, 由原来的0.5×106个/L增加到1.81×106个/L, 增加了约3.6倍(P<0. 05)。当棕鞭藻与微囊藻的细胞密度比为 4∶1时(图 2C) , 4d后, 对照组微囊藻和棕鞭藻细胞数增加了约3.7和1.6倍。而在共培养条件下, 微囊藻细胞数则迅速降低(P<0.01); 棕鞭藻细胞数则显著增加,由原来的0.5×106个/L增加到1.29×106个/L, 增加了约2.6倍(P<0. 05)。
2.2 棕鞭藻胞外滤液对微囊藻生理特性的影响
棕鞭藻胞外滤液对微囊藻的生长影响 对单独培养的微囊藻以及棕鞭藻培养液处理的微囊藻的细胞数进行计数, 结果表明(图 3)单独培养的微囊藻细胞数表现出一直增加的态势, 培养7d后,细胞数增加约5.5倍(P<0.01); 然而, 棕鞭藻培养液处理7d后, 微囊藻细胞数由初始的(2.72±0.65)×106个/L增加到(7.83±0.08)×106个/L, 增幅约为2.9倍(P<0.05)。
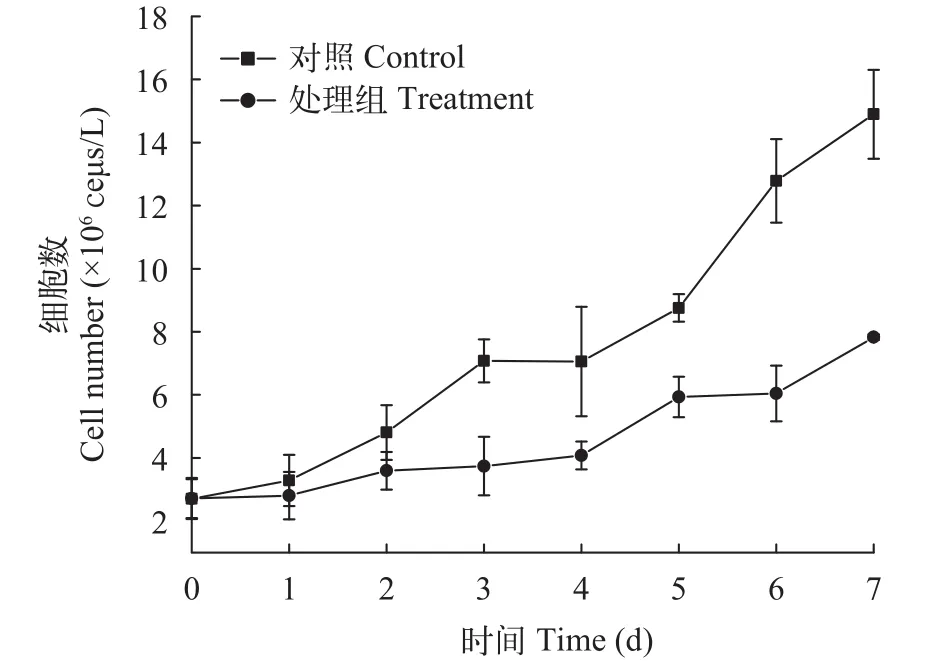
图 3 不同处理下微囊藻细胞数变化Fig. 3 Changes of cell number in Microcystis aeruginosa at different treatments
棕鞭藻胞外滤液对微囊藻的丙二醛(MDA)含量及过氧化氢酶(CAT)活性的影响如图 4所示, 单独培养的微囊藻MDA含量和CAT活性一直保持较低的水平, 处理7d后, 差异不显著(P>0.05);而棕鞭藻培养液处理微囊藻7d后, MDA含量由初始的(1.52±0.08) μmol/mg proteins增加到(13.98±0.69) μmol/mg proteins (P<0.01, 图 4A)。CAT活性由初始的(0.05±0.08) U/mg proteins增加到(0.46±0.05) U/mg proteins, 增加了8.2倍(P<0.01, 图 4B)。
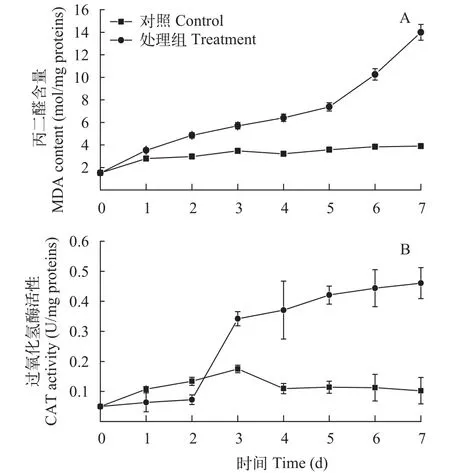
图 4 不同处理下微囊藻丙二醛(MDA)含量及过氧化氢酶(CAT)活性变化Fig. 4 The change of malondialdehyde (MDA) and catalase(CAT) in Microcystis aeruginosa at different treatments
棕鞭藻胞外滤液对微囊藻的胞外多糖(EPS)的影响 如图 5所示, 单独培养的微囊藻, 3d后胞外多糖含量比初始时含量约增加了2倍, 之后胞外多糖含量增加减缓(P>0.05); 然而, 棕鞭藻培养液处理的微囊藻胞外多糖显著增加, 7d后胞外多糖含量由初始的(1.10±0.13) pg/cell增加到(6.04±0.17) pg/cell,增加了449.09%(P<0.01)。

图 5 不同处理下微囊藻胞外多糖含量的变化Fig. 5 The extracellular polysaccharides of Microcystis aeruginosa at different treatments
3 讨论
3.1 棕鞭藻与微囊藻种群动态变化
1973年, Daley等[10]在开放体系中培养蓝藻组囊藻(Anacystis nidulans)时发现接种少量的自身污染物(Ochromonas)后, 组囊藻在6-24h内细胞生物量降至极低水平, 首次发现了棕鞭藻的吞食作用。随后, Baeka等[11]比较了棕鞭藻对有毒和无毒微囊藻的摄食。杨晓景等[12]研究发现滇池水体分离的棕鞭藻(Ochromonassp.)对惠氏微囊藻(Microcystis wesenbergii)具有很强的吞食能力, 共培养至6d时,微囊藻去除率达到90%以上。本研究也发现铜绿微囊藻FACHB-905与棕鞭藻共培养后, 微囊藻细胞数第4天显著降低, 约减少为初始细胞数的90%以上, 且效果随着微囊藻浓度的变化而变化(图 1)。同时, 本研究也发现当棕鞭藻共培养后, 细胞数显著高于单独培养(图 1), 表明棕鞭藻不仅能够自养生长, 而且能够异养生长, 且异养生长显著高于自养生长, 进一步支持了前人研究结论, 即棕鞭藻对微囊藻较强的摄食能力。此外, 彭玉辅在滇池(海埂公园)近岸水域水华发生区分离到能够摄食微囊藻的棕鞭藻, 并研究在不同的环境条件下棕鞭藻对惠氏微囊藻的吞食效果, 发现棕鞭藻的最适吞食温度约为30℃, 且棕鞭藻浓度越大, 吞食微藻的作用越明显[14]。这表明棕鞭藻和微囊藻能够共存于同一个生境, 且对微囊藻具有摄食能力, 因此具有控制藻类水华的潜能。然而, 刘新尧等[19]认为不像营养源控制(下行调控)和“生物操纵”等会对湖泊生态系统产生根本的改变, 而使用食藻生物控制法不仅能短期内控制藻类生物量或者阻止藻类大量增殖而且也不影响湖泊生态系统, 具有潜在的优势。综合本研究和前人研究结果, 棕鞭藻能够摄食微囊藻,因此可作为潜在的藻类水华控制生物, 抑制早期藻类大量增殖。然而, 由于湖泊蓝藻水华的复杂性,蓝藻水华的治理绝非易事。控制和治理蓝藻水华,不仅要对藻类本身的生理学和生态学有足够的认识, 而且要对藻类周边环境的生物地球化学、水化学、以及湖泊生态学等方面全面的了解。因此, 利用食藻生物控制蓝藻水华目前仍有许多实际应用问题亟待去解决。
3.2 棕鞭藻培养液对微囊藻生理特性的影响
Tang等[20]认为生理信号是低营养级生物觉察摄食压力形成自我保护主要方式。Keating[5]指出,浮游植物之间的相互作用是通过分泌胞外有机物的方式实现的。大量的研究表明, 一些藻类在生长过程中会通过不断释放脂类、氨基酸、有机磷酸、碳水化合物以及挥发性物质等多种胞外代谢产物(Extracellular products, ECP), 改变周围环境,从而影响其他种群的生长[21,22]。Wang等[6]认为化感作用对海洋微藻以及赤潮的暴发、消退具有重要的生态学意义。本研究发现棕鞭藻培养液处理的微囊藻的生物量的降低(图 2), 表明棕鞭藻培养液抑制了微囊藻的生长。孙颖颖等[23]发现球等鞭金藻存在不饱和双键的共轭结构物质能够抑制三角褐指藻和新月菱形藻的生长。Guilard和Hellebust[24]也发现棕囊藻能够分泌丙烯酸等抑藻物质抑制藻类的生长。因此, 推测该株棕鞭藻能够释放某些物质到培养液中, 抑制微囊藻的生长, 然而, 该棕鞭藻滤液中存在哪些抑藻物质有待后续工作进行深入研究。
本研究也发现棕鞭藻培养液处理后, 微囊藻的一些生理特性也发生明显的变化, 表现为MDA含量和CAT活性明显增加(图 3)。Okamoto和Colepicolo表明环境压力产生的细胞损伤是通过形成氧化压力来实现的[25]。本研究发现在滤液培养下, 微囊藻的MDA含量显著增加, 表明微囊藻细胞受到氧化损伤。而CAT酶都被认为是细胞受到胁迫表现出来的抗氧化压力的特性[16], 本研究发现CAT活性的增加, 表明微囊藻ROS水平增加, 并通过CAT清除体内ROS造成伤害。这些结果进一步说明了棕鞭藻滤液中可能存在着某些物质来诱导藻类的膜脂过氧化, 影响了微囊藻的生理生化。
同时, 本研究发现棕鞭藻培养液处理后, 微囊藻的可溶性胞外多糖(EPS)含量显著增加(图 3)。相似的结果也被Abomohra等[26]报道。Burkert等[27]认为棕鞭藻与微囊藻共培养可能诱导微囊藻的黏液层组成和厚度发生改变。Reynolds等[28]认为胞外多糖在细胞群体形成中具有重要的作用。已研究表明鞭毛藻的摄食[29]、微囊藻毒素的增加[30]、钙浓度的提高[31]以及高光及氮胁迫[32]均能增加胞外多糖的含量, 进而导致群体的形成。在本研究过程中, 我们也发现微囊藻FACHB-905有群体形成的现象(结果未显示), 这说明了棕鞭藻培养液对微囊藻产生了胁迫压力, 诱导了微囊藻胞外多糖的形成,促进了微囊藻细胞的聚集, 并形成群体来应对胁迫。
综上所述, 本研究发现棕鞭藻不仅能够摄食微囊藻细胞, 而且其培养滤液中可能存在着抑藻物质抑制微囊藻细胞的生理活动, 导致微囊藻生长和繁殖受到抑制。因此, 棕鞭藻可作为一种潜在的藻类水华控制生物, 控制微囊藻水华的发生。
