光叶眼子菜响应夏季高温的模拟研究
2019-01-07邱念伟周培军舒凤月侯元同
邱念伟 高 珊 周培军 舒凤月 侯元同 周 峰
(1. 曲阜师范大学生命科学学院, 曲阜 273165; 2. 南京晓庄学院食品科学学院, 南京 211171)
南四湖是我国第六大淡水湖(面积1266 km2),在我国南水北调、航运等方面具有十分重要的地位[1], 其中微山湖面积最大, 达660 km2。光叶眼子菜 (Co. Potamogeton lucensL.)群落在微山湖区广泛分布, 群落面积约占微山湖面积的1/4, 群落盖度高达85%—100%, 群落内以多年生沉水植物光叶眼子菜为绝对优势种, 群落结构单一, 仅有少量篦齿眼子菜和黑藻伴生[2]。光叶眼子菜是多年生沉水草本植物, 属于眼子菜科(Potamogetonaceae)眼子菜属(Potamogeton), 具有一定的观赏价值和净化污水的功能。光叶眼子菜夏秋两季在湖中大量繁殖, 生物量分别为微山湖生物量的52.83%和91.27%, 湖中密布的光叶眼子菜严重影响了航运和渔业, 秋季光叶眼子菜集中死亡, 腐败的植物体又严重影响了水质。要有效利用和治理光叶眼子菜, 必须了解其生活习性。调查发现, 光叶眼子菜群落主要分布在2 m以上的深水区, 1 m左右的浅水区分布较少, 且在夏季出现非自然死亡现象, 深水区的眼子菜在10月份才大量集中死亡。因此推测眼子菜的分布可能与夏季水温有关, 夏季高温强光天气时, 浅水湖区水温可达35℃以上, 水体高温可能是导致光叶眼子菜夏季衰老死亡的重要原因[3]。
温度是影响植物生长的最重要的环境因子之一, 每种植物都有适合其生长发育的最适温度, 某种沉水植物的最适温度可能对其他物种具有高度的竞争压力, 从而形成种群优势[4,5]。反之, 浅水区夏季高水温则可能会抑制光叶眼子菜生长, 进而影响其在浅水区的分布和竞争力。前人研究发现, 不同的沉水植物最适生长温度和对高温胁迫的耐受能力不同, 如黑藻具有耐高温和低光照的能力, 在水温高达42℃时仍能正常生长开花[6]; 金鱼藻和伊乐藻在35℃以上高温下培养15d以后, 两种藻的生长都会受到抑制, 但金鱼藻的耐热性显著好于伊乐藻[7]; 在相同高温胁迫下, 菹草、苦草、伊乐藻的生长竞争力也有很大差异[8]。总之, 在淡水生态系统中, 水温是影响大型水生植物群落中各物种分布的关键因素之一[9,10]。
本文人工模拟夏季短时高水温环境, 从代谢和光合作用的角度, 分析了光叶眼子菜的耐热性, 为探讨光叶眼子菜在微山湖的分布与水温的关系提供参考, 也为了解各类沉水植物的耐热性积累资料。
1 材料与方法
1.1 实验材料
2016年7月中旬, 从南四湖的微山湖深水区(水深2 m, 水温25℃)用打草器采集自然状况下生长良好的光叶眼子菜(Co.Potamogeton lucensL.), 连同湖水立即带回实验室进行模拟高温处理。
1.2 高温处理
实验以温度作为单一因素, 设25℃、30℃、35℃和40℃四个处理温度, 其中以25℃为对照(CK)。选取生长良好、长势一致的光叶眼子菜置于上述4个温度梯度的恒温循环水浴锅内, 锅内水体为天然湖水。考虑在自然条件下, 湖水中高水温主要在中午持续2—3h, 所以暗中高温短时处理3h后, 立即取出光叶眼子菜, 测定生理生化指标和光合参数。暗处理是为了研究单纯高温对光叶眼子菜的伤害, 同时使叶片充分暗适应, 以便进行叶绿素荧光动力学测定。
1.3 实验方法
叶绿素含量的测定将叶片从水中取出, 用吸水纸吸干叶片表面水分后, 称取0.1 g。然后将叶片切成0.1 cm的细丝, 用二甲基亚砜2 mL于65℃恒温箱暗中浸泡提取2h至叶片发白, 冷却后用8 mL 80%丙酮稀释叶绿素提取液并混匀, 使用紫外可见分光光度计测定其在663.6和646.6 nm处的吸光度。代入下列公式计算叶绿素总浓度(CT=7.35A663.6+17.58A646.6), 每个处理温度测定5个重复[11]。
蛋白质含量的测定称取叶片0.5 g, 加入5 mL预冷蒸馏水和少量石英砂, 在冰上充分研磨后, 4℃,4000×g离心10min, 取上清液测定蛋白质含量, 以结晶牛血清蛋白作为标准蛋白[12], 每个处理温度测定5个重复。
可溶性糖和丙二醛(Malondialdehyde, MDA)含量测定取光叶眼子菜叶片0.5 g, 加入5 mL 10%TCA充分研磨后, 室温5000×g离心10min, 取上清液1 mL, 然后采用王妍等人的TBA法测定可溶性糖与MDA含量[13], 每个处理温度测定5个重复。
叶绿素快相荧光动力学参数的测定取出高温暗处理3h的光叶眼子菜叶片, 立即在暗处用Handy PEA (Plant Efficiency Analyser; Hansatech Instrument Ltd., UK)测定其叶绿素快相荧光动力学曲线。激发光波长为650 nm的红光, 光强为3000 μmol/(m2.s),荧光信号的记录时程为1s, 每个温度处理测定10个重复。用BiolyzerHP3软件解析并计算荧光参数, 相关参数的推导、运算及生理意义参见文献[14, 15]。
1.4 数据分析
利用Excel 2010进行数据处理、统计分析和绘图, 采用单因素方差分析(One-way ANOVA)和最小显著极差法(LSR)分析不同温度下各生理生化参数的差异显著性。平均数上标记相同的小写字母表示处理间无显著差异(P>0.05), 标记不同小写字母表示处理间差异显著(P<0.05)。
2 结果
2.1 高温胁迫对光叶眼子菜叶片叶绿素和蛋白质含量的影响
在25—40℃水浴中处理光叶眼子菜3h后, 立即取出, 测定叶绿素含量, 图 1显示: 与对照(25℃处理)相比, 30℃处理并未影响其叶片叶绿素含量(P>0.05); 而在35℃和40℃高温处理后, 叶绿素含量显著低于对照(P<0.05), 分别比对照下降了9.8%和17.1%, 说明35℃及以上水温对光叶眼子菜的光合系统有明显伤害。在高温处理后, 可溶性蛋白含量的变化趋势与叶绿素类似, 在35℃和40℃高温处理后, 可溶性蛋白含量分别比对照下降了8.3%和17.2%。蛋白质是各类代谢活动的主要承担者, 其含量下降会影响细胞的多种代谢活动。
2.2 高温胁迫对光叶眼子菜叶片可溶性糖和丙二醛含量的影响
可溶性糖既是光合作用的直接产物, 也是植物细胞内重要的渗透调节物质。在35℃和40℃高温处理后, 光叶眼子菜的可溶性糖含量也显著低于对照(P<0.05), 分别比对照降低了30.5%和38.3%, 说明高温下糖的合成受到抑制或分解加快(图 2)。35℃和40℃高温同时诱导了明显的膜脂过氧化, 膜脂过氧化产物——丙二醛含量显著升高(P<0.05),分别为对照的1.29倍和2.01倍。这说明35℃高温对光叶眼子菜来说是一种胁迫。同样, 在30℃条件下的光叶眼子菜叶片可溶性糖和丙二醛含量与对照相比差异均不显著(P>0.05)。
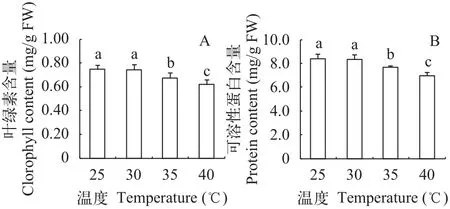
图 1 不同温度处理对光叶眼子菜叶片叶绿素含量(A)和可溶性蛋白含量(B)的影响Fig. 1 Effects of different temperatures on the chlorophyll content(A) and soluble protein content (B) in P. lucens leaves
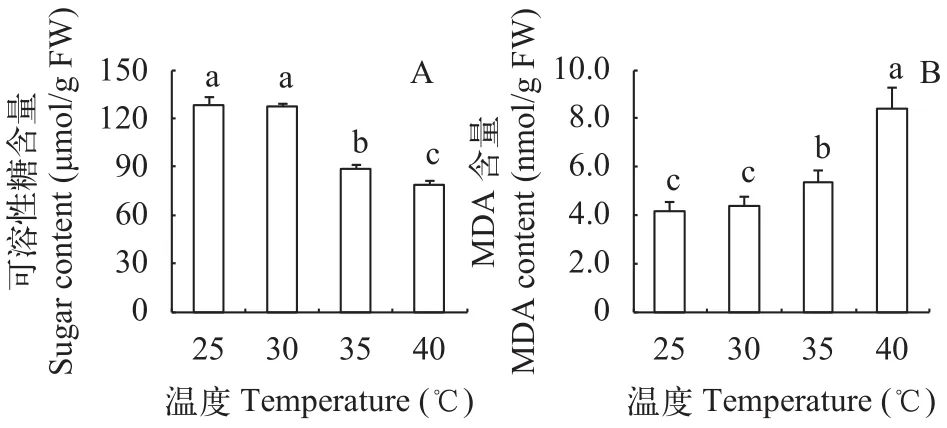
图 2 不同温度处理对光叶眼子菜叶片可溶性糖含量(A)和丙二醛含量(B)的影响Fig. 2 Effects of different temperatures on the soluble sugar content (A) and MDA content (B) in P. lucens leaves
2.3 高温胁迫对光叶眼子菜叶片光合功能的影响
高温胁迫对光叶眼子菜叶片叶绿素荧光动力学曲线的影响 光合作用是对各种逆境比较敏感的代谢活动, 光叶眼子菜属于沉水植物, 其光合效率不宜用光合仪进行测定。快相叶绿素荧光技术是探测植物光合活性的灵敏、快速、无损伤的探针, 可以系统地反映植物的光合结构、过程和效率的变化[16], 能探测各类植物材料的光合性能。光叶眼子菜高温暗处理3h后, 立即取出叶片, 用Handy PEA测定其叶绿素快相荧光动力学曲线。原始OJIP平均曲线显示(图 3A), 随着处理温度的升高,光叶眼子菜叶片的I相和P相荧光强度逐渐下降; 在40℃高温下, J相荧光强度开始显著低于对照, 说明高温影响了叶片的光化学效率, 但未观察到明显的K峰。
为了更深入地观察高温逆境对光叶眼子菜的OJIP曲线的影响, 需要对原始曲线进行标准化处理。第一种标准化方法是Fm-Fo标准化, 即先将任意时刻的荧光值(Ft)标准化为“Vt”,Vt=(Ft-Fo)/(Fm-Fo)。用Vt重新绘制OJIP的时间对数曲线, 这样Vt标准曲线的O相荧光值均变成了0, P相的荧光值均变成了1 (图 3B左)。然后再将对照(25℃)的任意时刻Vt值设为0, 用处理与对照温度的Vt差值(ΔVt)再重新绘制OJIP曲线(图 3B右), 这样就可以清楚地观察到处理与对照荧光曲线上K相(300μs处)和J相(2ms处)的荧光变化。结果显示, 在30℃及以上高温下, 光叶眼子菜的ΔVt曲线上K相和J相出现明显的凸起; 并且温度越高, 凸起越高(图 3B右)。K相凸起说明光系统II (Photosystem II, PSII)的放氧复合体失活; J相升高则说明电子越过质体醌QA的效率下降[17]。30℃处理即出现K峰, 证明光叶眼子菜的光合系统对高温比较敏感。
第二种标准化方法是Fj-Fo标准化, 方法是将任意时刻的荧光值(Ft)标准化为“Wt”,Wt=(Ft-Fo)/(Fj-Fo)。用Wt重新绘制OJIP时间对数曲线,Wt曲线上O相的荧光值均变成了0, J相的荧光值均变成了1(图 3C左)。然后再将对照(25℃)任意时刻的Wt值全部设为0, 用处理与对照的Wt差值(ΔWt)重新绘制OJIP曲线(图 3C右), 这样就可以清楚地观察处理与对照荧光曲线上O相与J相之间的荧光变化, 以及J相之后的荧光变化[17]。结果显示, 30℃及以上高温处理后, ΔWt曲线上仍可以观察到明显的K峰, 且与对照曲线相比, I相(30ms处)和P相(约300ms处)荧光显著下降, 进一步证明高温影响光叶眼子菜放氧复合体活性和光化学效率。
为观察PSII反应中心受高温破坏的程度, 还有一种Fk-Fo标准化方式, 以观察O相和K相之间是否出现L峰(150μs处), 即L-band[18]。具体方法是将50-300 μs时荧光值(Ft)标准化为“Wk”,Wk=(Ft-F50μs)/(F300μs-F50μs)。用Wk重新绘制照光后50—300 μs的荧光曲线。然后再将对照(25℃)的任意时刻Wk值全部设为0, 用处理与对照的Wk差值(ΔWk)重新绘制50-300 μs的荧光曲线(图 4右)。如果高温处理的ΔWk曲线上隆起L-band, 说明高温破坏了反应中心复合体的结构。但图 4结果显示, 在30—40℃高温处理后, 光叶眼子菜的ΔWk曲线上并未隆起L-band,说明30-40℃高温下光叶眼子菜PSII反应中心的结构仍保持稳定。
高温胁迫对光叶眼子菜叶片叶绿素荧光参数的影响用BiolyzerHP3软件解析不同温度下光叶眼子菜的叶绿素荧光动力学曲线, 可以计算出反映植物叶片光合结构、过程、速度和效率的光合荧光参数, 进一步了解光叶眼子菜在高温下的光合特征。把对照温度下(25℃)叶片的荧光参数均标准化为1, 用其他温度下的荧光参数与对照参数的比值绘制成雷达图(图 5), 可以更清楚地观察和比较高温对植物光合功能的影响。结果显示, 在35℃和40℃高温下, 光叶眼子菜到达最大荧光(Fm)所需的时间(Tfm)显著变短, 100和300 μs时光反应中心的关闭速率(dVG/dto, dV/dto)也显著变慢。随着处理温度的升高, I相相对可变荧光强度(Vi)变化不大, J相相对可变荧光强度(Vj)则显著增大, 说明电子经过质体醌B(QB)时的电子传递效率(1-Vi)受高温影响不大, 高温主要影响了光叶眼子菜质体醌A(QA)处的电子传递效率(ψo=1-Vj)。在35℃和40℃高温下初始荧光(Fo)和最大荧光(Fm)均变小, 热耗散的量子比率(Fo/Fm,φDo)显著增大, 捕获光能与热耗散能量的比例(Fv/Fo)及捕获光能用于电子传递的量子比率(φEo)变小, 因此PSII最大光化学效率(Fv/Fm,φPo)显著下降。在高温下光系统Ⅰ (PhotosystemⅠ, PSI)的相对活性(φRo)也有所降低, 质体醌库(Sm)稍有减小, 但质体醌周转次数(N)和还原速率(Sm/Tfm)与对照相比差异并不显著, 说明光叶眼子菜的质体醌库和PSI在高温下相对稳定, 主要是使PSII的非光化学比例(Kn)增大。
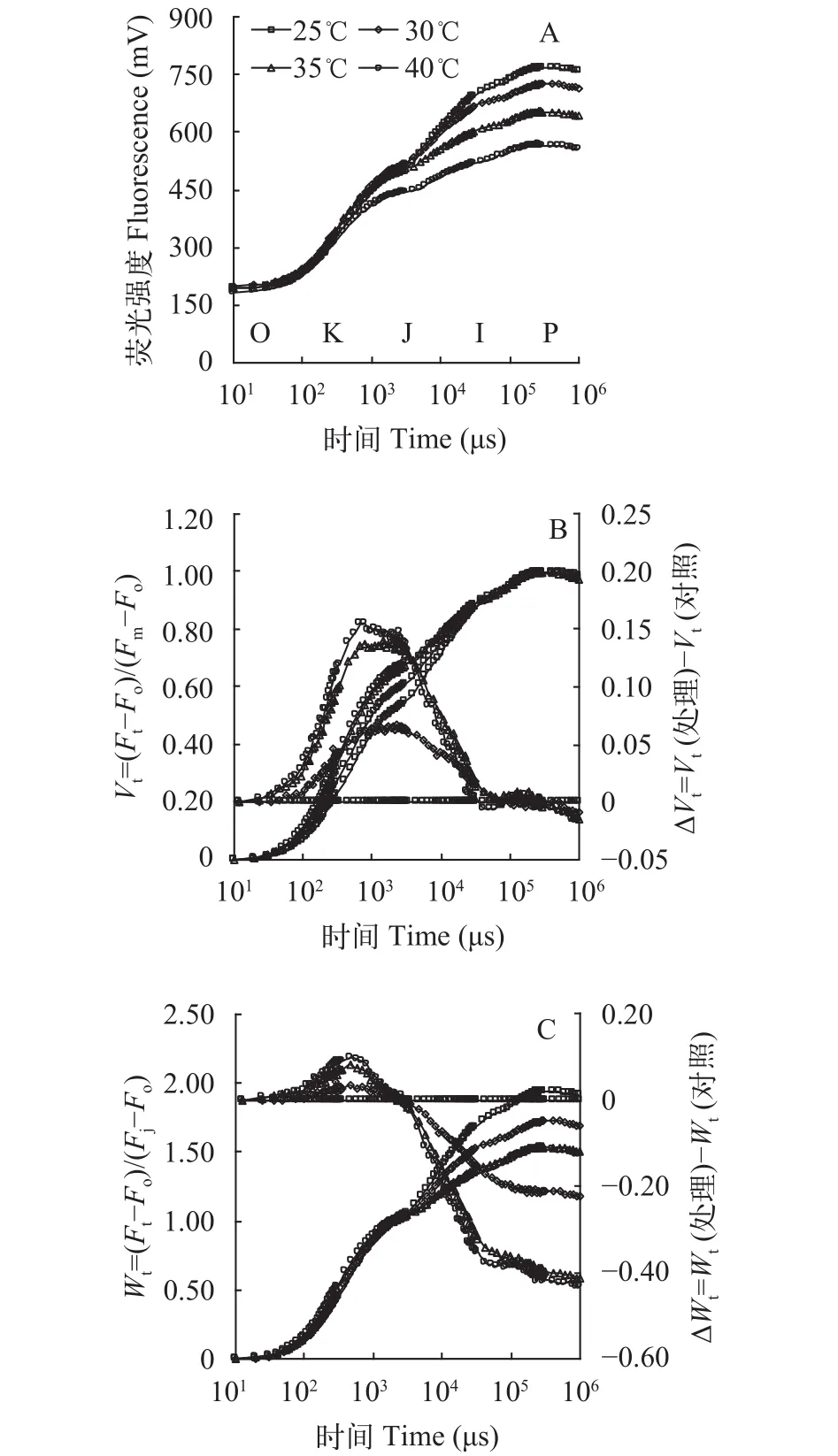
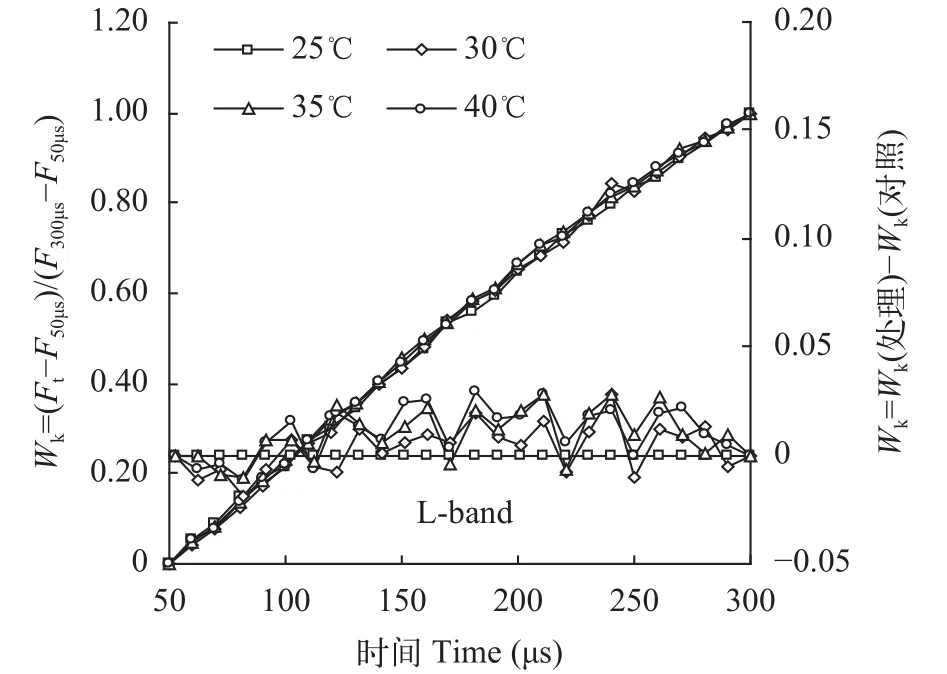
图 4 不同温度处理对光叶眼子菜叶片叶绿素荧光动力学曲线L-band的影响Fig. 4 The L-band on chlorophyll a fluorescence curves of P.lucens leaves under different temperatures
从单个反应中心活性来看, 随着处理温度的升高, 光叶眼子菜单个反应中心光能的吸收(ABS/RC)和捕获(TRo/RC)是增大的, 但捕获光能用于电子传递的效率(ETo/RC)降低, 从而使反应中心捕获的光能更多地以热能散失, 热耗散(DIo/RC)增大。从单位面积光合活性来看, 因为高温下叶片单位激发态面积的反应中心数目(RC/CSo)减少, 所以单位面积光能的捕获(TRo/CSo)和电子传递效率(ETo/CSo)均降低, 单位面积热能耗散(DIo/CSo)依然增大, 而单位面积光能的吸收(Fo=ABS/CSo)维持相对稳定, 直到40℃高温下才显著低于对照。光叶眼子菜的光合作用综合性能指数对高温更为敏感, 随着处理温度的升高, 叶片的结构功能指数(Structure and function index of plants,SFI)、性能指数(Performance index of plants,PI(abs))和光合驱动力(Drive force for photosynthesis,DF)均呈明显下降趋势。
3 讨论
温度是影响植物生长发育的重要生态因子之一, 在炎热的夏季阳光照射下, 浅水区水温可达35℃以上, 光叶眼子菜在南四湖浅水区分布较少,很可能与其耐热性有关。本文生理生化结果显示,在35℃和40℃高温下, 光叶眼子菜叶片的叶绿素、蛋白质和可溶性糖含量开始显著低于对照, 丙二醛含量开始高于对照; 而30℃时上述指标与对照相比差异不显著, 说明当温度高于35℃对光叶眼子菜即是一种高温胁迫(图 1、图 2)。夏季在微山湖浅水区观察到光叶眼子菜有衰老死亡现象, 其衰老死亡也可能是由于光合系统被高温破坏的缘故。陆生植物的耐热性研究证明高温诱导植物叶片衰老死亡是由于高温破坏叶绿体结构, 影响叶绿体电子传递效率, 造成叶绿体光合电子传递链渗漏电子, 产生活性氧, 从而诱导细胞凋亡[19,20]。前人主要从生长和抗氧化的角度探测了高温对沉水植物的影响[6—10]。因为光合作用是对高温等逆境最为敏感的化学过程[21], 所以本文以叶绿素荧光技术为探针,分析了高温下光叶眼子菜叶片光合结构和功能的变化。
叶绿素荧光诱导动力学曲线上出现K峰是高温伤害PSII的标志性特征[21], 大部分植物在45℃高温胁迫下都会出现明显的K峰, 如大麦用40℃处理10min, OJIP原始曲线上并未观察到明显的K峰, 而用45℃处理10min就会出现显著的K峰[22]。光叶眼子菜经30—40℃高温处理后的原始荧光曲线上并未观察到明显隆起的K相, 只有经过Fm-Fo标准化后才能观察到K峰(图 3B、图 3C);Fk-Fo标准化曲线上也未发现明显的L-band (图 4), 说明35℃和40℃对光叶眼子菜叶片的伤害并不是特别严重[17],主要是影响了反应中心放氧复合体和反应中心的活性, 并未导致大量放氧复合体或者反应中心失活。中等热胁迫下一般不会导致放氧复合体解离和反应中心失活[23], 只有重度热胁迫才会使放氧复合体从PSII解离, 导致Mn簇从反应中心复合体释放出来, 最终使放氧复合体完全失活[24]。
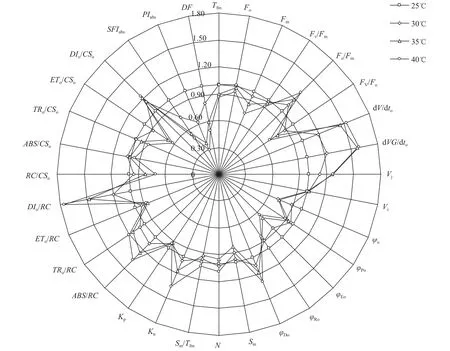
图 5 不同温度处理的光叶眼子菜叶片叶绿素参数比较雷达图Fig. 5 The radar diagram of fluorescence data of P. lucens leaves under different temperatures
荧光参数还可反映高温胁迫对植物光反应过程和效率的影响[25], 高温胁迫对光叶眼子菜叶片光合功能的影响主要表现为热耗散(Fo/Fm、φDo、DIo/RC、DIo/CSo)增加, 单位激发态面积的光能捕获效率(TRo/CSo)和电子传递效率(ETo/CSo)显著下降, 这种光合功能的下降与单位面积有活性的反应中心数目(RC/CSo)减小有关(图 5)。ΔWk曲线上未隆起L-band, 说明光叶眼子菜反应中心未受到显著破坏, 但其150和300μs时的反应中心关闭速率(dVG/dto、dV/dto)变慢, 可能是因为放氧复合体活性降低, 电子供应不足所致[23]。单个反应中心的电子传递效率(ETo/RC、φEo)也是下降的, 说明高温影响了光叶眼子菜PSⅡ反应中心受体侧的电子传递活性。此外, 在高温胁迫下, 光叶眼子菜的质体醌库(Sm)也显著变小, 也会导致PSⅡ电子传递效率下降, 这些现象与甜高粱等农作物的热伤害效应类似[26]。因此高温对光叶眼子菜光系统的结构和活性都具有显著影响。但35℃和40℃高温胁迫对光叶眼子菜光系统的伤害并不严重, 并未导致光叶眼子菜衰亡。一般单纯高温胁迫往往45℃以上才会对植物的光系统产生严重伤害, 这与离体实验效果类似[27]。微山湖浅水区夏季却出现光叶眼子菜衰老死亡现象, 主要是因为夏季中午高温往往伴随着强光, 强光与高温胁迫同时存在会加重对植物的伤害, 如35℃亚高温和1000 μmol/(m2.s)光强组合处理即可对番茄幼苗造成严重伤害[28]。
在高温胁迫下, 质体醌库减小, 会导致电子传递受阻, 在光合电子传递链上产生电子渗漏, 生成活性氧, 活性氧的含量与高温胁迫温度呈正相关[8]。对于植物的绿色组织而言, 在逆境条件下90%以上的活性氧来自叶绿体[29], 活性氧水平升高可诱导膜脂过氧化。本文结果显示在35℃和40℃高温胁迫下丙二醛含量分别为对照的1.29倍和2.01倍, 说明高温对光叶眼子菜产生了明显的过氧化伤害。在高温下维持叶绿体的活性对植物的耐热性至关重要, 植物在可耐受的高温条件下会主动合成热激蛋白等保护性物质提高抗热性, 这时蛋白质含量与温度呈正相关[30]。本文的结果却相反, 在35℃和40℃高温胁迫下, 光叶眼子菜的蛋白质含量显著低于对照, 推测可能是在高温下光叶眼子菜蛋白质分解加快或合成受阻, 不能有效快速合成热激蛋白增强耐热性。还有很多植物在高温胁迫下合成大量渗透保护物质来提高抗热性[31], 可溶性糖既是光合产物,也是最常见的渗透保护物质。在35℃和40℃高温胁迫下, 光叶眼子菜的可溶性糖含量也显著低于对照。上述结果说明光叶眼子菜缺乏有效的耐热机制。
综上所述, 光叶眼子菜在35℃及以上单纯高温胁迫下, 其光合活性即受到显著抑制, 出现明显的热胁迫损伤, 证明其是一种热敏感的沉水植物。光叶眼子菜作为南四湖最主要的优势物种, 主要分布在深水区, 可能与其热敏感有关, 夏季浅水区的高水温可导致其衰亡, 影响了其在浅水区的竞争力。
