烘焙对红松种籽衣活性成分含量及抗氧化活性的影响
2019-01-07郭奇泳张艳石茂军张琪瑶吴聪赵玉红
郭奇泳,张艳,石茂军,张琪瑶,吴聪,赵玉红
(东北林业大学林学院,黑龙江哈尔滨 150040)
红松(Pinus koraiensis)属裸子植物,又名海松,主要分布于小兴安岭地区,是我国重要的林业资源,红松中含有丰富的多酚类物质[1],这些物质已被证明具有抗氧化、抗癌、抗炎、防辐射和对α-淀粉酶、α-葡萄糖苷酶具有抑制作用等功效[2~6]。有关红松中活性成分的研究主要集中在对种壳、种鳞和种籽衣中多酚、黄酮、多糖等活性成分的提取及功能活性方面的研究[7~9]。
松仁外层包裹的膜衣称为种籽衣。赵起越等[10]对红松种籽衣的各种营养成分进行了测定,证明种籽衣中含有丰富的多酚和黄酮类化合物。张根生等[11]优化红松种籽衣中多酚的提取工艺。苏晓雨等[12]对红松种籽衣提取物的抗氧化作用进行了评价,证明红松种籽衣提取物具有明显的抗氧化活性并认为其优良的抗氧化性与多酚及黄酮等活性成分相关。
种籽衣作为松仁加工产品副产物因含有活性成分和具有生物活性而被加入到食品中,赵梦雅等[13]将松仁种籽衣应用于酸奶中并研究其对酸奶理化性质的影响,Н.Н.Типсина等[14]将松籽衣添加到面包制品中。松籽常被用来烘焙后食用,Schlörmann等[15]研究证明将榛子、杏仁和夏威夷果在低中温(120~160 ℃)条件下烘焙具有更好的风味和营养价值。而烘焙处理对红松种籽衣中活性成分含量和抗氧化活性产生的影响尚未见报道。
本研究对带壳和不带壳红松松籽进行烘焙处理,取种籽衣,选择烘焙温度为130 ℃,研究烘焙时间对其种籽衣中总多酚、总黄酮活性成分含量、抗氧化能力(DPPH·清除能力、羟基自由基清除能力和总还原力)及颜色变化的影响,为更好地利用红松种籽衣提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
红松松籽,黑龙江省林业科学院提供。
1.1.2 试剂
无水乙醇、没食子酸标准品、福林酚试剂、芦丁标准品、DPPH、脱氧核糖、三氯乙酸、PBS、抗坏血酸、TPTZ均为分析纯。
1.1.3 仪器与设备
756型紫外分光光度计,上海分析仪器厂;YP410047电子天平,上海佑科仪器仪表有限公司;DHG-9240电热恒温鼓风干燥箱,上海一恒科技有限公司;DK-SD电热恒温水槽,上海一恒科技有限公司;KQ-300DE数控超声波清洗器,昆明市超声仪器有限公司;722型可见分光光度计,上海光谱仪器有限公司;SW-CJ-IFD型超净工作台;TDL-40B-W台式低速大容量离心机,上海习仁科技仪器有限公司;远红外线食品烧烤炉。
1.2 实验方法
1.2.1 样品的制备
1.2.1.1 种籽衣的制备
带壳烘焙种籽衣的制备:将完整松籽在130 ℃条件下烘焙,取出冷却至室温。将松籽剥壳,手工去皮得到种籽衣,密封,避光保存备用。
不带壳烘焙种籽衣的制备:将松籽去壳,在130 ℃条件下烘焙,取出冷却至室温。手工从松仁表面剥离种籽衣,密封,避光保存备用。
1.2.1.2 提取液的制备
种籽衣经粉碎机粉碎,过 40目筛[11],精确称取种籽衣粉末。按料液比1:20(W/V)加入60%(V/V)乙醇溶剂,进行超声波辅助提取,提取温度 60 ℃,功率300 W,时间90 min[11]。离心(4000 r/min,20 min),分离提取液,残渣复提一次,合并两次提取液。
1.2.2 总多酚含量测定
采用Folin-Phenol法测定提取物总多酚含量。
1.2.2.1 标准曲线的绘制
参照张根生等[11]的方法,以没食子酸为对照品。没食子酸标准储备溶液(1000 μg/mL):称取(0.11±0.01)g没食子酸(GA,相对分子质量188.14)于100 mL容量瓶中溶解并定容至刻度,摇匀(现配)。没食子酸工作液:用移液管分别移取1.0、2.0、3.0、4.0、5.0 mL的没食子酸标准储备溶液于100 mL容量瓶中,分别用水定容至刻度,摇匀,浓度分别为10、20、30、40、50 μg/mL。用移液管分别移取没食子酸工作液、水(做空白对照)各1.0 mL于10 mL棕色容量瓶中,分别加入5.0 mL福林酚试剂(10%,V/V),摇匀。反应3~8 min内,加入4.0 mL Na2CO3溶液(7.5%,m/V),充分混匀后定容。置于25 ℃恒温水浴中反应1 h后,用比色皿于765 nm波长下测定吸光值。以没食子酸的质量浓度为横坐标,吸光度值为纵坐标绘制没食子酸标准曲线。没食子酸在0~50 μg/mL浓度范围内线性回归方程为y=0.0161x+0.029,R²=0.9993。
1.2.2.2 样品的测定
取1 mL稀释提取液,按上述方法测定总多酚的含量,公式如下:
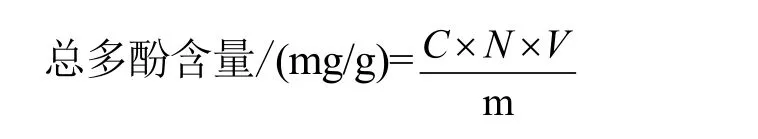
式中:V为稀释提取液的体积(mL);N为稀释倍数;C为按标准曲线计算的溶液的总多酚浓度(mg/mL);m为样品的质量(g)。
1.2.3 总黄酮含量测定
采用亚硝酸钠-硝酸铝比色法测定提取物总黄酮含量。
1.2.3.1 标准曲线的绘制
参照张晓茹等[16]的方法,以芦丁为对照品。精密称取芦丁对照品20 mg用少量60%乙醇溶解后,转移至100 mL容量瓶,定容至刻度线。分别精密量取0、1.0、1.5、2.0、2.5、3.0、3.5 mL芦丁溶液置于试管中,加入0.5 mL亚硝酸钠溶液(5%,W/V),摇匀,静置6 min,加入0.5 mL硝酸铝溶液(10%,W/V),摇匀,静置6 min,加入5 mL氢氧化钠溶液(4%,W/V),摇匀,加入60%乙醇定容至10 mL,静置25 min,在509 nm波长处测定吸光值,以芦丁浓度为横坐标,以吸光度为纵坐标,绘制标准曲线。芦丁在0~70 μg/mL浓度范围内线性回归方程为 y=0.0118x-0.0014,R²=0.9991。
1.2.3.2 样品的测定
取1mL稀释提取液,按上述方法测定总黄酮的含量,计算公式如下:
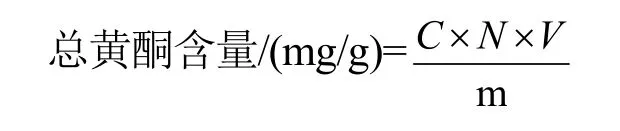
式中:V为稀释提取液的体积(mL);N为稀释倍数;C为按标准曲线计算的溶液的总黄酮浓度(mg/mL);m为样品的质量(mg)。
1.2.4 抗氧化能力测定1.2.4.1 DPPH·清除能力测定
参照张晓茹等[16]的方法,用无水乙醇将DPPH样品配置为0.1 mmol/L的DPPH乙醇溶液,并保存于棕色瓶中(临用前配)。取测定液2 mL及2 mL DPPH溶液到同一试管中,摇匀,室温下暗处静置30 min后测定其在波长517 nm下吸光度A1,同时测定2 mL DPPH溶液与2 mL无水乙醇混合液吸光度A0,以及2 mL测定液与2 mL无水乙醇混合液吸光度A2。自由基清除能力的计算公式:
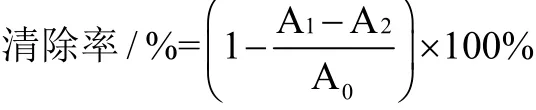
1.2.4.2 羟基自由基清除能力测定
参照 Siddhuraju[17]的方法并做修改。取 0.25 mL提取液,0.25 mL蒸馏水做空白对照。样品中加入0.5 mL磷酸盐缓冲液(pH 7.4,100 mmol/L)、0.2 mL 2-脱氧-D-核糖(28 mmol/L)、0.4 mL Fe3+-EDTA(100 μmol/L FeCl3,104 μmol/L Na2-EDTA 1:1)、0.2 mL H2O2(1 mmol/L)和0.2 mL抗坏血酸溶液(1 mmol/L)。在37 ℃水浴下反应1 h,立即加入,加冰的三氯乙酸(2.8%,W/V)和2 mL 2-硫代巴比妥酸(1%,W/V),沸水浴20 min,待样品冷却(10 min),于532 nm波长下测定个样品吸光值,平行测定三次,计算清除率。
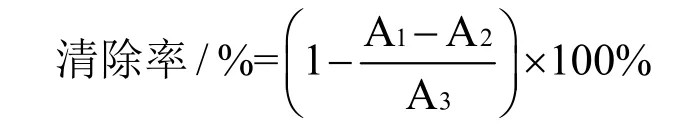
式中:A1:加测定溶液后的吸光度;A2:加测定溶液,不加脱氧核糖溶液反应后的吸光值;A3:未加测定溶液时的吸光度。
1.2.4.3 总还原力测定
采用FRAP法,参照Bouayed等[18]的方法并做修改,向试管中加入5 mL TPTZ(用40 mmol/L HCl配制成浓度为10 mmol/L的溶液)和0.5 mL 20 mmol/L FeCl3溶液混合均匀,于37 ℃水浴中水浴加热5 min后,加入0.5 mL待测液摇匀,继续37 ℃水浴10 min,取出静置至室温后于593 nm波长下测定吸光值。
标准曲线绘制:配制FeSO4浓度分别为0.2、0.4、0.6、0.8、1.0 mmol/L作为待测液,按上述方法测定吸光值。FeSO4在0~1.0 mmol/L浓度范围内线性回归方程为 y=0.6776x+0.0437,R²=0.9991。
1.2.5 种籽衣色差值的测定
亮度值L*、红绿值a、黄蓝值b的测定参照静玮等[19]的方法。
1.2.6 种籽衣提取液全波长扫描
以60%乙醇溶液作基线,提取液稀释10倍后在紫外分光光度计进行全波长扫描。
1.3 数据处理
采用origin8.0绘图,采用SPSS20.0对数据进行相关性分析、显著性检验,所得结果用平均值±标准差(±sd)表示,以p<0.05作为差异显著性检验标准。
2 结果与分析
Schlörmann等[15]研究证明低温(120~140 ℃)烘焙条件下坚果具有最高的感官评价分数。因此本实验选择在130 ℃进行烘焙处理。
2.1 总多酚含量测定结果
在 130 ℃条件下分别对带壳、不带壳松籽烘焙10、20、30、40 min,种籽衣多酚含量测定结果如图1所示。与未烘焙种籽衣相比,种籽衣经过不同条件烘焙后总多酚含量呈现不同程度的损失。其中,带壳烘焙种籽衣在10 min总多酚含量降到最低,继续烘焙总多酚含量又会上升随后再继续下降;不带壳烘焙的种籽衣总多酚含量在30 min时下降到最低,继续烘焙总多酚含量上升。
未处理种籽衣提取液总多酚含量为11.31 mg/g,较赵梦雅等[13]16.20 mg/g有所降低,可能与松子成熟度、季节、储存和处理条件以及干燥方法等因素相关;Bradleyw等[20]将加利福尼亚杏仁种籽衣在295 ℉条件下烘焙14 min,总多酚含量由25.10 mg/g下降至18.50 mg/g,本研究种籽衣在烘焙过程中总多酚含量也呈现不同程度的降低(p<0.05)。Locatelli等[21]等研究了180 ℃烘焙10 min和20 min对榛子种籽衣总酚含量的影响,结果显示种籽衣在烘焙20 min时总酚含量显著高于10 min,与本研究带壳烘焙情况类似。Pelvan等[22]的研究表明,没食子酸和香草酸是天然榛子皮中的主要酚酸,而在烘焙后的榛子皮中,香草酸和丁香酸占主导地位,以此推断,烘焙红松种籽衣中酚酸种类发生变化,即烘焙过程中伴随着原有酚酸丧失和新酚酸生成反应的进行,可能是烘焙过程中总多酚含量在20 min(带壳)和40 min(不带壳)时升高的原因。
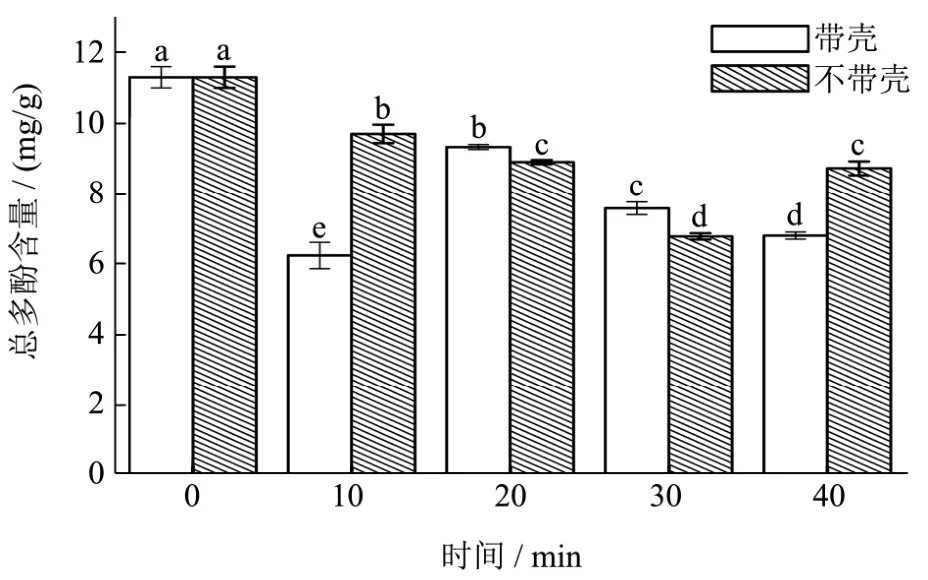
图1 烘焙种籽衣总多酚含量与时间关系Fig.1 Relationship between total polyphenol content and time of baked seed coat
2.2 总黄酮含量测定结果
在130 ℃条件下分别进行带壳、不带壳烘焙10、20、30、40 min,种籽衣总黄酮含量测定结果如图 2所示。与未烘焙种籽衣相比,种籽衣经过不同条件烘焙后总黄酮含量呈现不同程度的损失,其中,带壳焙烘焙种籽衣在20 min总黄酮含量较10 min略微上升后,继续烘焙总黄酮含量又会下降;不带壳烘焙的种籽衣总黄酮含量在10~30 min时间段呈现上升趋势,随后在40 min时降到最低。
未处理种籽衣总黄酮含量为3.05 mg/g,比较吴琼等[23]研究结果有所降低。本研究按提取多酚的最佳工艺测定总黄酮含量,与吴琼等[23]最佳工艺不同,应是黄酮提取含量低的主要原因。带壳烘焙总黄酮含量普遍低于不带壳烘焙,应是松子壳阻碍了种籽衣直接暴露在空气中,从而阻碍了分解反应的进行。
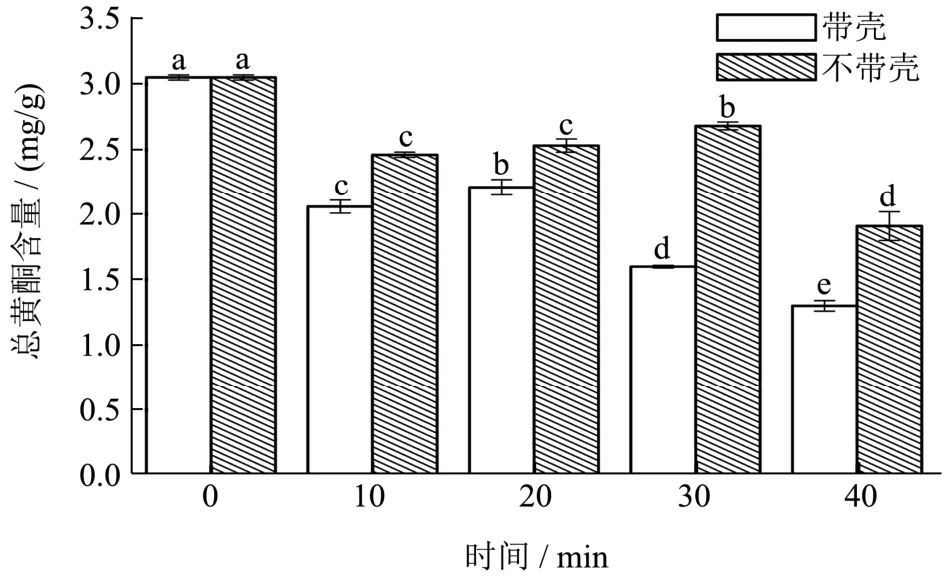
图2 烘焙种籽衣总黄酮含量与时间关系Fig.2 Relationship between the content of total flavonoids and the time of baking seed coat
2.3 红松种籽衣抗氧化性测定结果
2.3.1 DPPH·清除能力研究
不同浓度带壳、不带壳烘焙种籽衣提取液对DPPH·清除能力影响结果分别见表 1和表 2。由DPPH·清除能力的半抑制浓度(IC50)可知,带壳烘焙过程中,DPPH·清除能力在20 min时上升随后继续下降,在 20 min时达到最高;不带壳烘焙过程中,DPPH·清除能力在20 min和40 min上升,在20 min时最高。其中不带壳烘焙20 min的DPPH·清除能力最高,IC50值为0.16 mg/mL,低于未烘焙样品IC50值0.17 mg/mL,说明其DPPH·清除能力高于未烘焙样品。
DPPH·清除率在提取液浓度为 0.05~0.80 mg/mL范围内随浓度增大而升高,且同一浓度不同烘焙时间的提取液清除率差异明显(p<0.05)。当提取液浓度达到0.80 mg/mL时,DPPH·清除率可高达89.39%(不带壳烘焙20 min)和90.71%(不带壳烘焙40 min)。
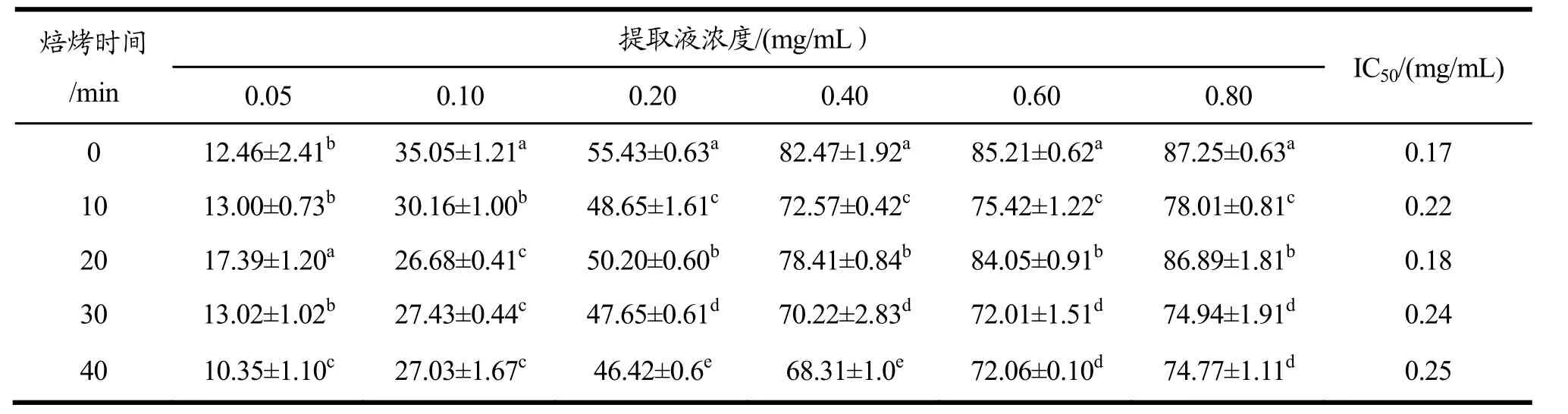
表1 带壳烘焙种籽衣不同浓度提取液的DPPH自由基清除率Table 1 DPPH radical scavenging rates of different concentration extracts of shell-baked seed coats
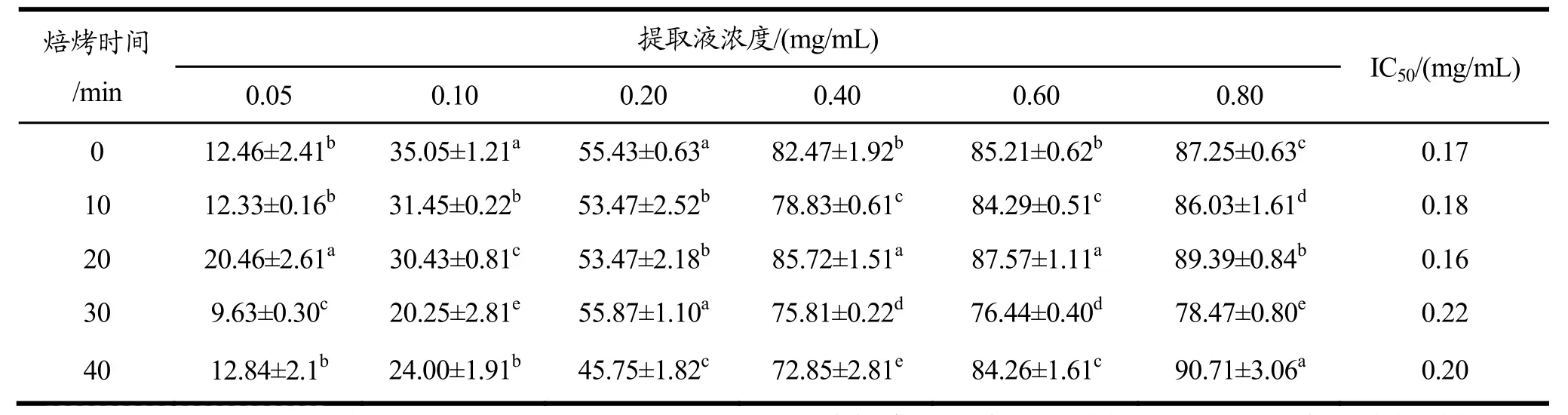
表2 不带壳烘焙种籽衣不同浓度提取液的DPPH自由基清除率Table 2 DPPH radical scavenging rates of different concentration extracts of seed coats without shell baking
2.3.2 羟基自由基清除能力研究
不同浓度带壳、不带壳烘焙种籽衣提取液对羟基自由基清除能力影响结果分别见表3和表4。由羟基自由基的半抑制浓度(IC50)可知,烘焙后的种籽衣的提取液对羟基自由基的清除能力在 20 min时呈现大幅度的上升,带壳烘焙IC50值从0.19 mg/mL降低至0.11 mg/mL,不带壳烘焙IC50值从0.14 mg/mL降低至 0.10 mg/mL,都比未处理种籽衣 IC50值(0.14 mg/mL)低。同样情况出现在40 min时也出现,但清除能力不如未处理种籽衣。且不带壳烘焙的种籽衣对羟基自由基的清除能力较带壳烘焙的种籽衣强。其中不带壳烘焙20 min清除能力最强。
羟基自由基清除率在提取液浓度为 0.10~2.00 mg/mL范围内随浓度增大而升高,即两者呈现明显的量效关系,且同一浓度不同烘焙时间的提取液清除率差异明显(p<0.05)。当提取液浓度达到 2.00 mg/mL时,羟基自由基清除率可高达 91.03%(不带壳烘焙20 min)。
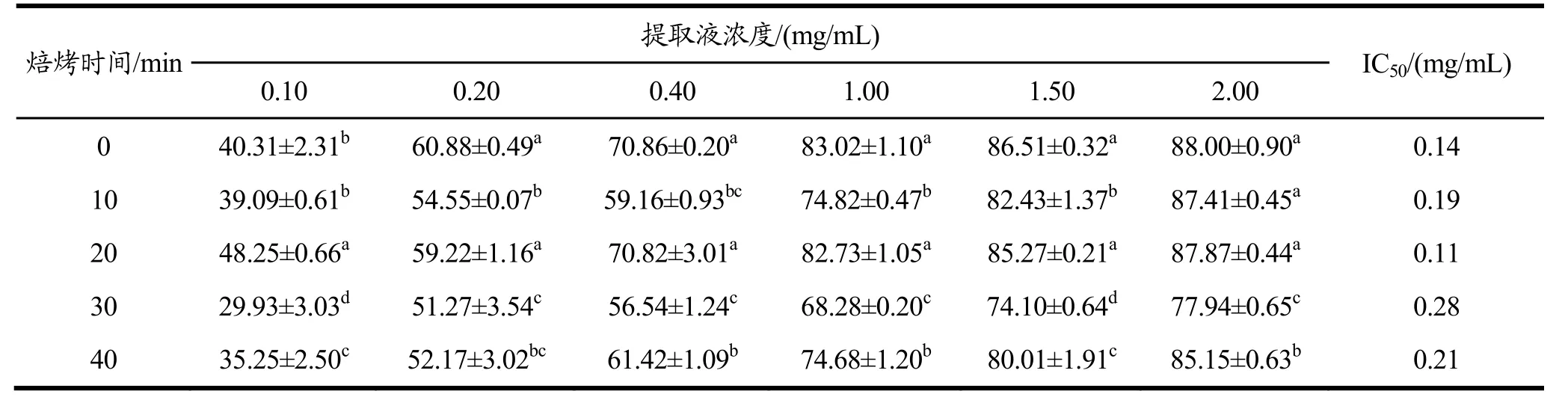
表3 带壳烘焙种籽衣不同浓度提取液的羟基自由基清除率Table 3 Hydroxyl radical scavenging rates of different concentration extracts of shell-baked seed coats
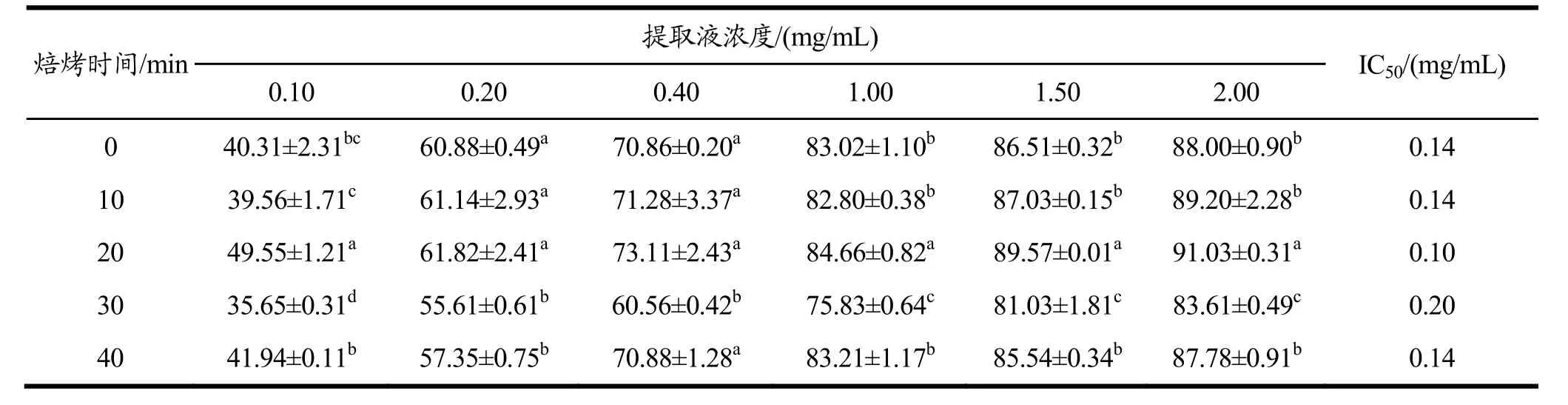
表4 不带壳烘焙种籽衣不同浓度提取液羟基自由基清除率Table 4 Hydroxyl radical scavenging rates of different concentration extracts of seed coats without shell baking
2.3.3 总还原力研究
烘焙种籽衣提取液总还原力测定结果如图 3所示。烘焙后种籽衣总还原能力不如未烘焙种籽衣,不同烘焙时间条件呈现不同程度的降低。带壳烘焙过程中还原力逐渐减弱,未烘焙种籽衣提取液为 4.51 mmol/L(以FeSO4为当量,下同),带壳烘焙40 min时为2.32 mmol/L;不带壳烘焙过程中总还原力在20 min和40 min时有较大幅度的上升,其中20 min时为3.74 mmol/L,40 min时为3.69 mmol/L。
从图中可以看出,烘焙后种籽衣总还原能力不如未烘焙种籽衣,这与Bradleyw等[20]的研究结果相同,因此是否带壳进行烘焙会影响种籽衣的总还原能力。在烘焙时间20 min以后(包括20 min),不带壳总还原力明显高于带壳。活性成分含量变化说明烘焙过程中存在着新物质的生成[22],而颜色变化说明烘焙过程中存在美拉德反应,这与 Davis等[24]推测相同。在低中温130 ℃烘焙条件下,壳的存在阻碍种籽衣直接接触热空气,从而阻碍两种反应的进行,应是带壳烘焙种籽衣抗氧化性(DPPH·清除能力、羟基自由基清除能力、总还原力)不如不带壳烘焙种籽衣的原因。
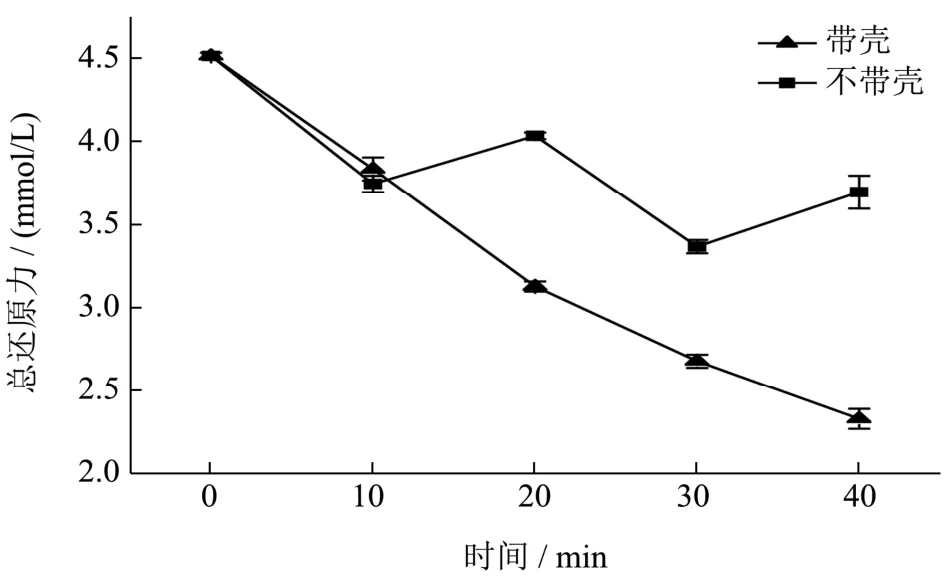
图3 烘焙种籽衣总还原力与烘焙时间关系图Fig.3 Relationship between total reducing power and baking time of baked seed coat
2.4 烘焙种籽衣颜色变化研究
L*、a、b值测定结果如图4。烘焙0~40 min过程中,a值呈现先升高再降低而后继续升高的趋势,且a不带壳>a带壳;b值持续降低,30 min后降低速度趋于平缓;L*值持续降低,30 min后降低速度趋于平缓,且L*带壳>L*不带壳。说明烘焙过程中伴随着呈色物质的分解和生成,且对不带壳种籽衣影响更为剧烈。Davis等[24]研究了烘焙(166 ℃,0~77 min)对花生种籽衣颜色的影响,表明在烘焙过程种籽衣颜色明显变暗,并推测是由烘焙过程中美拉德反应引起的。
红松种籽衣中含有较为丰富的蛋白质和糖类[10],在烘焙过程中伴随着美拉德反应(非酶褐变)和焦糖化反应的进行,结果生成黑色素,是烘焙过程中种籽衣颜色逐渐加深的原因,即L*值、a值、b值大幅度降低,烘焙30 min后,由于蛋白质和糖类逐渐被消耗,非酶褐变反应速度减慢,因而颜色变化程度降低。项惠丹等[25]研究表明美拉德反应生成的黑色素具有抗氧化活性,且与反应物浓度和反应时间有一定的量效关系,这也是烘焙过程中各指标变化不规律的原因。
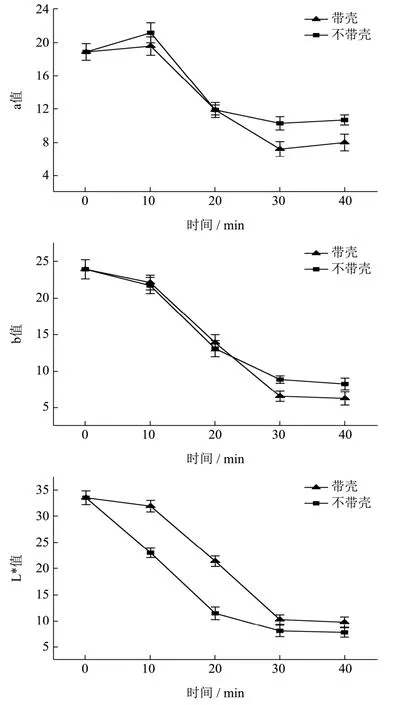
图4 a、b、L*值与烘焙时间变化关系Fig.4 Relationship between a, b, L* values and baking time
2.5 种籽衣提取液全波长扫描结果
带壳、不带壳烘焙种籽衣提取液全波长扫描结果如图 5-a和图 5-b。所有样品吸收峰波长都位于274~279 nm之间。其中,未处理种籽衣提取液吸收峰波长为275.5 nm,吸光值为1.00;带壳烘焙40 min种籽衣提取液吸收峰波长为275.0 nm,吸光值最高1.13;不带壳烘焙20 min种籽衣提取液吸收峰波长为278.5 nm,吸光值为1.12。说明烘焙过程中活性成分种类以及含量是发生变化的。Alasalvar等[26]研究的榛子种籽衣提取物吸收峰波长为282 nm,说明两者活性成分较为接近。
烘焙过程中特征吸收峰波长和吸光值都在变化,即烘焙过程中活性成分种类和含量都会发生变化。Alasalvar等[26]将榛子皮提取物在层析柱中用乙醇进行洗脱得到低分子量的酚酸,并做扫波长扫描分析,得到最大吸收峰波长为278 nm,与不带壳20 min吸收峰波长接近,结合两者分析,不带壳烘焙20 min的红松种籽衣提取物中应含有大量的低分子量酚酸,通过总多酚和总黄酮在10~20 min时变化情况,20 min较 10 min活性成分含量高或两者差异不明显(p<0.05),由此可以推断这个时间段是新的酚酸生成的主要阶段,从而烘焙20 min时新的酚酸含量达到最高,随后继续烘焙新的酚酸也会丧失使总多酚含量减少,这可以为烘焙20 min时的高抗氧化性提供依据。类似的情况也可以在30~40 min时间段看到。
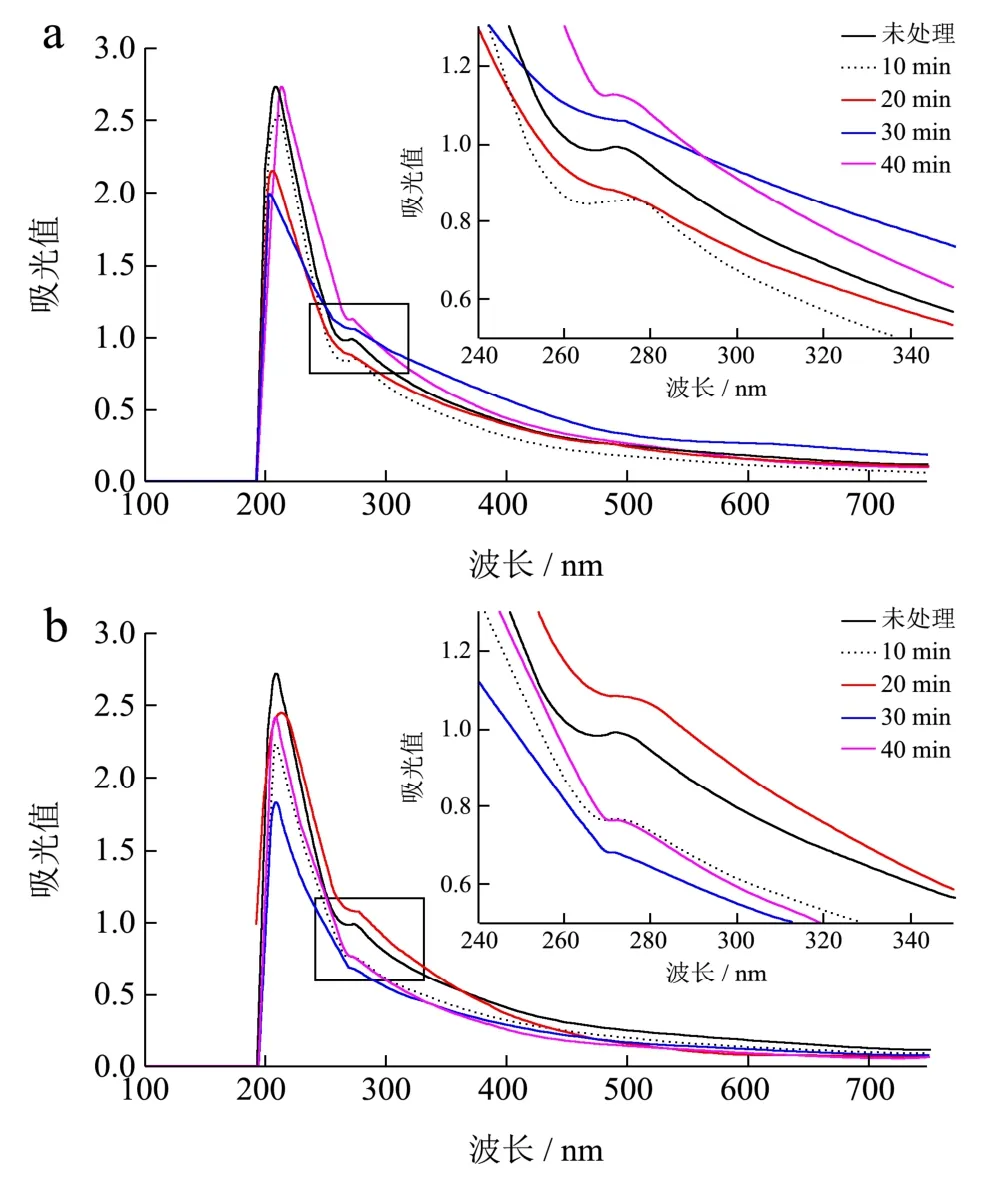
图5 带壳和不带壳烘焙种籽衣全波长扫描图Fig. 5 Full-wavelength scan of seed coats with and without shells
2.6 抗氧化活性与总多酚、总黄酮含量间的相关性
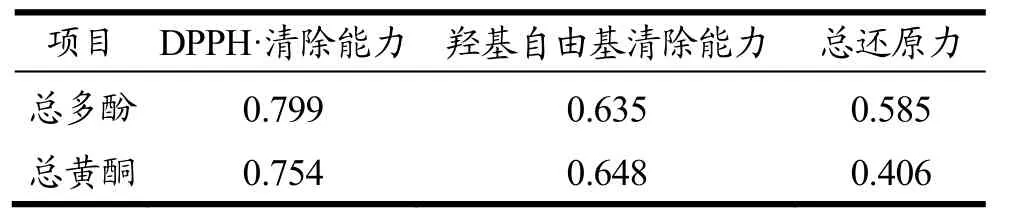
表5 活性成分与抗氧化指标间相关系数表Table 5 Correlation coefficient between active ingredients and antioxidant properties
为了研究活性成分含量与抗氧化活性之间是否存在量效关系,根据含量及IC50值计算了各指标间相关系数,总多酚、总黄酮含量分别对DPPH·和羟基自由基的相关系数分别为0.799和0.648,证明总多酚、总黄酮含量分别对 DPPH·清除能力和羟基自由基清除能力有正相关性。
3 结论
130 ℃烘焙不同时间对带壳和不带壳红松种籽衣中活性成分和抗氧化性产生不同影响,适度烘焙的不带壳红松种籽衣的抗氧化能力显著提升。烘焙后的红松种籽衣中成分和性质的改变使其具有更高的利用价值,是酚类和天然抗氧化剂的很好来源,相比于未烘焙种籽衣更适合作为具有抗氧化功能的食品配料。
