超高效液相色谱-四极杆/静电场轨道阱高分辨质谱非靶标筛查测定白酒和饮料中甜菊糖苷
2019-01-05李伟明
冯 峰, 李伟明, 孙 燕,3, 张 峰*
(1. 中国检验检疫科学研究院食品安全研究所, 北京 100176; 2. 番禺出入境检验检疫局综合技术服务中心实验室, 广东 广州 511400; 3. 北京中医药大学, 北京 100029)
甜菊糖苷是从菊科草本植物甜叶菊叶中提取的高甜度、低热量的天然甜味剂,被誉为继甘蔗糖、甜菜糖之后的“第三代健康糖源”[1]。由于其甜度是蔗糖的200~350倍,且属于天然来源,因此,目前越来越多的食品中加入甜菊糖苷以吸引消费者。研究表明,如果长期过量食用甜味剂,会对身体带来较大伤害。我国《食品添加剂使用标准》(GB 2760-2014)中明确规定蒸馏酒中不允许添加甜味剂,配制酒和饮料中的甜味剂的使用也不得超过限量[2]。然而,一些企业为了逃避监管,在白酒和饮料中添加甜味剂的情况仍时有发生。
目前,对于食品中甜味剂的检测,文献报道的大多还是针对人工合成甜味剂的检测,主要有毛细管电泳法[3,4]、液相色谱法[5-8]和液相色谱-串联质谱法[9-15]等。天然甜味剂则因异构体多,成分复杂,目前研究的还较少。范广宇等[13]报道了一种使用亲水作用色谱-液相色谱-三重四极杆质谱同时检测人工和天然甜味剂的方法,但这种方法只能针对特定的甜味剂使用标准品进行检测,无法对不断出现的新合成甜味剂进行快速精准筛查和回顾性分析。
本研究建立了一种基于超高效液相色谱-四极杆/静电场轨道阱高分辨质谱进行白酒和饮料中甜菊糖苷类甜味剂非靶标的筛查方法,该方法不仅可以实现8种甜菊糖苷类甜味剂的精准定量,而且基于筛选出的甜菊糖苷类化合物的标识性碎片离子,还可以对样品中未知甜菊糖苷进行非靶标筛查。
1 实验部分
1.1 仪器与试剂
Q-Exactive四极杆/静电场轨道阱高分辨质谱系统及Dionex UltiMate 3000超高效液相色谱系统(美国Thermo Fisher公司);分析天平XP 105(瑞士Mettler公司); Milli-Q Advantage A10超纯水机(美国Millipore公司)。
甜菊苷(stevioside)、瑞鲍迪苷B(rebaudioside B)、瑞鲍迪苷D(rebaudioside D)、瑞鲍迪苷F(rebaudioside F)和杜克苷A(dulcoside A)购自美国ChromaDex公司;瑞鲍迪苷A(rebaudioside A)、瑞鲍迪苷C(rebaudioside C)和甜菊双糖苷(steviolbioside)购自北京百灵威公司;以上化合物纯度均大于97%。乙腈(色谱纯)和甲酸铵(优级纯)购自美国Fisher公司。白酒和饮料样品购自超市和电商平台。
1.2 溶液制备
标准储备液:准确称取适量标准品,分别用水溶解,配制成1 000 mg/L的储备液,于4 ℃储存。
混合标准溶液:分别取8种甜菊糖苷的储备液,用乙腈-水(65∶35, v/v)配制成10 mg/L的混合标准溶液,于4 ℃储存,使用时根据需要用水或空白白酒样品稀释到所需浓度。
1.3 样品制备
对于白酒样品,准确称取1.0 g样品,用流动相进行5~10倍稀释后,过0.22 μm有机滤膜后上机测定。对于饮料样品,准确称取1.0 g样品,直接过0.22 μm水相滤膜后上机测定。
1.4 色谱条件
色谱柱:Waters XBridge Amide色谱柱(150 mm×4.6 mm, 3.5 μm);柱温:35 ℃。流动相:乙腈-10 mmol/L甲酸铵(65∶35, v/v);流速:0.4 mL/min。进样体积:5 μL。
1.5 质谱条件
加热电喷雾离子源(HESI),负离子模式;喷雾电压:-3.0 kV;毛细管温度:320 ℃;加热器温度:50 ℃;鞘气:氮气,流速为40 arb;辅助气:氮气,流速为5 arb;扫描模式:一级母离子全扫描和数据依赖的二级子离子扫描(full MS/dd-MS2)模式。一级母离子全扫描分辨率:7×104半高峰宽(FWHM);最大注 入时间:200ms;采集范围:m/z150~1 200。数据依赖二级子离子扫描分辨率:1.75×104FWHM;触发阈值:1×105;最大注入时间:50 ms。8种天然甜味剂的质谱分析参数见表1。
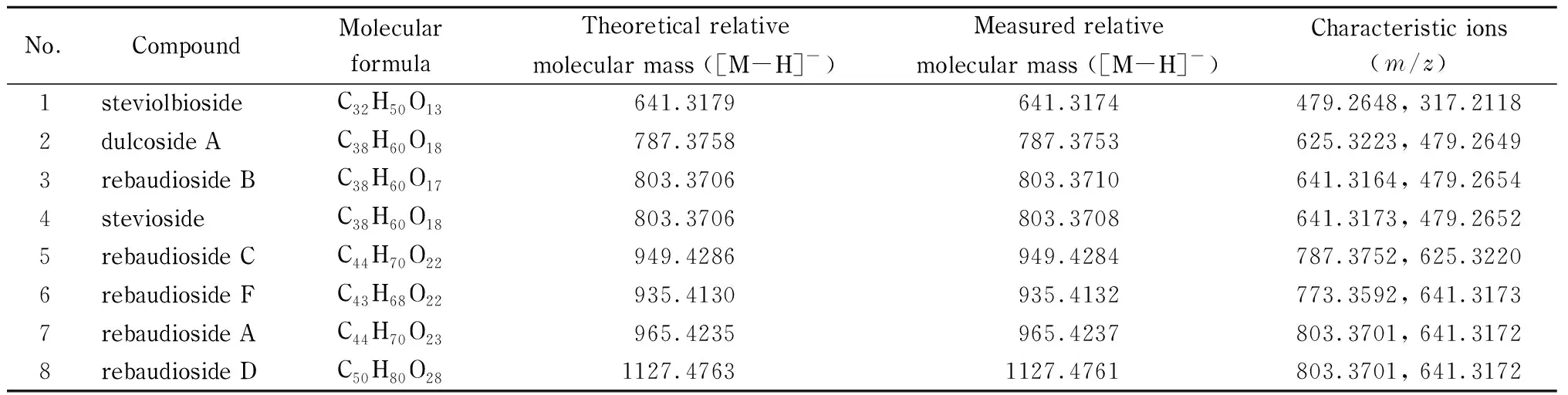
表 1 8种甜菊糖苷的质谱参数Table 1 Mass parameters of the eight steviol glycosides

图 1 8种甜菊糖苷的超高效液相色谱-四极杆/静电场 轨道阱质谱提取离子色谱图Fig. 1 Extract ion chromatograms of the eight steviol glycosides using ultra high performance liquid chromatography-quadrurpole/Orbitrap mass spectrometry
2 结果与讨论
2.1 质谱条件优化
本研究采用Q Exactive高分辨质谱的full MS/dd-MS2模式进行甜菊糖苷类化合物的分析,通过使用目标化合物的精确分子离子质量数,结合二级碎片离子谱的分析,可以实现在没有标准品的情况下,对样品中有无甜菊糖苷类化合物进行精准鉴定。设定母离子的扫描范围为m/z150~1 200,不仅涵盖目前能够获得的8种甜菊糖苷类标准品的质量范围,而且覆盖到了绝大多数甜菊糖苷类化合物的相对分子质量范围,可以对未知的甜菊糖苷类化合物实现非靶标的筛查。在实际扫描过程中,当一级全扫描发现目标列表里的分子离子且信号强度超过预设值后,就会触发数据依赖子离子扫描模式,进而获得对应分子离子精确质量数的二级离子全扫描质谱信息,以实现定性确证。使用超高效液相色谱-四极杆/静电场轨道阱高分辨质谱对实验室已有的8种甜菊糖苷类化合物进行分析,色谱图见图1。
2.2 灵敏度、准确度和精密度
本研究也比较了使用四极杆/静电场轨道阱质谱对目前可以通过商业化的方式购得的甜菊糖苷类化合物纯品进行母离子定量、子离子定量以及样品基质定量结果的影响。结果表明,8种甜菊糖苷使用母离子定量时的线性关系要优于子离子定量的线性关系,在使用母离子定量时,8种甜菊糖苷标准溶液在10~1 000 μg/L范围内线性关系良好(相关系数r2≥0.995)。
过在没有经过稀释的白酒和饮料中准确加入一定量的混合标准溶液,配制成50 μg/L的加标样品,进行回收率分析,以考察基质效应。结果表明,对于饮料样品,基质干扰较少,回收率大于95%,但是白酒样品特别是酱香型白酒样品受样品基体的影响比较大,回收率低于60%(40%~60%)。
为消除白酒基质对甜菊糖苷类化合物定量的干扰,本研究采用基质匹配标准曲线的方法进行校正,分别考察了未稀释、稀释5倍、稀释10倍后白酒样品加标绘制标准曲线的线性关系。结果表明,未稀释白酒样品部分化合物在10~1 000 μg/L范围内相关系数小于0.99,稀释5倍或是10倍后的白酒样品相关系数均大于0.995。考虑到稀释倍数会影响方法的检出限,最终选择稀释5倍的白酒作基质匹配标准曲线,在此条件下测得的线性回归方程、线性范围和相关系数见表2。逐级稀释标准品,并对有信号检出的最低浓度加标样品重复进样3次,用3次响应的信噪比(S/N)均大于3和10来确定检出限和定量限,结果见表2。
回收率的检测为在白酒样品中准确加入一定量的混合标准溶液,用流动相稀释5倍,配制成4个水平(50、100、250、500 μg/kg)的加标样品,每个水平进行3次平行分析。8种甜味剂在线性范围内的平均加标回收率为81.9%~106%, RSD<10%,精密度良好(见表3)。

表 2 8种甜菊糖苷的线性范围、回归方程、相关系数、检出限和定量限Table 2 Linear ranges, regression equations, correlation coefficients (r2), LODs and LOQs of the eight steviol glycosides
Y: peak area;X: mass concentration, μg/L.

表 3 白酒中8种甜菊糖苷的加标回收率和相对标准偏差(n=3)Table 3 Spiked recoveries and RSDs of the eight steviol glycosides in wines (n=3)
-: not detected.

图 2 4种典型甜菊苷类化合物的二级碎片离子谱Fig. 2 Secondary fragment ion spectra of the four typical steviol glycoside compounds
2.3 甜菊糖苷类化合物质谱裂解规律
如Molina-Calle[12,14]所报道,甜菊糖苷类甜味剂属于四环二萜糖苷,这类甜味剂的基础结构为内-贝壳杉烯酸(ent-kaurenoic acid)经羟基化后生成的甜菊醇,分子式为C20H30O3,精确相对分子质量为318.219 5。在甜菊醇的C-19和C-13两个不同位置的碳上接上不同数量的葡萄糖基、木糖基和鼠李糖基,就形成各种不同的甜菊糖苷类甜味剂[15]。据文献[14]报道,目前从甜叶菊中分离纯化的甜菊糖苷类甜味剂达30种以上,这些甜味剂由于缺乏标准品,无法通过传统的方法得到识别和检测。基于从高分辨质谱获取的8种甜菊糖苷类化合物的二级碎片离子精确质量数信息(见表4和图2),对甜菊糖苷类化合物的裂解规律进行了分析。从表4可以看出,甜菊糖苷类化合物的二级碎片离子质谱图中存在m/z479.265 0和317.211 9两个共性特征碎片离子,根据精确质量数可以推断,m/z317.211 9为甜菊醇分子离子峰,m/z479.265 0则是内-贝壳杉烯-葡萄糖碎片离子。其余二级碎片离子则是内-贝壳杉烯-葡萄糖基结合了别的单糖(包括葡萄糖基、鼠李糖基和木糖基,m/z641.316 3、625.322 1和611.306 4)而构成。对比各种甜菊糖苷类化合物的二级碎片离子可以看出,对于甜菊醇的C-19和C-13两个糖苷化位点来说,由于所有化合物在二级碎片离子谱中均看不到单独丢失鼠李糖基和木糖基的碎片离子,所以可推断C-19位更容易发生裂解,最终推断出甜菊糖苷类化合物的裂解规律见图3。
2.4 实际样品测定
采集北京地区市售的7份饮料样品和5份白酒样品进行检测。白酒样品中未检出甜味剂,饮料样品中检出4种天然甜味剂(甜菊苷、甜菊双糖苷、瑞鲍迪苷A和瑞鲍迪苷C),含量未超过国家限量标准。此外,使用full MS/dd-MS2模式对于未有甜味剂检出的白酒样品中所有化合物进行碰撞裂解和二级碎片离子全扫描,并使用本研究发现的m/z479.265 0和317.211 9标识性碎片离子进行提取,未见到明显色谱峰。

表 4 8种甜菊糖苷的化学结构及二级碎片离子精确质量数Table 4 Chemical structures and accurate masses of secondary fragment ions of the eight steviol glycosides
R1: functional group at C-19 unit; R2: functional group at C-13 unit; Nos. 1-20: serial number of carbon unit in steviol glycosides. Glc: glucose (-C6H11O6); Rha: rhamnose (-C6H11O5); Xyl: xylose (-C5H9O5).
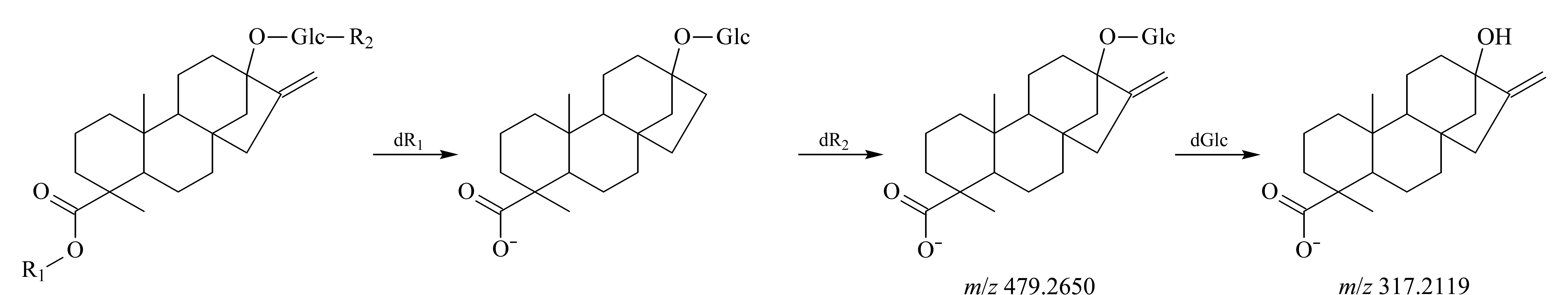
图 3 甜菊糖苷类化合物质谱裂解途径Fig. 3 Mass spectrometry fragment pathways of steviol glycoside compounds dR1: disrupt R1 functional group; dR2: disrupt R2 functional group; dGlc: disrupt glucose functional group.
3 结论
采用亲水作用液相色谱-四极杆/静电场轨道阱高分辨质谱技术,建立了食品中甜菊糖苷类甜味剂快速精准筛查方法,与目前所报道的液相色谱-串联质谱法相比,本方法不仅灵敏度同样满足标准要求,而且不需要标准品即可对样品中是否有菊糖苷进行快速和精准定性。同时,通过研究甜菊糖苷类化合物的质谱裂解规律,鉴定出2个甜菊糖苷类化合物的标识性碎片离子,实现了食品中未知甜菊糖苷类化合物的非靶标筛查。
