喉鳞癌中DNA结合/分化抑制蛋白-2和血管内皮生长因子-C表达及临床意义
2019-01-05吕丹雨秦雪梅陈国辉白广平
孙 青,吕丹雨,秦雪梅, 陈国辉, 白广平
复旦大学附属中山医院青浦分院耳鼻咽喉科(上海 201700)
喉鳞癌临床中较为常见,主要见于中老年人,主要通过淋巴道播散[1]。近年人们关注肿瘤中的淋巴管生成对转移的促进作用,并发现了以血管内皮生长因子-C(VEGF-C)为代表的淋巴管生成因子。研究认为VEGF-C可以与受体VEGFR3结合,促进淋巴管内皮细胞的增殖,为淋巴道转移提供直接的通道[2-3]。DNA结合/分化抑制蛋白-2(ID-2)是近年学者在动物实验时发现的因子,具有分化抑制的特征,主要通过抑制环-螺旋-环转录因子的作用对肿瘤细胞的增殖和转移进行调控[4],其对脉管内皮细胞的增殖可能有明确的作用。本实验通过免疫组化的方法检测喉鳞癌中ID-2和VEGF-C的表达,探讨其临床价值。
资料和方法
1 一般资料 收集2013年1月至2015年12月在我院住院治疗并经病理医师明确诊断、行手术根治的喉鳞癌患者作为观察组,共67例。纳入标准:①临床随访资料完整。②符合WHO中的标准。③患者或家属均签属知情同意书。均留取患者完整的临床资料及术后蜡块组织。排除标准:①伴有其它器官恶性肿瘤。②有口腔及呼吸道手术史。③伴有遗传及免疫性疾病的患者。④术前放、化疗的患者。其中男34例,女33例,年龄43~88岁,平均58.8岁。选择声带息肉的组织45例作为对照组,其中男21例,女24例,年龄40~78岁,平均56.7岁。两组常规资料的比较差别无统计学意义(P>0.05),具有可比性。
2 ID-2和VEGF-C表达的检测 ID-2和VEGF-C均购自北京中杉金桥生物公司,均为浓缩液。先行预实验,选择染色最好的浓度用于正式实验(ID-2为1∶200,VEGF-C为1∶250)。正常实验均由同一技师完成,一次性操作完成,严格按说明书的步骤进行,DAB显色,减少人为误差。
3 ID-2和VEGF-C结果的判定 ID-2和VEGF-C的定位是细胞质,二维方式评分,即:着色强度:无为0分;弱为1分,中等为2分,强为3分;阳性率:选择2个高倍视野,取平均值,以<5%为0分,6~10%为1分,以11~30%为2分,以31~50%为3分,以>50%为4分。依着色强度和阳性率的评分之作为最终评定依据,≤3分为阴性,以>3分为阳性。
4 统计学方法 应用SAS 6.12统计学软件分析,采用χ2检验、线性相关性分析,以P<0.05为差异有统计学意义。
结 果
1 两组中ID-2和VEGF-C表达的比较 两组中ID-2和VEGF-C表达的阳性率差异有统计学意义(P<0.05)。见表1,见图2。
2 观察组中ID-2和VEGF-C的阳性率在不同临床特征分组中的比较 观察组中ID-2和VEGF-C的表达与增殖指数、脉管累犯、淋巴结转移相关,ID-2的表达与肿瘤的分化程度和肿瘤最大径密切相关,见表2。
3 观察组中ID-2和VEGF-C的相关性 应用线性相关分析,显示观察组中ID-2和VEGF-C的表达具有正相关性(r=0.58,P=0.040)。
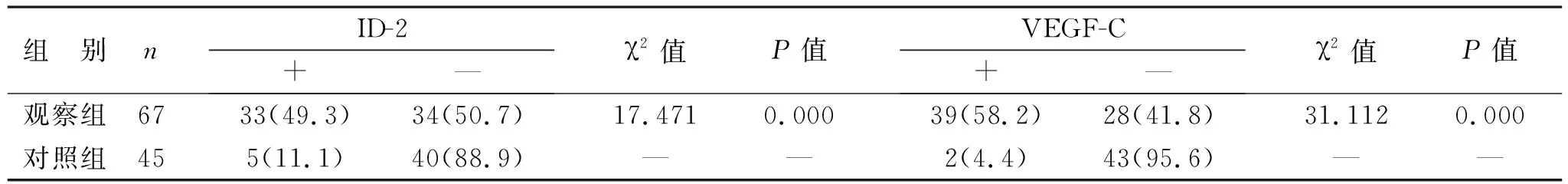
表1 两组中ID-2和VEGF-C阳性率的比较[例(%)]
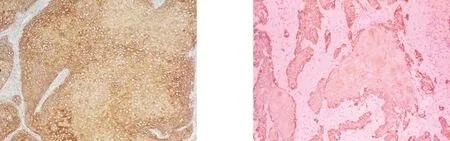
图1 ID-2在喉鳞癌中阳性表达 图2 VEGF-C在喉鳞癌中阳性表达
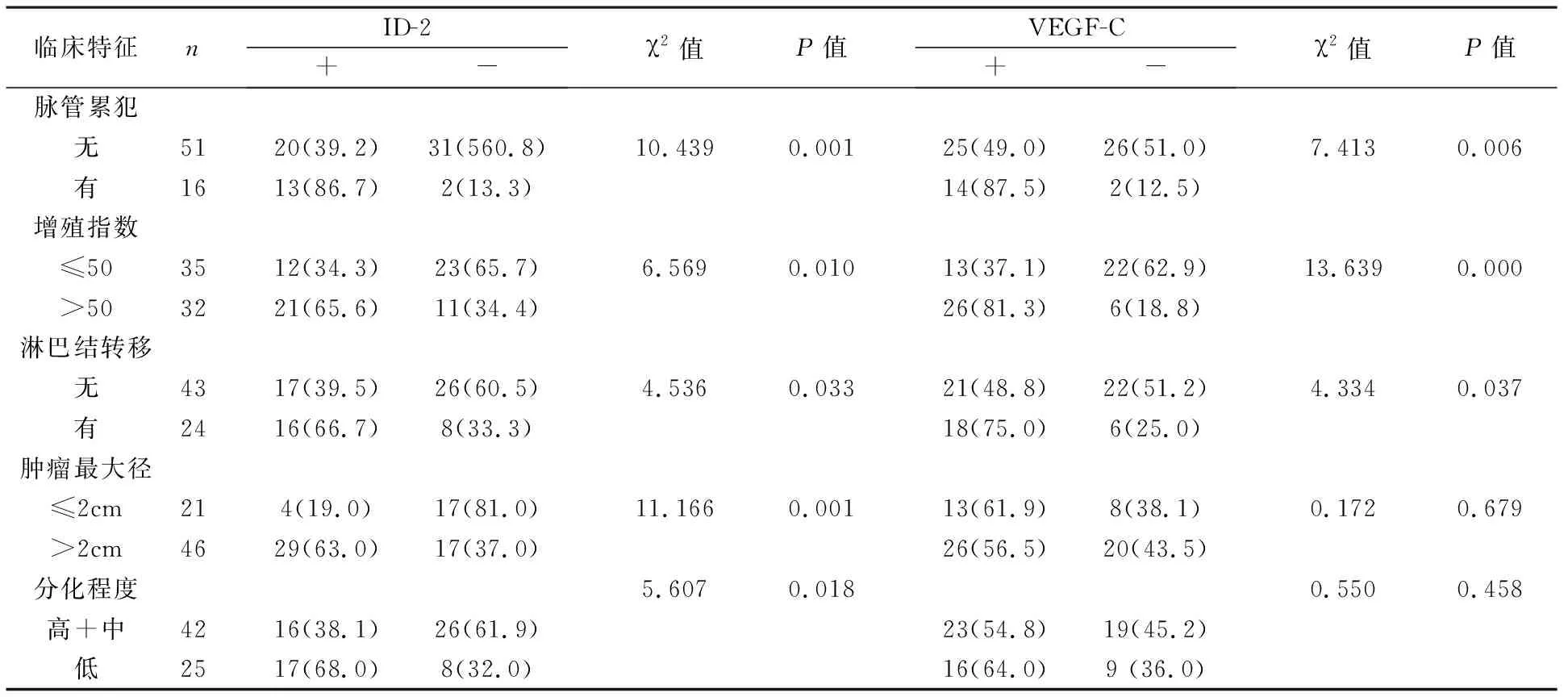
临床特征n ID-2+- χ2值P值 VEGF-C+- χ2值P值脉管累犯无51 20(39.2)31(560.8) 10.4390.001 25(49.0)26(51.0) 7.4130.006有16 13(86.7)2(13.3) 14(87.5)2(12.5)增殖指数≤5035 12(34.3)23(65.7) 6.5690.010 13(37.1)22(62.9) 13.6390.000>5032 21(65.6)11(34.4) 26(81.3)6(18.8)淋巴结转移无43 17(39.5)26(60.5) 4.5360.033 21(48.8)22(51.2) 4.3340.037有24 16(66.7)8(33.3) 18(75.0)6(25.0)肿瘤最大径≤2cm21 4(19.0)17(81.0) 11.1660.001 13(61.9)8(38.1) 0.1720.679>2cm46 29(63.0)17(37.0) 26(56.5)20(43.5)分化程度 5.6070.018 0.5500.458高+中42 16(38.1)26(61.9) 23(54.8)19(45.2)低25 17(68.0)8(32.0) 16(64.0)9 (36.0)
讨 论
喉鳞状细胞癌是发生于喉粘膜鳞状上皮的恶性肿瘤,肿瘤形成常表现为失控性增生和分化障碍,对周围组织和器官进行侵犯,形成浸润性病变[5]。肿瘤多为高和中分化的,具有角化现象,部分病例显示出明显的异型增生,表现为弥漫性生长,出现低分化的特征,此种肿瘤的预后差[6]。肿瘤间质可以观察到血管和淋巴管的新生,也能观察到比正常喉粘膜的间质更多的淋巴管,尤其是D2-40和VEGFR3阳性的淋巴管,这些淋巴管增生后与机体原有的淋巴循环相连,为肿瘤细胞进入淋巴道创造管腔条件。淋巴管内皮细胞出现明显增殖,也可以表现出较高的增殖指数,其中促进增殖最重要的因子是VEGF-C和VEGF-D,二者也被学者定义为淋巴管生长因子。VEGF-C是最早在血管内皮生长因子家族中发现的淋巴管生长因子,作用最强,效果最明显,其作用方式是通过VEGFR3实现的,VEGF-C/VEGFR3可能是作用的直接通路,能使淋巴管内皮细胞增殖,表现为DNA复制明显。当细胞增殖到一定程度,在淋巴液的物理性冲击作用下,可以形成具有功能的管腔,并与原有淋巴循环相通。肿瘤细胞通过此途径形成转移性播散。IDs蛋白是一类相对分子量为13-20kDa的小分子蛋白,其编码的蛋白含有119-199个氨基酸残基,此结构域含有亲脂的α螺旋序列,在α螺旋中高度保守螺旋区通过其疏水基团的作用,形成二聚体,发挥转录调控作用,其对转录的调控作用可能是通过核因子起作用。ID-2是家族中的重要成员,具有所谓的“永生化”的结构和功能特征,其特点是能阻止细胞分化,使细胞发育停滞,呈明显的增生状态。近年也有研究显示ID-2通过细胞表面的配体-受体发挥作用,其特点是通过泛素蛋白的作用来降解相关基质通路来完成的。也有研究认为ID-2过度表达可以延迟细胞老化,对调控细胞定向分化和胚胎发育有一定作用。还有研究认为ID-2可以促进初始器官的形成,并对成熟器官细胞的凋亡有一定作用[7]。有学者认为ID-2高表达时可以促进血管的生成,使CD34阳性的血管新生作用增强,同时对淋巴管的生成也有明显的调节作用,因此ID-2的作用谱可能更广泛。
本研究结果显示观察组中ID-2和VEGF-C的表达明显高于对照组,提示二者具有癌基因样的作用,二者是促进肿瘤形成的重要因素,二者的作用与对细胞的增殖生长的调控有关。结果显示观察组中ID-2和VEGF-C的表达与病变的增殖指数、脉管累犯和淋巴结转移密切相关,提示ID-2和VEGF-C表达上调后能引起细胞增生,主要表现为肿瘤性的失控性增生,也表现为对脉管的侵犯和破坏,继而形成淋巴道播散。ID-2是多种细胞的增殖因子,当其受到肿瘤性因子刺激时表达上调,其调控途径主要有两种,一是bHLH依赖途径(依靠CDKs抑制剂的调节发挥作用),另一个是bHLH非依赖途径(通过pRB、Ets结构域转录因子发挥作用)。结果显示ID-2高表达与肿瘤的分化程度密切相关,提示ID-2可以调节肿瘤的分化过程,并对起源细胞进行结构性的改建,同时对邻近组织的直接蔓延起促进作用。ID-2升高时可以调节鳞状细胞癌、腺癌和小细胞癌的分化,而分化是细胞由幼稚到成熟时的发育过程,因此其也是细胞在生长过程中不同发育时期细胞表现的形态反映,ID-2表达上调,能使细胞停滞于幼稚阶段,肿瘤细胞的异型性更明显,与起源组织的差异小,细胞核染色深,细胞的形态多种多样,此类细胞具有高度增殖及高度侵袭的特征。本结果也显示出ID-2的表达与肿瘤最大径密切相关,提示ID-2对肿瘤生长过程具有明确的调控作用。相关分析显示观察组中ID-2和VEGF-C的表达具有正相关性,提示二者具有正向协同作用,ID-2对淋巴管生成因子具有促进作用[8]。因此ID-2的调控途径可能更多,其也常作为上游基因,对下游相关信号进行调节,如VEGF-C、EGFR和PI3K/AKT等信号通路,引起淋巴管内皮细胞细胞增生繁殖,肿瘤细胞在淋巴管内迁移形成淋巴结转移[9-10]。但是否ID-2/VEGF-C/VEGFR-3是一个经典通路尚有待证实。
总之,ID-2和VEGF-C在喉鳞癌组织中表达明显升高,且具有协同作用,对肿瘤的形成和发展有一定的调节作用。
