儿童特发性肺含铁血黄素沉着症
2019-01-05彭万磊
■ 文 彭万磊
特发性肺含铁血黄素沉着症(idiopathic pulmonary hemosiderosis,IPH)是一种少见的、病因不明的肺部弥漫性出血性疾病,1864年由Virchow首次报道,1931年Ceelan对其临床特点进行了总结。IPH多发生于小于10岁的儿童,成人较少见,男女患病无差异。国内尚无准确的发病率统计数据。
IPH临床异质性大,无特殊治疗手段,病情易反复,病程呈慢性过程,给患者生活质量带来严重负面影响,甚至致死。IPH主要的死亡原因为急慢性呼吸衰竭、肺出血以及肺纤维化所致的肺心病。随着诊疗措施的改进,IPH的年生存率有所提 高,1983年Chryssanthopoulos随访希腊30例IPH患儿,其5年生存率为60%;1999年美国的Saeed研究报道称其5年生存率为86%。
一、病因和发病机制
IPH的病因及发病机制目前尚不清楚,多数研究认为IPH和免疫功能紊乱有关。有报道认为,IPH的发病与食物过敏有关,如牛奶、麦胶等,2008年Khemiri等通过对突尼斯确诊的10例IPH患儿进行乳糜泻筛查,发现仅3名患儿合并乳糜泻,通过含麦胶食物回避结合激素治疗,1例因停止回避麦胶而再次出现症状,提示麦胶过敏与IPH相关,但不是唯一原因。2008年Taytard等报道法国多中心收治的25例IPH患儿中20%合并唐氏综合征;2007年Gencer等报道土耳其同胞两姐妹先后诊断为IPH,同时发现其血清IgE升高明显,提示IPH发病可能与遗传或免疫因素相关。2000年法国Le Clainche等对15例IPH患儿观察随访10~36年,发现其中4例患儿在随访期内出现免疫相关疾病,认为抗中性粒细胞胞浆抗体阳性可能是影响预后的不良因素之一。1999年Milman等对IPH患者的肺组织进行活检,未发现有免疫复合物沉着及血管炎的表现。
这些研究都没有发现IPH与免疫相关的阳性证据,免疫功能紊乱与IPH的关系还没有得到充分证实。另外,1983年Cassimos等通过对希腊30例IPH患儿的研究分析结果提示,IPH发病可能与环境、季节、有机磷农药甚至营养状态有关,但目前尚无更多数据支持该假说。
目前国内外较为认可的是自身免疫假说。临床报道IPH患儿可合并多种自身免疫性疾病,如继发肾脏损伤的Good-Pasture综合征;血清抗肾小球基膜(GBM)抗体肾小球和肺泡壁的毛细胞血管基膜有线状免疫球蛋白沉积、感染或接触特殊物质后产生抗体沉着于肾脏和(或)肺泡壁的毛细血管基底上,产生自身免疫反应破坏毛细血管壁,继而引起出血。有研究报道,20%IPH患儿合并唐氏综合征遗传缺陷,国内及国外均有同胞先后发病报道,提示该疾病可能存在先天遗传因素。杨文萍等报道的3例IPH患儿中2例为同胞兄弟,肺组织均有不同程度肺弹力纤维断裂,考虑是否存在肺先天性弹力纤维发育不良,后天受到各种因素作用,使肺弹力纤维断裂引起基底膜断裂,如肺毛细血管通透性增加,出现肺出血。
IPH的病因及发病机制均不清楚,目前的假说涉及免疫、遗传及病理学等基础,故需大样本分子生物学、病理活检等深入研究。

增强CT显示双侧胸部弥漫性磨玻璃影
二、临床表现与诊断
临床上IPH以缺铁性贫血、反复咳嗽、咯血及胸部影像学弥散性肺实质浸润等为主要特征。IPH是一种慢性肺部出血性疾病,其病程常可分为四期:(1)急性出血期:患者常急性起病,以面色苍白、乏力及咯血为主要表现,严重者可出现心功能衰竭,肺部体征不一,胸部影像学上可见大小不一、浓淡不同的云絮影,可在数日消减,也可在短期内反复发生;(2)慢性反复发作期:此期患者咳嗽、胸痛等症状反复,可咳出少量新鲜血丝或者陈旧性血痰,影像学显示肺纹理增多,呈细网状、网粒状,多位于肺中野内带,也可反复合并少许新鲜出血灶,此期一般持续6~12个月,甚至可长达10年;(3)静止期:肺部出血停止,临床症状基本消失;(4)后遗症期:此期主要表现为由于反复出血导致的肺部广泛纤维化,临床上以不同程度肺功能不全为主要表现,可合并有肺不张、肺气肿、支气管扩张或者肺心病,胸部X线片可见肺纹理增多,小囊样透亮区或者纤维化。
IPH确诊需在胃液、痰液或者肺泡灌洗液中找到含铁血黄素巨噬细胞(hemosiderin-laden macrophages,HLMs),并除外其他疾病:以咳嗽、咯血为主要表现者应同各种原因引起的左心房高压、肺炎、肺结核、气道异物、肺胶原性血管病等鉴别;以小细胞低色素贫血为主要表现者,应与溶血性贫血、营养性缺铁性贫血等其他血液系统疾病相鉴别;有条件可以行肺活检与血管炎等疾病进行鉴别。
三、治疗药物
IPH患者肺部常呈弥漫性出血,而且容易反复发作,但病因及诱因不明确,因此需要定期随访临床症状体征(咳嗽、咯血及呼吸困难情况)、血常规和胸部影像学(最好是肺部CT)检查,以监测病情变化,动态调整治疗方案,预防和减少肺部出血,避免肺部反复出血所导致的纤维化和严重出血致死的风险。IPH的治疗以肾上腺糖皮质激素为主,其疗效和地位肯定。
1.肾上腺糖皮质激素 国内外公认肾上腺糖皮质激素是治疗IPH的一线药物。肾上腺糖皮质激素能够快速有效地控制肺部活动性出血,尤其在IPH的急性出血期有重要作用;在疾病的间隙缓解期,长时间小剂量应用肾上腺糖皮质激素可减少肺部出血反复发作,甚至可以减缓肺部纤维化。目前认为肾上腺糖皮质激素作用机制为:(1)抗炎作用,抑制抗原抗体反应,抑制巨噬细胞进入炎症区域及其吞噬作用,减轻炎症反应;(2)改善毛细血管通透性,减少毛细血管渗出,减少出血;(3)减少巨噬细胞对含铁血黄素的摄入,减少其在肺组织的沉积,从而减轻对肺组织反复损伤,延缓肺纤维化。
在IPH治疗的不同病变阶段中,激素的剂型以及剂量的选择有所不同。急性出血期静脉使用激素可以快速渗透到病变的部位,控制出血。激素剂量根据患儿出血的严重程度、贫血程度以及是否有进行性出血等情况进行调整。针对IPH急性出血期,目前激素的使用剂量和给药途径尚无统一的定论。有较多的临床研究报道显示,急性出血期采用静脉激素冲击治疗,治疗期间一般采用甲泼尼龙2mg/(kg·d)~20mg/(kg·d),3天后可以将治疗用量改为口服泼尼松 1mg/(kg·d) ~ 2mg/(kg·d),疗效肯定,不良反应较少,之后激素减量需缓慢,参考临床表现和影像学结果,低剂量长时间维持至少6个月以上。维持治疗随访中仍有患者肺部出血性病变反复发生,因此不能急于减药和停药。
2013年日本DoiT等报道3个治疗中心20年间有9例IPH患者按照以下方案治疗:急性出血期静脉应用地塞米松 0.8mg/(kg·d),3天;急性出血期后间隔数周至数月以小于 0.3mg/(kg·d)的剂量单次静脉注射,病情缓解后可持续性每月静脉滴注1次。该项临床研究平均随访观察11年(2.4~16.9年),无1例死亡,5例患者完全停药,平均用药时间5.5年,1例持续预防性用药,3例无呼吸道症状但仍需治疗性用药,该研究表明长时间小剂量使用激素可以改善患儿预后并减少激素不良反应。
来自法国的研究报道显示,根据患儿体表面积按照甲泼尼龙300mg/(m2·d),每月3天,症状严重者加用口服泼尼松1mg/(kg·d),在对25例患儿长达5年的随访中发现其临床症状、影像学及生化指标都有了明显的改善,但其中的13例患儿因激素耐药或者激素副作用停药,加用免疫抑制剂。因此,激素的剂量选择尚需进一步的研究确定。
长期系统性使用激素将不可避免产生相应的不良反应,如体质量增加、高血压、骨质疏松、易感染等。为了减少系统性激素的用量和不良反应,有研究者提出呼吸道吸入激素疗法辅助治疗。目前的研究报道多采用局部吸入布地奈德。布地奈德是一种用于治疗和预防哮喘发作的吸入类固醇激素,局部抗炎活性强,故广泛用于局部抗炎。有研究报道,应用布地奈德每次1mg,2~3次/天,IPH患儿症状可以获得长期缓解,且因全身使用激素引起的Cushing面容及体质量增加等不良反应消失。临床表现较轻者,给予吸入布地奈德,每次1mg,2~3次/天;丙酸氟替卡松2吸/天治疗,也可以取得较好疗效。但由于对吸入激素药物吸收利用情况、药物剂量调整及控制肺部出血的作用尚无定论,临床应用尚不广泛,需要进一步获取证据支持。局部应用激素可以明确减少系统性激素应用引起的不良反应。
关于IPH的激素治疗,疗效肯定,治疗模式多样,疗程不确切,目前缺乏大样本临床研究。激素的剂量、剂型、疗程和疗效的关系不明确,多采用个体化治疗调整。临床医师应掌握激素使用的核心原则:控制和减少肺部反复出血的发生,防治肺功能衰减;尽量采用小剂量长疗程维持,使激素的不良反应控制在最小可以耐受的范围。
2.免疫抑制剂部分患儿对激素治疗产生依赖甚至无效,免疫抑制剂可以作为IPH治疗的二线选择。针对儿童IPH患者,由于免疫抑制剂的诸多不良反应,同时疗效不确切,因此通常不作为首选。当IPH患儿对肾上腺皮质激素效果不佳或产生激素剂量依赖时,或肺功能持续下降,疗效不能维持时,可考虑选择加用或单用免疫抑制剂进行治疗。常用的免疫抑制剂有6-巯嘌呤(6-mercaptopurine,6-MP)、硫唑嘌呤(azathioprine,Aza)、环孢 素 A(cyclosporine A,CyA)、环 磷 酰 胺(cyclophosphamide,CTX)等。
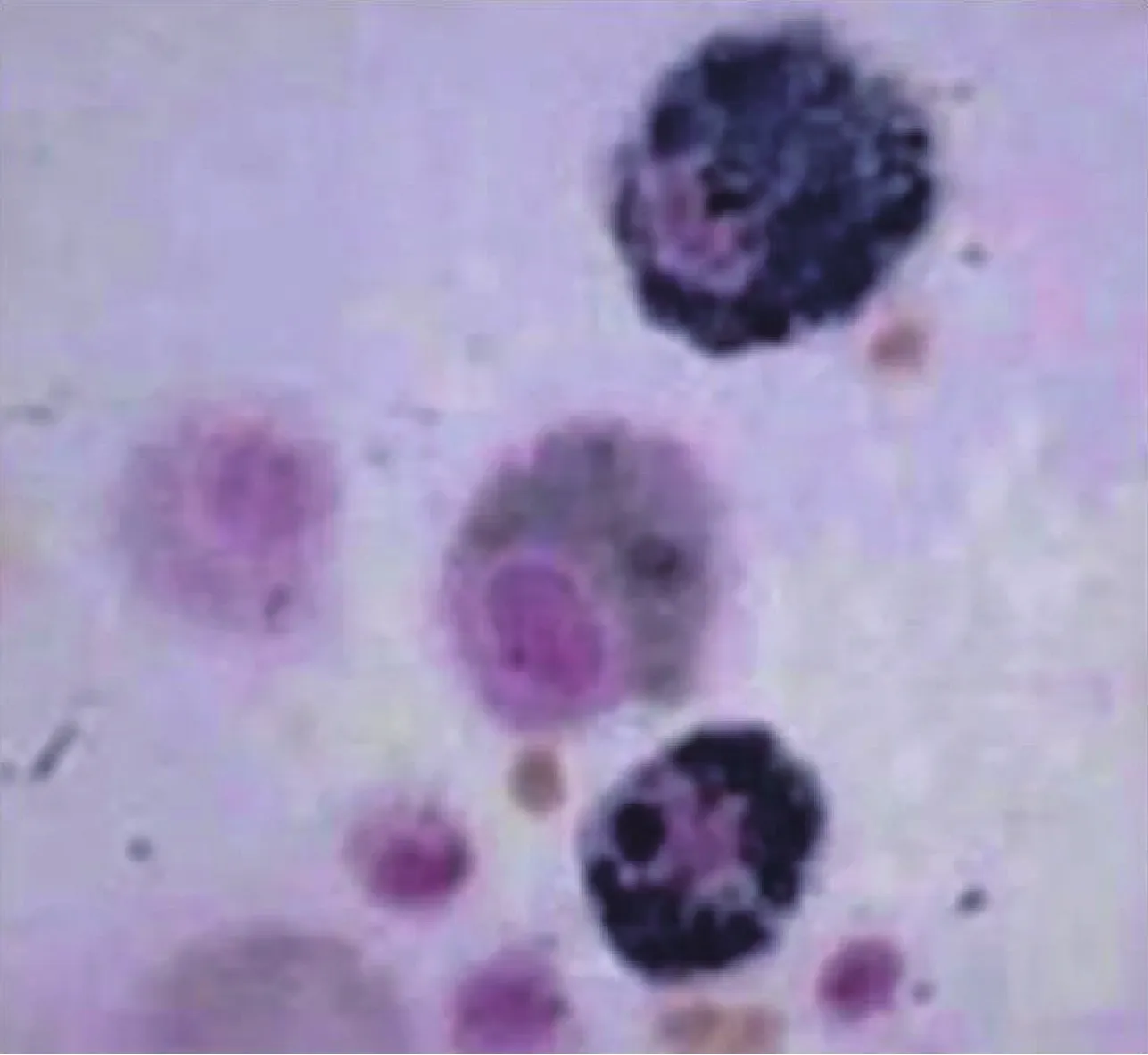
灌洗液细胞学检查显示含铁血黄素巨噬细胞
(1)6-MP用 于 治 疗 IPH, 常与激素联合应用,急性出血期口服泼尼松2mg/(kg·d),4周内逐渐减少用量直至停药,同时开始口服6-MP60mg/(m2·d),维持治疗3年,有一定的疗效。Aza同6-MP相似,可用于治疗IPH,小剂量的Aza联用肾上腺皮质激素有较好的效果,Aza的剂量从 1mg/(kg·d)~ 2mg/(kg·d)增加到 3mg/(kg·d)~ 5mg/(kg·d),病情控制后适量维持约1年。由于个体间Aza及6-MP代谢相关酶的活性不同,在使用Aza及6-MP时,约有20%~30%的病例出现肝功能损害、胰腺炎等不良反应,可以出现在使用的任何阶段,但多出现在使用的前4周,治疗过程中注意监测肝功能、血常规等各项指标,做到调整剂量个体化。
(2)CyA大量基础研究表明,CyA可以减轻不同原因引起的肺纤维化,诱导肺组织上皮细胞的凋亡,最终改善肺间质纤维化,故可以在IPH晚期肺纤维化时应用,用量为5mg/(kg·d),但目前尚无 CyA 应用于IPH患儿的临床报道,需临床研究提供循证支持。
(3)CTX 2013年Flanagan等报道应用CTX与激素联合治疗单用激素仍反复肺出血的IPH患者,CTX 剂量2mg/(kg·d),活动出血停止,逐渐减停,提示CTX联合激素治疗可以应用于单用激素无效者。但2003年台湾报道1例患儿在剂量为2mg/(kg·d)时持续使用1年后出现血小板减少症,有其他脏器出血风险,因此在长时间使用过程中应注意观察血小板情况,避免出现血小板减少症。
3.抗疟疾药 抗疟疾药有抗炎、免疫抑制和免疫调节作用,目前临床广泛用于免疫性疾病的治疗,临床上常使用的有羟氯喹及氯喹。IPH的发生可能与免疫紊乱相关,且对免疫抑制治疗有效,可在激素控制欠佳或病情反复时加用免疫抑制剂,急性期作为激素的补充治疗,缓解期可单用。其中羟氯喹的不良反应较少,故应用较广。
2010年Almeida报道,在急性期予以泼尼松和羟氯喹的治疗,羟氯喹剂量为 4.5mg/(kg·d)~ 6mg/(kg·d),恢复期继续口服羟氯喹,并将泼尼松逐渐减量至停药,改为吸入激素,即在常规激素使用的基础上加用羟氯喹,可以改善IPH生存情况,但同时也提示对年长、病程长、既往有咯血史及黄疸等情况的患者,治疗反应欠佳,但尚需临床资料提供循证医学证据支持。
4.祛铁剂 IPH患儿肺部反复出血,三价铁沉着于肺组织中是导致进行性肺纤维化的主要因素,对患儿长期预后影响重大,减轻其对肺组织损害是改善患儿长期预后的重要治疗。2000年臧晏等对5例IPH 患儿使用除铁灵 30mg/(kg·d),持续10h静脉滴注,前5天,每日1次,之后2天1次,连续5次,总疗程15天,通过对患儿血红蛋白、血清铁、铁蛋白、尿铁蛋白等检测,得出除铁灵祛铁有效,且对血红蛋白中二价铁影响小、未发生不良反应,证实使用祛铁药治疗IPH的可行性。但IPH患儿因反复出血,机体呈缺铁状态,且铁鳌合剂有发生不良反应的风险,故临床中在IPH患儿中是否使用祛铁剂存在一定争议,尚缺乏循证医学证据支持。
5.中药 中医认为IPH属“咳喘”“血证”“虚劳”范畴。胡波等在治疗时一方面遵循活血化瘀治疗,改善肺微循环,防治肺纤维化的原则;另一方面通过扶正祛邪,提高机体抗病能力,减少反复发作,在以中医为主的治疗下,在2011年报道对16例患儿进行观察随访,获得痊愈1例,显效11例,有效4例的结果。中药提取物如雷公藤多苷、姜黄素等可减缓鼠的肺纤维化,但尚无应用于临床的报道可供参照。中药所含成分复杂,疗效不确切,使用时应慎重。
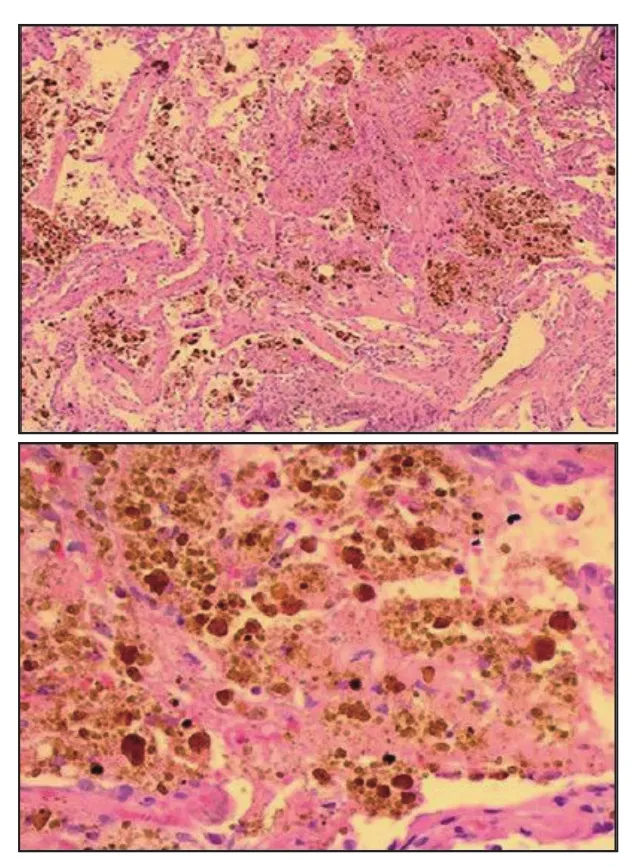
肺活检显示丰富的含铁血黄素巨噬细胞组织
6.肺移植 IPH后遗症期,患儿肺纤维化明显,肺功能受损严重,不可逆转,严重影响患儿生活质量,最终可导致死亡。早年有学者对病情反复、肺纤维化病变明显的IPH患儿进行双侧肺移植,但3年后IPH复发,近年亦无新的有关IPH的进行肺移植治疗案例报道,其可行性尚待进一步论证。
7.对症支持治疗 在IPH病情发展的不同阶段,除疾病本身,需及时观察及解决的问题不同,对症处理及相应的支持治疗也有所区别。
(1)急性出血期 该期存在的主要问题为出血引起的呼吸道阻塞及贫血,通过吸氧纠正低氧血症,伴严重出血者,常规供氧措施不能满足正常氧耗时,可以积极予以高频通气模式机械通气,呼气末正压通气可能具有填塞作用,供氧同时减少肺泡内出血。当发生严重的肺大出血,机械通气无法改善呼吸衰竭时,体外膜肺的及时应用也可以有效地降低死亡风险,为激素等治疗争取宝贵时间。急性出血期常伴有严重的贫血,甚至导致失血性休克,同时有呼吸道阻塞,可以进一步加重心脑肾等重要脏器缺血缺氧,及时予以红细胞输注改善机体缺血缺氧情况也是重要支持措施。
(2)慢性反复发作期 该期大部分患儿仍长时间使用激素或者免疫抑制剂,抵抗力差,可予以免疫调节药物增强免疫力,预防感染发生。研究发现,长时间应用糖皮质激素并不能改变肺纤维化患儿的长期预后,因此,IPH晚期是否使用其他药物减缓肺纤维化尚需进一步研究。IPH主要治疗药物大多有抑制机体免疫功能的副作用,长期使用过程中,应密切监测,并予以对应预防措施防治严重不良反应发生,减少非IPH原因引起的死亡,若患儿居于某感染性疾病高发区,必要时还可定期予以相应药物以预防严重的特殊病原菌感染;有服用激素者应长期予以钙剂补充预防骨质疏松;持续性缺铁性贫血患儿,必要时也应予以补充铁剂,甚至补充促红细胞生成素等予以纠正贫血;使用激素或免疫抑制剂期间及停药后一段时间,患儿应避免接种疫苗。
虽然随着近年来对IPH治疗措施及剂量研究的深入,患儿可以得到缓解甚至完全治愈,生存率较之前上升,但仍有部分患儿肺部出血反复,难以控制,死于肺部大出血,且尚无大样本IPH相关流行病学、病理等基础研究报道。IPH的病因及发病机制不明确,诊疗技术的改进依赖临床经验,故仍需大量的针对IPH的临床及基础研究。(注:最新的干细胞治疗对本病所致肺纤维化已取得突破性进展)
[资料来源] 彭万磊综述,于洁审校.儿童特发性肺含铁血黄素沉着症的治疗.儿科药学杂志,2016,22(7):48-52.
