基于RSM和MLP-ANN的草莓果浆超声酶解参数优化
2019-01-04丛嘉昕宋江峰李大婧刘春泉包怡红
丛嘉昕,宋江峰,李大婧,刘春泉,包怡红
(1.东北林业大学林学院,黑龙江 哈尔滨 150036; 2.江苏省农业科学院农产品加工研究所,江苏 南京 210014)
由于草莓果实含有大量果胶质、粗纤维等成分,直接打浆后的颗粒较大,出汁率较低,且过于黏稠[1],通过酶制剂浸解和进一步液化,其出汁率和可溶性物质提取率将明显提高[2-3]。刘兴艳等[4]、余森艳等[5]和王新惠等[6]采用单一酶或复合酶系酶解草莓果浆,提高了草莓果浆的出汁率。同时,由于酶解使难消化的多糖降解,转变成可溶性膳食纤维、单糖和寡糖等,还可以提高其生物利用率,使草莓的营养成分更多地被人体吸收利用。此外,刘莹等[7]在研究复合酶制剂对混浊苹果汁品质的影响时发现,若能有效控制酶解过程,复合酶制剂可以维持果浆的混浊稳定性,且能减弱褐变,使果浆保持良好的色泽。
已有相关试验结果证实,影响超声辅助草莓果浆酶解效果的因素主要有酶添加量、超声功率、酶解时间等,数学建模是检验不同因素对超声酶解的影响并获得最佳工艺条件的有效手段,其中,响应面法(RSM)是将建模和过程优化集于一体的数学统计方法,能够模拟各种输入因素对输出响应值的影响,分析各种因素之间的相互作用并确定因素水平的最优区域,被广泛应用于活性成分提取的工艺优化[8-9]。人工神经网络模型(ANN)具有从试验数据中学习的能力,能有效地处理非线性关系以及预测建模[10],已被应用在微波辅助提取无花果黄酮[11]、超声辅助酶提取杏鲍菇蛋白[12]、山竹粉总酚提取[13]、微波真空膨化浆果脆片[14]等工艺的优化,但未见应用于草莓果浆酶解工艺方面。因此,本研究对超声辅助酶解草莓果浆参数(复合酶添加量、超声功率和酶解时间)进行研究,通过建立RSM和ANN模型寻求较优的参数组合,以期为提高草莓果浆酶解品质提供参考。
1 材料与方法
1.1 材料与试剂
凤凰草莓由江苏省农业科学院园艺所提供。主要试剂:果胶酶(60 000 U/g)、纤维素酶(40 000 U/g),食品级,由宁夏夏盛实业集团有限公司生产;浓盐酸、无水乙醇、氯化钾、无水乙酸钠,均为国产分析纯。
1.2 仪器与设备
JYL-C012打浆机,由九阳股份有限公司生产;KH7200DB超声波清洗器,由昆山禾创超声仪器有限公司生产;BS-224-S电子天平,由赛多利斯科学仪器(北京)有限公司生产;WYA-2S数字阿贝折光仪,由上海易测仪器设备有限公司生产;HH-6数显恒温水浴锅,由上海江星仪器有限公司生产;Tg16-WS台式高速离心机,由长沙湘仪离心机仪器有限公司生产;UV-6300紫外分光光度计,由上海美普达仪器有限公司生产;FE20 pH计,由梅特勒-托利多仪器(上海)有限公司生产。
1.3 试验方法
1.3.1 超声酶解草莓果浆 将新鲜的草莓去蒂,用1%食盐水冲洗后,在清水中漂洗干净,沥干水分,迅速置于-80 ℃的超低温冰箱冷冻后,转移至-18 ℃冰箱保存,待用。用时于室温下解冻,用打浆机打浆2 min,称取草莓果浆液20.0 g,用1 mol/L的盐酸溶液调节pH为3.5,加入一定量果胶酶和纤维素酶(1∶5,质量比)的复合酶,置于超声装置中处理一段时间后[超声温度控制在(40±3) ℃],果浆加热至65 ℃钝化酶活性,得到草莓果浆酶解液。
1.3.2 品质指标测定方法
1.3.2.1 可溶性固形物含量 参照GB 12295-1990[15]水果、蔬菜制品可溶性固形物含量的测定方法,用阿贝折光仪测量折射率,在折光仪上直接读出可溶性固形物含量(SSC)。
1.3.2.2 花色苷含量 采用He等[16]的方法,略作修改。准确称取1.0 g草莓酶解液,用10 ml 80%(体积比)乙醇溶液于36 ℃水浴搅拌浸提1 h,之后于10 000 r/min离心10 min,收集上清液,反复操作浸提、离心,直至离心管中沉淀褪成无色,将上清液过滤并定容至50 ml。取1 ml提取液,分别用0.025 mol/L KCl-HCl缓冲液(pH 1.0)和0.4 mol/L HAc-NaAc缓冲液(pH 4.5)稀释至10 ml,静置平衡,以蒸馏水为对照,分别在520 nm和700 nm波长处测定吸光值(OD),然后通过公式(1)和(2)计算草莓果浆中花色苷含量。

(1)
Abs= (OD520-OD700)pH1.0-(OD520-OD700)pH4.5
(2)
式中:Abs为样品的光吸收值;MW为天竺葵-3-O-葡萄糖苷的相对分子质量(433);DF为稀释倍数;ε为天竺葵-3-O-葡萄糖苷的消光系数(22 400);L为光程长(1 cm);m为草莓酶解液质量(g)。
1.3.3 CCD试验设计 前期单因素试验结果表明复合酶添加量(x1)、超声功率(x2)和酶解时间(x3)对草莓果浆酶解效果有重要影响,因此,以x1、x2和x3为变量,可溶性固形物含量(Y1)和花色苷含量(Y2)为响应值,根据中心组合设计(CCD)原理,进行试验研究,试验因素与编码值如表1所示。共设20个试验点,其中14个为析因点,1个为中心点,中心点试验重复6次,以估计误差。
表1草莓果浆超声酶解FCCD因素与水平
Table1Factorsandlevelsusedinface-centeredcentralcompositedesign(FCCD)forultrasonicenzymolysisofstrawberrypulp

因素水平-10+1x1(%)0.040.060.08x2(W)150180210x3(min)102030
以-1,0,1编码分别代表自变量低、中、高水平。x1、x2、x3分别表示复合酶添加量、超声功率、酶解时间。
1.3.4 模型建立
1.3.4.1 RSM模型 由最小二乘法拟合二次多项方程:
(3)
式中,n=3,方程转化为:
Y=β0+β1x1+β2x2+β3x3+β12x1x2+β13x1x3+β23x2x3+β11x12+β22x22+β33x32
(4)
其中Y为预测SSC或花色苷含量,β0为常数项,β1、β2、β3分别为线性系数,β12、β13、β23为交互项系数,β11、β22、β33为二次项系数。
1.3.4.2 MLP-ANN模型 利用Neural Solutions 5.0软件进行多层感知神经网络模型(MLP-ANN)神经网络训练,其中输入层为3,分别是复合酶添加量、超声功率和酶解时间;对目标值SSC和花色苷含量分别建模,输出层均为1,采用Neural Expert板块的Prediction功能,按照神经网络复杂程度,智能推荐确定最佳隐藏层节点数以及单元数、输入层和输出层的传递函数,确定最佳算法以使得整个网络以最少的迭代次数达到误差要求。
1.3.5 数据分析 所有试验数据为3次平行试验测定结果的平均值。使用Design Expert 8.0.6软件进行响应面模型分析。采用Neuro Solutions 5.0软件构建人工神经网络模型。
RSM和MLP-ANN模型预测性能的评价指标为决定系数(R2)、平均相对偏差(AAD)、均方误差(MSE)及均方根误差(RMSE),其表达式分别为[17-19]:
(5)
(6)
(7)
(8)
式中,Ypred,i为模型预测值,Yexp为试验平均值,Yexp,i为试验实测值,n为试验次数(20)。
2 结果与分析
2.1 RSM优化
2.1.1 响应面回归模型的建立与方差分析 利用Design-Expert 8.0.6软件对表2中试验结果进行多元回归拟合,表3为其回归模型系数和方差分析结果。由表3可知,模型方程Y1和Y2的F>F0.05(9,5)=4.77,且P<0.01,说明模型方程Y1和Y2极显著;2个模型方程失拟性检验的失拟项F
表2草莓果浆超声酶解中心组合试验设计及结果
Table2Experimentaldesignandresultsforultrasonicenzymolysisofstrawberrypulp

试验号x1 (%)x2 (W)x3 (min)Y1 (%)Y2 (mg)10.06180209.912.620.04150309.48.730.06210209.710.840.08210109.510.050.04210309.610.860.04210109.29.270.08150109.59.280.061802010.012.590.04150109.16.4100.08180209.711.1110.06150209.59.0120.061802010.011.6130.06180109.711.7140.06180209.912.8150.061803010.213.5160.04180209.49.9170.08210309.813.3180.06180209.911.4190.06180209.910.9200.08150309.611.0
x1、x2、x3分别表示复合酶添加量、超声功率、酶解时间。Y1和Y2分别表示可溶性固形物含量和100 g草莓果浆花色苷含量。
2.1.2 多重响应参数优化 通过回归拟合,试验因子对Y1和Y22个响应值的影响可用回归方程表示:
Y1=9.900+0.140x1+0.070x2+0.180x3-0.012x1x2-0.037x1x3+0.038x2x3-0.330x12-0.280x22+0.170x32
Y2=11.86+0.96x1+0.98x2+1.08x3-0.22x1x2+0.15x1x3+0.10x2x3-1.19x12-1.79x22+0.91x32
进一步利用期望函数法[23-24],得到优化后的超声酶解条件为:复合酶添加量0.06%、超声功率187.9 W、超声时间30 min,此时SSC和花色苷含量的预测值分别为10.4%和每100 g草莓果浆13.92 mg。为方便试验操作,将最优工艺参数调整为复合酶添加量0.06%、超声功率180 W、酶解时间30 min,在此条件下进行3次平行试验,结果表明,SSC和花色苷含量的相对误差分别为1.96%和3.42%,均小于5%,与预测值吻合。
2.2 MLP-ANN神经网络模型的建立与预测
选取表2中前12组数据作为训练集,其余8组数据作为检验集。在模型建立的过程中,最大迭代次数为1 000,网络训练误差随训练次数的增加逐渐降低,SSC和花色苷神经网络训练次数分别增加到477次和487次时,训练误差达到期望误差10-5(图1)。将神经网络训练得到的预测值与中心组合设计试验的实测值进行比较,结果如表4,SSC和花色苷网络模拟训练结果的最大相对误差分别为-0.500%和-0.287%,说明训练效果很好。
表3响应面模型方差分析
Table3Varianceanalysisofresponsesurfaceresults

方差来源自由度Y1平方和均方F值P值Y2平方和均方F值P值Model91.6200.18016.65<0.000 154.9406.10014.360.000 1x110.2000.20018.090.001 79.2209.22021.680.000 9x210.0490.0494.520.059 49.6009.60022.600.000 8x310.3200.32029.910.000 311.66011.66027.440.000 4x1x210.0010.0010.120.741 10.4000.4000.950.352 0x1x310.0110.0111.040.332 20.1800.1800.420.529 9x2x310.0110.0111.040.332 20.0800.0800.190.673 6x1210.3000.30027.950.000 43.9003.9009.180.012 7x2210.2200.22020.160.001 28.8208.82020.750.001 0x3210.0780.0787.180.023 12.2702.2705.350.043 3失拟50.0800.0162.820.139 61.2800.2600.430.812 5残差100.1100.0114.2500.430纯误差50.0280.0062.9700.590总和191.73059.190
x1、x2、x3分别表示复合酶添加量、超声功率、酶解时间。Y1和Y2分别表示可溶性固形物含量和100 g草莓果浆花色苷含量。
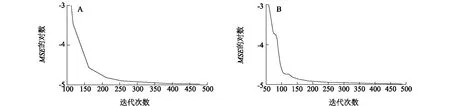
A:可溶性固形物含量(SSC);b:花色苷。图1 神经网络训练过程误差曲线Fig.1 Error curves of neural network training process
表4MLP-ANN神经网络模拟训练结果
Table4Simulation-basedtrainingresultsofMLP-ANN
SSC (%)试验号实测值预测值相对误差 (%)每100 g草莓果浆花色苷含量 (mg)试验号实测值预测值相对误差 (%)19.99.9200.202112.612.598-0.01629.49.4150.16028.78.675-0.28739.79.7110.113310.810.780-0.18549.59.5030.032410.010.0050.05059.69.597-0.031510.810.8070.06569.29.2050.05469.29.2010.01179.59.459-0.43279.29.199-0.011810.09.950-0.500812.512.498-0.01699.19.1050.05596.46.4010.016109.79.7140.1441011.111.099-0.009119.59.497-0.032119.09.0020.0221210.09.980-0.2001211.611.597-0.026
为了进一步验证MLP-ANN神经网络模型的性能,将未参与训练的其余8组数据进行模拟计算,获得预测值与实测值的比较结果(表5)。可以看出,SSC和花色苷神经网络测试的最大相对误差分别为0.441%和-0.037%。采用已建好的MLP-ANN对复合酶添加量、超声功率和酶解时间进行优化,得到超声辅助酶法制备草莓果浆的最佳工艺条件为复合酶添加量0.06%,超声功率186.8 W和酶解时间30 min,在此条件下草莓果浆的预测SSC为10.3%,每100 g草莓果浆花色苷含量为13.47 mg,结合实际操作情况将最佳工艺参数修正为复合酶添加量0.06%,超声功率180 W和酶解时间30 min,此时草莓果浆的实测SSC和每100 g草莓果浆花色苷含量分别为10.02%和13.46 mg,与预测值间相对误差分别为0.89%和0.07%,均小于1.00%,说明采用MLP-ANN神经网络模型对超声辅助酶解草莓果浆品质的预测具有较高的可靠性。
2.3 2种模型的比较
按照公式(5)~(8)计算RSM和MLP-ANN模型评价指标(R2、AAD、MSE和RMSE),评价其对预测超声酶解制备草莓果浆品质的精确度,AAD、MSE和RMSE越低,R2越高,则证明所建立的模型越稳健,拟合性越好;较大的RMSE和AAD的值意味着在预测中出现错误的可能性较高[25]。各指标计算结果见表6,两模型预测值对比如图2所示,可以看出,本研究所建立的RSM模型的决定系数(R2)明显低于MLP-ANN模型,平均相对偏差AAD、均方误差(MSE)及均方根误差(RMSE)也均高于MLP-ANN模型,说明在预测超声辅助制备草莓果浆的品质上,MLP-ANN模型具有更优秀的预测能力。
表5MLP-ANN神经网络测试结果
Table5TestresultsofMLP-ANNnetwork

SSC (%)试验号实测值预测值相对误差 (%)每100 g草莓果浆花色苷含量 (mg)试验号实测值预测值相对误差 (%)139.79.685-0.1551311.711.7010.009149.99.895-0.0511412.812.799-0.0081510.210.2450.4411513.513.495-0.037169.49.4020.021169.99.9020.020179.89.795-0.0511713.313.3010.008189.99.9030.0301811.411.397-0.026199.99.9050.0511910.910.899-0.009209.69.599-0.0102011.011.0030.027

图2 RSM和MLP-ANN模型预测值对比Fig.2 The comparison of values predicted by RSM and MLP-ANN
表6RSM与MLP-ANN模型评价指标比较
Table6ComparisonforevaluationindicesofRSMandMLP-ANN
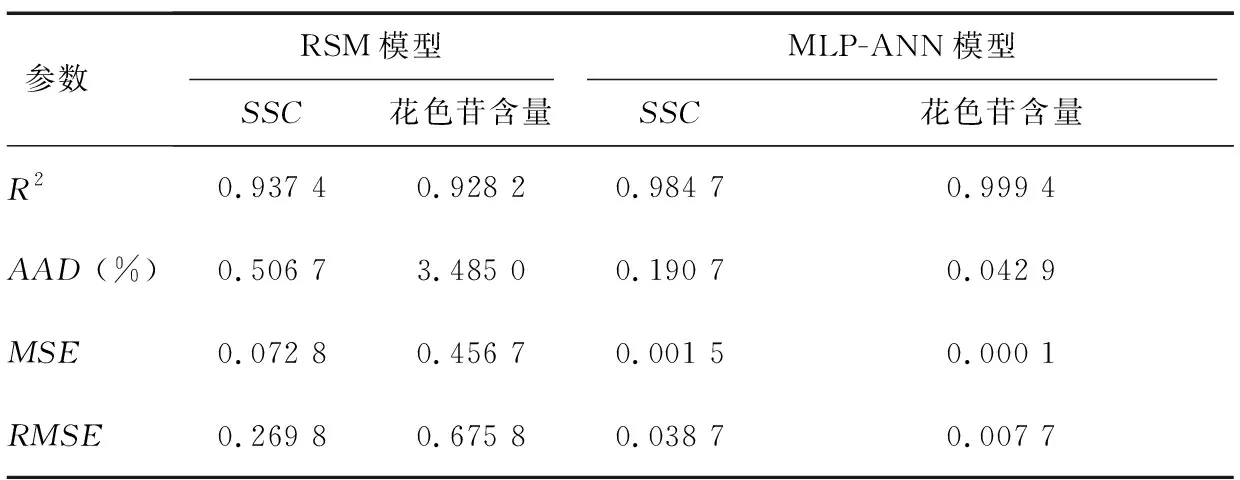
参数 RSM模型SSC花色苷含量MLP-ANN模型SSC花色苷含量R20.937 40.928 20.984 70.999 4AAD (%)0.506 73.485 00.190 70.042 9MSE0.072 80.456 70.001 50.000 1RMSE0.269 80.675 80.038 70.007 7
3 讨 论
本研究通过建立RSM和MLP-ANN 2种模型,研究复合酶添加量、超声功率和酶解时间三因素对草莓果浆SSC和花色苷含量的影响,从而对草莓果浆超声酶解工艺进行优化,该优化是非线性拟合的过程,RSM模型的拟合限于二次多项式方程,表现为对SSC和花色苷含量拟合的决定系数(R2)为0.937 4和0.928 2,而神经网络模型是一种模拟人脑生物处理能力的计算机技术,它可以很好地对极其复杂的和非线性的数据进行建模和仿真[26-27],相比RSM模型具有更广的适用范围,精确度更高,目前已应用于葡萄[28]、猕猴桃[29]、甜菜[30]、番石榴[31]、桔子[32]等果蔬加工和活性成分提取的工艺参数优化。MLP-ANN模型对SSC和花色苷含量拟合的决定系数(R2)分别达到0.984 7和0.999 4,拟合程度较RSM模型好,说明MLP-ANN模型具有更高的预测能力,这与Ighose等[33]、Lin等[34]和董春旺等[35]的研究结果一致,表明RSM模型虽然能够较好地说明各因素对响应值的作用大小,但在数据拟合、预测和建模优化等方面不如人工神经网络模型。
本研究结果得到草莓果浆超声酶解的最佳工艺参数为复合酶添加量0.06%,超声功率180 W和酶解时间30 min,此时草莓果浆SSC和每100 g草莓果浆花色苷含量分别为10.2%和13.46 mg,在前期预试验中得到未经超声酶解处理的草莓果浆酶解液中SSC和每100 g草莓果浆花色苷含量分别为9.1%和5.73 mg,显然,超声辅助酶解处理提高了果浆中SSC和花色苷含量,这可能是由于适宜的超声波条件有利于疏通酶内外扩散的传质通道[36],能够促进酶解过程;此外,果胶酶能将细胞间的果胶质分解为可溶性果胶,从而破坏草莓的胞间质,纤维素酶有效催化细胞壁初生壁和次生壁中的纤维素水解,使得细胞内的可溶性糖类等可溶物质最大限度地溶出[37],果胶酶与纤维素酶的协同效应使得SSC和花色苷含量显著升高。刘璐萍等[38]研究结果表明经超声辅助酶解法处理的马齿苋籽油提取率达86.80%,比传统索氏提取法提高了15.43%。李超等[39]的研究结果也表明超声波协同果胶酶法可以提高草莓出汁率。本研究结果为进一步优化草莓果浆酶解参数和果浆品质预测模型的精确度提供了参考。
在前期单因素试验的基础上,采用RSM和MLP-ANN模型对超声辅助酶解草莓果浆的工艺条件进行优化,对比2种模型的优化结果得到:MLP-ANN模型对SSC和花色苷含量拟合的AAD和RMSE值明显低于RSM模型,R2高于RSM模型,这说明MLP-ANN模型的预测能力要优于RSM模型。最后结合实际操作情况,采用MLP-ANN模型优化超声酶法制备草莓果浆的最佳工艺条件为:复合酶添加量0.06%,超声功率180 W和超声时间30 min,在此条件下,草莓果浆的SSC为10.2%,每100 g草莓果浆的花色苷含量为13.46 mg。与未经过超声酶解的果浆相比,SSC提高了1.12倍,花色苷含量提高了2.35倍,说明超声辅助酶解对草莓果浆品质具有促进作用,从而为在加工过程中有效提高草莓果浆品质提供参考。
