川芎嗪对补体旁路激活致内皮细胞炎症反应的干预作用
2019-01-04孙黔云
李 娇,郭 静,李 敏,孙黔云
(1.贵州医科大学省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550014;2. 贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550014;3.贵州省人民医院干医科,贵州 贵阳 550002)
内皮细胞是位于血管腔内表面的单层扁平上皮细胞,作为血液与组织液代替交换的关键接口,广泛分布于全身大血管和各脏器官的微血管[1]。同时,内皮细胞作为重要的代谢器官和内分泌器官,起着调节血管功能的重要作用,与炎症、心血管疾病、糖尿病等的发生和发展有着密切的关系[2]。这一系列疾病的发生都与内皮细胞的活化和损伤密切相关,在细胞的损伤因素中,补体是一个重要的损伤因素[3]。尤其是被过度激活的补体旁路,会导致内皮细胞活化而产生一系列的炎症反应,使细胞间黏附分子和炎症介质等表达上调,从而导致炎症发生和组织损伤,引起一系列结构的改变和功能的失调[4-5]。川芎嗪(tetramethylpyrazine,TMP)是中药民族药伞形科植物川芎的主要活性成分,在临床治疗上被广泛应用于心脑血管等疾病的治疗[6]。相关研究表明,TMP能够减轻内皮细胞损伤,表现出修复细胞屏障、抗炎、抗氧化等功能[7-8],提示TMP能抑制炎症反应。但还没有研究显示TMP对补体旁路激活致人微血管内皮细胞(human microvascular endothelial cell,HMEC)炎症反应方面是否具有干预作用,目前也尚不清楚TMP在这方面的抗炎作用及其机制。因此,本研究以补体旁路激活诱导内皮细胞发生炎症反应,探讨TMP对补体旁路激活引起HMEC活化的干预作用及其相关的分子作用机制。
1 材料
1.1试剂HMEC细胞株为本课题研究组提供;胎牛血清(fetal bovine serum,FBS)购于杭州四季青生物工程有限公司;RPMI 1640培养基购自美国Gibco公司;NF-κB信号通路质粒、海肾荧光素酶报告质粒和Dual-Luciferase reporter assy system,均为美国普洛麦格公司产品;感受态细胞购自北京康为世纪生物科技有限公司;质粒小量提取试剂盒、Lipo6000TM脂质体转染试剂,购自于江苏碧云天生物技术研究所;TMP标准品购自北京索莱宝科技有限公司,批号为1024A023;眼镜蛇毒因子(cobra venom factor,CVF)由本实验室分离纯化制备和活力单位测定;人细胞间黏附分子1(intracellular adhesion molecule 1,ICAM-1)、血管细胞间黏附分子1(vascular cell adhesion moleucle 1,VCAM-1)、E选择素(E-selectin)、白细胞介素6(interleukin 6,IL-6)、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)ELISA 检测试剂盒,购自武汉博士德生物工程有限公司;正常人血清(normal human serum,NHS)由本实验室制备;灭活人血清(inactivated normal human serum,INHS)是经正常人血清56 ℃水浴灭活0.5 h制备而得。
1.2仪器ESCO CLM-170B-8-NF CO2培养箱(新加坡ESCO公司);NanoDrop 2000C超微量分光光度计(美国Thermo公司);TS2-S-SM倒置显微镜(日本Nikon公司);连续波长酶标仪(美国Molecular Devices公司);DW-HL340超低温冰箱(中国美菱公司);GloMax 96化学发光检测仪(美国Promega公司)。
2 方法
2.1细胞培养HMEC的培养用FBS与RPMI 1640比例为1 ∶10的培养基,于37 ℃、含5% CO2饱和温度培养箱中培养。
2.2补体旁路激活物的制备将正常人血清与浓度为6.5×104U·L-1的CVF进行等体积混合后,于37 ℃水浴30 min制备CVF孵育产物(CVF-activated complement,CAC)[9-10],同时以灭活正常人血清替代正常人血清,按照上述方法制备的孵育产物作为对照。
2.3CAC对HMEC黏附分子表达的影响把对数期生长的HMEC以1.0×104个/孔接种于细胞培养板,总体积100 μL,培养24 h后进行换液处理,即弃上清后用温育的无血清RPMI 1640培养基清洗2次,加入40 μL CAC刺激产物后,再加入该培养基后补齐至100 μL,分别取0、2、6、10、24 h孵育上清,离心后按照ELISA试剂盒说明书测定ICAM-1、VCAM-1和E-selectin含量,复制前期研究模型。
2.4CAC对HMEC表达炎症介质的影响把对数期生长的HMEC以2.0×104个/孔接种于96孔培养板,总体积200 μL,培养24 h后进行换液处理,即弃上清后用温育的无血清RPMI 1640培养基清洗2次,加80 μL CAC孵育产物后,用无血清RPMI 1640培养基补齐至200 μL,分别取0、12、24、48 h细胞培养上清,离心后按照ELISA试剂盒说明书测定IL-6和TNF-α。
2.5TMP对CAC刺激HMEC表达黏附分子的干预作用把对数期生长的HMEC以1.0×104个/孔接种于细胞培养板,总体积100 μL,培养24 h后进行换液处理,即用温育无血清RPMI 1640培养基清洗2次后,加入50 μL该培养基和10 μL用生理盐水稀释的TMP(基于前期筛选,TMP终浓度分别为1.0×10-10、1.0×10-12、1.0×10-14mol·L-1)预处理细胞2 h,再加入40 μL CAC孵育产物,轻轻摇匀后孵育6 h,收集上清培养液,离心后按照ELISA试剂盒说明书测定ICAM-1、VCAM-1和E-selectin,以生理盐水代替TMP,分别设置NHS CVF孵育产物模型组(Model)和INHS CVF孵育产物正常对照组(Control)。
2.6TMP对CAC刺激HMEC表达炎症介质的干预作用把对数期生长的HMEC以2.0×104个/孔接种于96孔培养板,总体积200 μL,培养24 h后进行换液处理,即用温育不含血清RPMI 1640培养基清洗2次后,加入100 μL该培养基和20 μL已稀释的TMP,终浓度同“2.5”,预处理细胞2 h后,加入80 μL CAC孵育产物至200 μL,轻轻摇匀后孵育48 h,收集上清培养液,离心后按照ELISA试剂盒说明书测定IL-6和TNF-α含量,以生理盐水代替TMP,分别设置NHS模型组和INHS正常对照组。
2.7NF-κB核转录活性检测
2.7.1质粒制备 分别将1 ng NF-κB表达质粒和内参重组质粒加入到50 μL感受态细胞DH5α中,混匀后冰浴30 min,再经42 ℃热激90 s,再冰浴2 min,加入950 μL不含氨苄青霉素的LB培养基,置于37 ℃摇床振荡培养1 h,经2 000 r·min-1离心5 min后,弃去上清,用新鲜的LB培养基悬浮菌液后,取适量菌液均匀涂布于平板上(含有氨苄青霉素的LB固体筛选培养基),于37 ℃培养箱过夜培养,挑取单菌落置于含抗生素的LB液体培养基中进行扩大培养,按碧云天质粒小量抽提剂盒说明书,分别提取NF-κB表达质粒和内参重组质粒,并用NanoDrop测定其浓度。
2.7.2双萤光素报告基因检测 将对数期生长的HMEC以1.0×104个/孔接种于96孔不透光细胞培养板,总体积100 μL,培养24 h后使进行转染,转染前,弃上清细胞培养液,用温育无血清RPMI 1640培养基清洗2次后,加入90 μL含血清不含抗生素的RPMI 1640培养基,按脂质体转染试剂说明书进行转染,然后每孔加入转染混合液10 μL,转染16 h后去除上清,各组参照“2.5”进行相应处理,其中TMP终浓度分别为1.0×10-10、1.0×10-12、1.0×10-14mol·L-1,加入CAC孵育产物4 h后进行萤光强度的检测,以生理盐水代替TMP分别设置NHS模型组(Model)和INHS正常对照组(Control)。按照下列公式计算各组相对核转录活性Ra,其中R1为各组的萤火虫萤光素酶测定值,R2为各组海肾萤光素酶的测定值。
2.8统计学分析采用软件SPSS 18.0进行单因素方差分析,组间多重比较采用LSD法。
3 结果
3.1CAC对HMEC表达相关炎症反应分子的影响CAC作用于内皮细胞后导致ICAM- 1、VCAM-1和E-selectin 的表达上调,且在6 h时间点检测到表达高峰,同样,CAC作用于HMEC也导致炎症因子IL-6和TNF-α的表达上调,并在48 h与对照组相比明显上调(P<0.01),与本课题组前期的实验结果相同[10-12]。以上结果显示本实验成功复制CAC孵育产物诱导内皮细胞炎症反应模型。
3.2TMP对HMEC表达ICAM-1的影响Fig 1的结果显示,3个浓度的TMP均可降低ICAM-1的表达,其中1.0×10-10mol·L-1的TMP抑制效果与模型组相比差异具有统计学意义(P<0.01),结果呈现剂量依赖性。

Fig 1 Effect of TMP with different concentrations on ICAM-1expression of HMEC induced by CAC for 6
**P<0.01vscontrol;##P<0.01vsmodel
3.3TMP对HMEC表达VCAM-1的影响Fig 2结果表明,3个浓度的TMP预处理HMEC后,都能明显降低VCAM-1的表达,与模型组相比差异有统计学意义(P<0.05或P<0.01),表现出明显的量效关系。

Fig 2 Effect of TMP with different concentrations on VCAM-1expression of HMEC induced by CAC for 6
**P<0.01vscontrol;#P<0.05,##P<0.01vsmodel
3.4TMP对HMEC表达E-selectin的影响如Fig 3所示,CAC导致HMEC表达E-selectin增加,而TMP能明显抑制E-selectin的表达,其中1.0×10-10、1.0×10-12mol·L-1干预组与模型组相比,差异具有统计学意义(P<0.01)。

Fig 3 Effect of TMP with different concentrations on E-selectinexpression of HMEC induced by CAC for 6
**P<0.01vscontrol;##P<0.01vsmodel
3.5TMP对HMEC表达IL-6的影响Fig 4结果表明,HMEC经TMP预处理后,其IL-6的表达明显下调,其中,TMP(1.0×10-10、1.0×10-12mol·L-1)组与模型组相比差异均有统计学意义(P<0.01)。
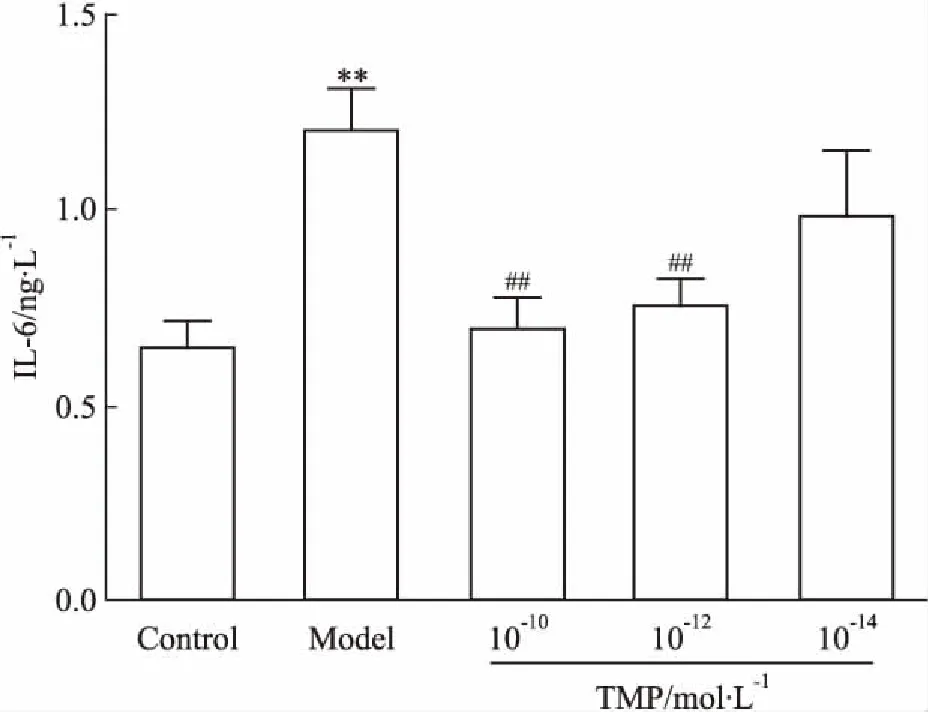
Fig 4 Effect of TMP with different concentrations on IL-6expression of HMEC induced by CAC for 48
**P<0.01vscontrol;##P<0.01vsmodel
3.6TMP对HMEC表达TNF-α的影响如Fig 5所示,TMP能下调HMEC中TNF-α水平, 其中,1.0×10-10mol·L-1组与模型组相比差异有统计学意义(P<0.05)。

Fig 5 Effect of TMP with different concentrations on TNF-αexpression of HMEC induced by CAC for 48
**P<0.01vscontrol;#P<0.05vsmodel
3.7TMP对补体旁路激活致NF-κB转录活性的影响如Fig 6所示,CAC刺激HMEC后,NF-κB的核转录活性明显上调,而TMP对CAC所导致的NF-κB核内转录活性的增强有干预作用,其中,TMP(1.0×10-10、1.0×10-12mol·L-1)组与模型组相比差异均有统计学意义(P<0.01)。
4 讨论
补体旁路的激活在机体天然防御系统中扮演着重要的角色,而在许多病理的机体中,该途径的过度激活会导致机体炎症反应和损伤,其中补体旁路激活诱导可致内皮细胞炎症反应,引起细胞形态改变、功能失调,引起细胞损伤,从而导致细胞内相关指标的表达发生改变。眼镜蛇毒因子CVF是一种来源于眼镜蛇毒的高度特异的补体旁路激活蛋白,其在血清中可与B因子形成具有C3/C5转化酶活性的CVFBb,从而激活补体旁路途径,产生大量C3a、C5a及攻膜复合物(membrane attack complex,MAC)[13]。补体旁路激活产物刺激内皮细胞后,会引起JAK2、NF-κB等炎症相关通路活化,该激活方式与机体病理生理条件下的补体旁路途径的过度激活高度一致,能反映体内补体激活的真实状况[9-10],可作为一个特异的补体研究工具,用于模拟机体在病理状态下补体旁路途径的过度激活状态。TMP作为贵州民族药大品种川芎中提取的一种酰胺类生物碱,具有抑制机体过度炎症反应,改善微循环、抗凝血、抗氧化等多种药理活性[14]。近年来一些研究报道[15-16],TMP对脂多糖和氧化低密度脂蛋白诱导的内皮细胞损伤具有保护作用,但对于补体旁路激活导致的内皮细胞损伤和炎症反应的保护研究均较少涉及。因此,本文采用CVF来激活补体旁路,探索了TMP对补体旁路激活诱导的HMEC炎症反应的保护作用,以深入挖掘TMP的药理药效。

Fig 6 Effect of TMP with different concentrations on transcriptionalactivity of NF-κB after exposure of HMEC to
**P<0.01vscontrol;##P<0.01vsmodel
前期研究结果表明,加入CVF孵育产物刺激内皮细胞后,内皮细胞被激活,相关的信号通路活化,首先表现为NF-κB信号通路的活化,核内转录活性上调,然后蛋白分子表达的变化,最后产生后续系列的炎症反应[14]。在本研究中,内皮细胞受到CAC 刺激后会引起ICAM- 1、VCAM-1、E-selectin、IL- 6和TNF-α的表达上调。其中前三者在6 h时达到峰值,IL-6和TNF-α的表达上调在48 h检测点明显高于对照。ICAM-1作为介导中性粒细胞和内皮细胞黏附的黏附分子,在促进炎症部位的黏连性中起着十分重要的作用;VCAM-1也是一种重要的黏附分子,在活化的内皮细胞中高度表达;E-selectin也是一种重要的黏附分子,在炎症的发生、发展中起着重要作用;而IL- 6和TNF-α则是重要的炎症介质。NF-κB信号通路在维持机体正常生理功能中起着很重要的作用,该通路的活化会介导炎症反应。有研究表明,抑制NF-κB信号通路能够取得较明显的内皮细胞保护作用[15]。NF- κB作为细胞内核转录因子,起着调控上述分子靶基因转录的作用,与细胞炎症反应生理和病理过程密切相关。这些黏附分子、炎症介质和NF- κB核转录因子在炎症的发生、发展中扮演了重要角色。其表达的上调提示CAC孵育产物刺激HMEC后,可直接导致基于微血管内皮细胞活化应答的炎症发生。
基于上述结果,检测到TMP能够抑制核转录活性的上调,抑制相关黏附分子和炎症介质的表达,结合目前已有的对炎症相关信号通路的结果,认为其作用机制是与抑制核转录活性有关,至于具体作用的靶点还需要进一步的确认。文献报道,TMP在干预氧化低密度脂蛋白对内皮细胞的损伤模型中,也提示其作用机制与抑制NF-κB信号通路的活化有关[15]。基于TMP抑制了核内转录活性,提示TMP抑制NF-κB信号通路的活化,从而下调与炎症相关的细胞因子的转录调控表达,进一步抑制或减轻炎症反应,表明TMP对补体旁路激活导致的HMEC炎症反应具有一定的干预作用。
本研究结果表明,TMP对补体旁路激活致内皮细胞黏附分子、炎症介质和NF-κB核内转录活性表达上调均有不同水平的抑制作用,其中核内转录活性的变化揭示其作用机制可能与NF-κB信号通路的活化有关。该工作有助于进一步阐明内皮细胞炎症反应相关信号通路调控机制和潜在的作用靶点,为深入挖掘TMP的开发应用价值提供参考依据和线索,同时,也为进一步开展贵州民族药大品种中天然活性分子保护内皮细胞损伤的机制研究提供新思路和新方法。
(致谢:本文实验是在贵州省中国科学院天然产物化学重点实验室药理与活性筛选中心孙黔云研究员课题组的实验室完成。)
