重组人B型利钠肽抑制氧化低密度脂蛋白诱导的巨噬细胞氧化应激及炎症反应
2019-01-03孟利民杨华信栓力刘吉祥赵秀峰刘丽军杨瑞波常超
孟利民 杨华 信栓力 刘吉祥 赵秀峰 刘丽军 杨瑞波 常超
056002 邯郸市第一医院心内一科
氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)和单核/巨噬细胞是动脉粥样硬化发生发展过程中的关键性因素,对泡沫细胞形成、炎症反应、巨噬细胞凋亡、易损斑块的破裂、坏死核心和继发血栓的形成起重要作用,成为动脉粥样硬化疾病治疗作用靶点[1-3]。本课题组前期研究表明,重组人B型利钠肽(recombinant human brain natriuretic peptide,rhBNP)可抑制ox-LDL诱导的THP-1源巨噬细胞凋亡[4],但具体机制不明;研究发现,白细胞介素37(interleukin-37,IL-37)作为抗炎细胞因子,参与动脉粥样硬化的发生发展[5]。因此,本研究重点探讨rhBNP对ox-LDL诱导的THP-1源巨噬细胞氧化应激和IL-37水平的影响,旨在为临床寻找及应用抑制动脉粥样硬化的药物提供新思路。
1 材料与方法
1.1 材料与试剂
人单核细胞系THP-1源细胞购自武汉大学;rhBNP(商品名:新活素,批号:20161228)购自成都诺迪康生物制药有限公司。主要试剂:RPMI-1640培养基(美国GIBCO公司);链霉素/青霉素、胎牛血清(FBS)(美国GIBCO公司);ox-LDL试剂(广州亦源生物科技有限公司);H2DCF-DA荧光探针(美国Sigma公司);超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malonaldehyde,MDA)试剂(南京建成生物工程研究所);IL-37的ELISA双抗体试剂(上海西唐生物科技有限公司)。
1.2 研究方法
1.2.1 THP-1源巨噬细胞的培养及分组 本课题组前期研究结果[4]:人单核细胞系THP-1细胞用100 mmol/L的佛波酯孵育24~48 h,使其诱导分化为巨噬细胞;与50和75 μg/ml ox-LDL相比,100 μg/ml ox-LDL诱导巨噬细胞24 h的凋亡率显著升高,故选100 μg/ml作为ox-LDL处理THP-1源巨噬细胞的浓度;将不同浓度的rhBNP(10-7、10-8、10-9和10-10mol/L)和100 μg/ml ox-LDL分别干预THP-1源巨噬细胞24 h,结果显示,10-9mol/L rhBNP的抑制凋亡作用最为显著,故选10-9mol/L作为rhBNP干预ox-LDL诱导的THP-1源巨噬细胞的浓度。
实验分为3组:(1)对照组:不进行任何干预,THP-1源巨噬细胞置1640培养基中于5%CO2、37℃、饱和湿度培养箱中孵育24 h;(2)100 μg/ml ox-LDL组:在实验细胞中加入100 μg/ml ox-LDL共同孵育24 h;(3)100 μg/ml ox-LDL+10-9mol/L rhBNP组:10-9mol/L rhBNP和100 μg/ml ox-LDL共同孵育24 h。
1.2.2 共聚焦显微镜检测活性氧(reactive oxygenspecies,ROS)的含量 2′,7′-Dichloroflu-orescein diacetate(H2DCF-DA)是一种专门检测细胞内ROS的细胞渗透荧光染料。H2DCF的荧光强度与细胞产生的ROS含量成正比。给予THP-1源巨噬细胞分组干预后,PBS洗涤2遍,加入终浓度为10 μM的H2DCF-DA探针,37 ℃避光30 min,去除上清液,用PBS缓冲液漂洗2遍后重悬于1 ml PBS中,之后立即用共聚焦显微镜检测细胞平均荧光密度(MFI),激发光波长为488 nm,发射光波长为525 nm,MFI值可反映细胞内ROS变化。采用Image-Pro Plus 6.0软件进行分析。
1.2.3 逆转录聚合酶链反应法(RT-PCR)检测SOD、MDA的基因表达 采用ABI 7300系统行基因分析。从细胞提取RNA用于cDNA逆转录,参照TaKaRa说明书行RT-PCR。PCR引物设计用primer 3.0软件,并经GenBank校对,核实,引物序列见表1。反应体系:SYBR 5 μL,Forward Primer 0.2 μL,Reverse Primer 0.2 μL,template 1 μL,dH2O 3.6 μL,SYBR Premix Ex Taq。反应条件:(1)95℃ 30 s;(2)循环40次:95℃ 5 s, 60℃ 30 s;(3)Melt Curve 95℃ 0 s,65℃ 15 s,95℃ 0 s,每样品3复孔,保证实验数据的有效性。PCR结束后,以GAPDH为内参照,计算2-ΔΔt。

表1 RT-PCR引物序列和反应参数
1.2.4 比色方法检测SOD活性及MDA含量 收集培养细胞的上清液,储存在-70℃;采用黄嘌呤氧化酶法测定SOD活性,硫代巴比妥法测定MDA含量,严格按照试剂盒说明书操作。使用分光光度计检测550 nm和532 nm的吸光度。
1.2.5 ELISA检测细胞上清IL-37水平 取细胞培养液,3 000 r/min离心15 min,取上清液置-70℃冰箱保存、待测,待标本全部收集完毕后1次测定。采用ELISA的双抗体夹心法检测细胞上清的IL-37水平。
1.3 统计学方法

2 结果
2.1 rhBNP抑制了ox-LDL诱导的ROS水平的增加
与对照组比较,100 μg/ml ox-LDL干预THP-1源巨噬细胞24 h明显升高ROS水平(527.30%±36.20% 比100.00%±0.00%,P<0.05);与100 μg/ml ox-LDL组相比,100 μg/ml ox-LDL+10-9mol/L rhBNP明显降低ROS水平(237.30%±30.62% 比527.30%±36.20%,P<0.05),见图1。
2.2 rhBNP抑制了ox-LDL诱导的SOD mRNA的表达和活性降低
与对照组比较,100 μg/ml ox-LDL干预THP-1源巨噬细胞24 h明显降低SOD mRNA的表达和活性[0.53±0.18 比1.00±0.00,(256.60±8.20)U/ml比 (355.80±9.58)U/ml;均为P<0.05];与100 μg/ml ox-LDL组相比,100 μg/ml ox-LDL+10-9mol/L rhBNP明显升高SOD mRNA的表达和活性[0.90±0.07 比0.53±0.18,(310.40±2.97)U/ml比 (256.60±8.20)U/ml;均为P<0.05]。
2.3 rhBNP抑制了ox-LDL诱导的MDA mRNA的表达和含量增加
与对照组比较,100 μg/ml ox-LDL干预THP-1源巨噬细胞24 h明显升高MDA mRNA的表达和含量[1.59±0.23 比 1.00±0.00,(29.40±1.68)nmol/ml 比(5.94±0.51)nmol/ml;均为P<0.05];与100 μg/ml ox-LDL组比较,100 μg/ml ox-LDL+10-9mol/L rhBNP明显降低MDA mRNA的表达和含量[1.14±0.10 比 1.59±0.23,(20.54±1.55)nmol/ml比(29.40±1.68)nmol/ml;均为P<0.05]。
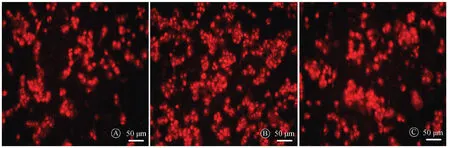
A:对照组;B:100 μg/ml ox-LDL组;C:100 μg/ml ox-LDL+10-9mol/L rhBNP组;激光共聚焦显微镜下细胞内的ROS呈红色荧光图1 rhBNP抑制了ox-LDL诱导的ROS水平的增加(共聚焦显微镜,×200,n=3)
2.4 rhBNP抑制了ox-LDL诱导的IL-37水平的降低
与对照组比较,100 μg/ml ox-LDL干预THP-1源巨噬细胞24 h明显降低IL-37水平[(48.05±3.01)ng/L 比(57.82±2.26)ng/L,P<0.05];与100 μg/ml ox-LDL组比较,100 μg/ml ox-LDL+10-9mol/L rhBNP明显升高IL-37水平[(53.06±1.87)ng/L 比(48.05±3.01)ng/L,P<0.05]。
3 讨论
氧化应激和炎症反应贯穿了动脉粥样硬化的始终。ox-LDL可引起内皮损伤和功能障碍,是致动脉粥样硬化的关键因素[6],可通过参与巨噬细胞源性泡沫细胞的形成、促进细胞粘附、刺激巨噬细胞增生和分化、促进血小板粘附、聚集血栓形成、损伤内皮细胞的机制参与动脉粥样硬化的发生发展[7-8]。病变晚期,单核/巨噬细胞亦可通过促进炎症、凋亡、脂质沉积和斑块破裂,形成易损斑块的坏死核心,继而诱发血栓形成导致血管堵塞,诱发急性冠脉综合征的发生[9-10]。因此,ox-LDL及单核/巨噬细胞始终是动脉粥样硬化发生发展的重要环节和关键步骤,是动脉粥样硬化疾病治疗作用靶点。
rhBNP不仅可有效改善急性失代偿性心力衰竭患者的症状和血流动力学[11],还具有抗炎作用[12],然而,rhBNP对动脉粥样硬化的作用研究不多见。本课题组前期研究发现,ox-LDL可诱导巨噬细胞凋亡,及rhBNP可能通过抑制线粒体膜电位的减少,从而抑制巨噬细胞凋亡,初步提示rhBNP具有抗动脉粥样硬化作用,但其具体机制仍未明确[13]。
在动脉粥样硬化病变过程中,氧化应激可激发产生大量ROS,通过各种机制启动血管周围炎症,并减少相关的抗氧化酶水平,损伤组织和细胞,加速细胞凋亡和促进动脉粥样硬化的发展[14-15]。为了减轻ROS的不良作用,体内产生了相关的抗氧化酶,比如SOD,为ROS清除酶家族成员之一,通过促进超氧阴离子的消除来抵抗ROS对机体的损伤[16]。此外,MDA为脂质过氧化的最终产物,可作为氧化应激对组织损伤的标志[17]。本研究发现,rhBNP 可减轻ox-LDL诱导的氧化应激状态,ox-LDL可加重巨噬细胞氧化应激,即增加细胞内ROS的形成和MDA的含量,但rhBNP明显减轻了ox-LDL诱导的氧化应激反应,即减少了ROS的产生和MDA的含量,增加SOD的活性。另外,研究表明,与对照组相比,ox-LDL组SOD mRNA表达明显降低,MDA mRNA表达增加,而经过rhBNP共同处理,SOD mRNA表达增加,MDA mRNA表达减少。本文从基因水平上证实了,ox-LDL可通过降低SOD mRNA水平和增加MDA mRNA水平诱导细胞凋亡,且rhBNP可改善这些变化。同时结果表明,抗氧化酶SOD表达的增加伴随着MDA水平的减少。本次实验进一步证实了rhBNP具有抗氧化应激作用,但具体信号通路仍需进一步研究。
动脉粥样硬化是一种免疫介导的慢性炎症反应性疾病[18]。研究表明,单核/巨噬细胞聚集可释放炎症因子,进而损伤内皮细胞,导致炎症细胞聚集,参与动脉粥样硬化的发生[19]。IL-37作为抗炎细胞因子,参与动脉粥样硬化的发生发展[5]。ox-LDL是否影响巨噬细胞IL-37的分泌尚未见相关报道,而本研究发现,与对照组相比,ox-LDL组IL-37水平下降,提示ox-LDL抑制了巨噬细胞抗炎因子的生成;但经rhBNP干预后,IL-37水平升高,提示rhBNP可能抑制ox-LDL诱导的IL-37减少,协调抗炎/促炎因子失衡,抑制炎性反应。
综上所述,ox-LDL可能通过增加ROS的产生、降低SOD的活性、增加MDA的含量、下调SOD mRNA的表达、上调MDA mRNA表达及降低IL-37水平,对巨噬细胞产生影响,且rhBNP可逆转这些作用。本研究仅在细胞水平上探讨rhBNP的作用,但具体通过何种途径发挥作用,有待今后进一步的研究和探索。
利益冲突:无
