果壳生物质热解特性与动力学
2019-01-02范方宇黄元波杨晓琴郑云武郑志锋
范方宇, 黄元波, 杨晓琴, 郑云武, 刘 灿,王 珍, 郑志锋*
(1. 西南林业大学 轻工与食品工程学院, 云南 昆明 650224; 2. 云南省生物质高效利用工程实验室;云南省高校生物质化学炼制与合成重点实验室, 云南 昆明 650224; 3. 西南林业大学 材料科学与工程学院, 云南 昆明 650224; 4. 西南林业大学 西南山地森林资源保育与利用教育部重点实验室, 云南 昆明 650224)
随着澳洲坚果[1]、油茶[2]和核桃[3]等林产食品在我国的迅速发展,林产食品加工产生的果壳废弃物综合利用成为食品行业不可回避的问题。传统果壳废弃物主要以堆积丢弃、焚烧为主,不仅造成大量的能源浪费,还引起了严重的环境污染。果壳废弃物综合利用可降低环境污染、节约化石能源、缓解能源危机、促进经济林产业的发展[4]。传统果壳废弃物利用研究很多,既有活性物质的提取[5]、以果壳为原料制备活性炭[6-7],也有以果壳生物质、生物炭为原料进行燃烧[1]等方面的研究。油茶、核桃和澳洲坚果等果壳生物质主要成分为纤维素、半纤维素和木质素,具有巨大的能源开发潜力。热解是生物质综合利用的重要方法之一,也是获取可再生能源的重要方法。目前常见热解原料以农林生物质为主,忽视了农林食品加工中废弃物的综合利用[8],研究油茶、核桃和澳洲坚果的果壳生物质热解特性对果壳生物质的综合利用具有重要意义。近年来,以果壳生物质为原料,采用热解法制备固、液、气三相产物研究逐渐增多。有研究者对油茶壳[9]、核桃壳[10]的热解特性进行了一定的研究,但对澳洲坚果壳的热解特性研究未见相关报道;同时,由于果壳生物质组成不同,采用同一种动力学方法对比分析不同果壳生物质的热解特性与动力学,也未见相关报道。本研究利用TG-DTG联用技术研究油茶、核桃、澳洲坚果3种果壳废弃物的热解特性,并采用分布活化能(DAEM)研究了其热解动力学,分析其区别,以期为果壳生物质的热解利用提供基础理论依据。
1 材料和方法
1.1材料
油茶壳为云南腾冲油茶去籽果壳;核桃、澳洲坚果为云南昆明农贸市场采购,去果肉果壳。原料收集后以去离子水清洗3次,去其表面及内部残渣,105 ℃条件下干燥24 h。干燥后于粉碎机中粉碎60 s,过筛,收集尺寸小于0.074 mm样品,用封口袋密封保存,置于干燥器内备用。
1.2测试方法
采用MAC-3000型全自动工业分析仪(姜堰市国创分析仪器有限公司),参考GB 212—2001标准分析样品的灰分、挥发分、固定碳含量;采用Vario EL/micro cube元素分析仪(德国Elementar公司)测碳、氢、氮、硫元素的量,氧元素的量采用差减法计算。3种样品工业分析和元素分析结果见表1。

表1 果壳生物质工业分析及元素分析(干燥无灰基)
热解实验采用德国耐驰(NETZSCH)公司产STA409热重分析仪。以氮气为载气,气体流量60 mL/min。升温速率为10、 20、 40、 60 ℃/min,由室温开始升温,终止温度为900 ℃。
1.3热解动力学参数计算
分布活化能模型(DAEM)在1943年被首次提出,是基于无限平行反应和活化能分布两点假设,被广泛应用于分析一些复杂的化学反应体系的模型,常用于生物质燃烧和热解过程的动力学分析,是已被证明的一种切实可靠的方法[11-12]。生物质热解过程中,该模型认为反应为无限独立平行一级反应,每一个反应均有独立活化能,且活化能连续分布[13-14],分布活化能模型如式(1)所示:
(1)
式中:E—活化能,kJ/mol;R—气体常数,8.314 J/(mol·K);T—绝对温度,K;V—t时刻反应物析出挥发分质量,g;V*—反应总挥发分质量,g。
f(E)为活化能分布函数,满足式(2):

(2)
将升温速率β=dT/dt带入式(1),得式(3):
(3)
式中:k0—频率因子,min-1;β—升温速率,K/min。
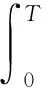
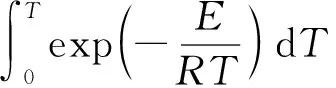
(4)
基于以上假设及模型,热解过程DAEM可表达为式(5):
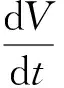
(5)
式(5)为热解反应速率表达式,ΔV*活化能在[E,E+ΔE]区间,ΔV为任一时刻由ΔV*中逸出的挥发分质量。程序升温,温度呈线性升高,其增加速率为β=dT/dt。对式(5)两端同除以ΔV,整理积分得式(6):
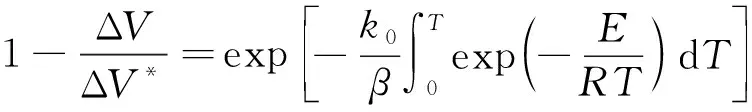
(6)
本研究采用Miura-Maki[15]积分法对DAEM模型进行简化处理,得式(7):
(7)
由式(7)可做ln(β/T2)与1/T的曲线,根据曲线拟合计算斜率与截距,求活化能E。
2 结果与讨论
2.1果壳热解特性
图1为升温速率20 ℃/min时3种果壳生物质热解的TG和DTG曲线。从TG曲线可见,3种果壳生物质热解过程类似,油茶壳热解过程区别于澳洲坚果壳和核桃壳,其热解起始温度低,相同升温速度下热解达到最大失重速率时的温度低。在室温至150 ℃之间,DTG曲线上可见微小失重峰,此时为水分蒸发阶段,但因样品经过干燥处理,其失重特点不明显;油茶壳在130~170 ℃,澳洲坚果壳、核桃壳在130~180 ℃主要为生物质中木质素发生玻璃化转变,DTG曲线较为平稳;当温度继续升高,直至450 ℃时,是生物质的主热解阶段,此时纤维素、半纤维素、木质素都发生裂解,挥发分被氮气带走,在TG曲线上表现为迅速下降。在此阶段,随着温度的升高,失重速度逐渐变大。澳洲坚果壳、油茶壳和核桃壳分别在351、 296、 347 ℃时,达最大失重速率,分别为15.85、 8.32、 14.95%/min,此阶段主要为半纤维素、纤维素的热解;对于木质素,由于其热解温度范围在180~500 ℃之间,因此整个热解过程中木质素均在热解;当温度继续升高时,部分未热解木质素继续热解,但因含量少,此时曲线失重速率趋于零,热解过程趋于稳定,为炭化阶段。
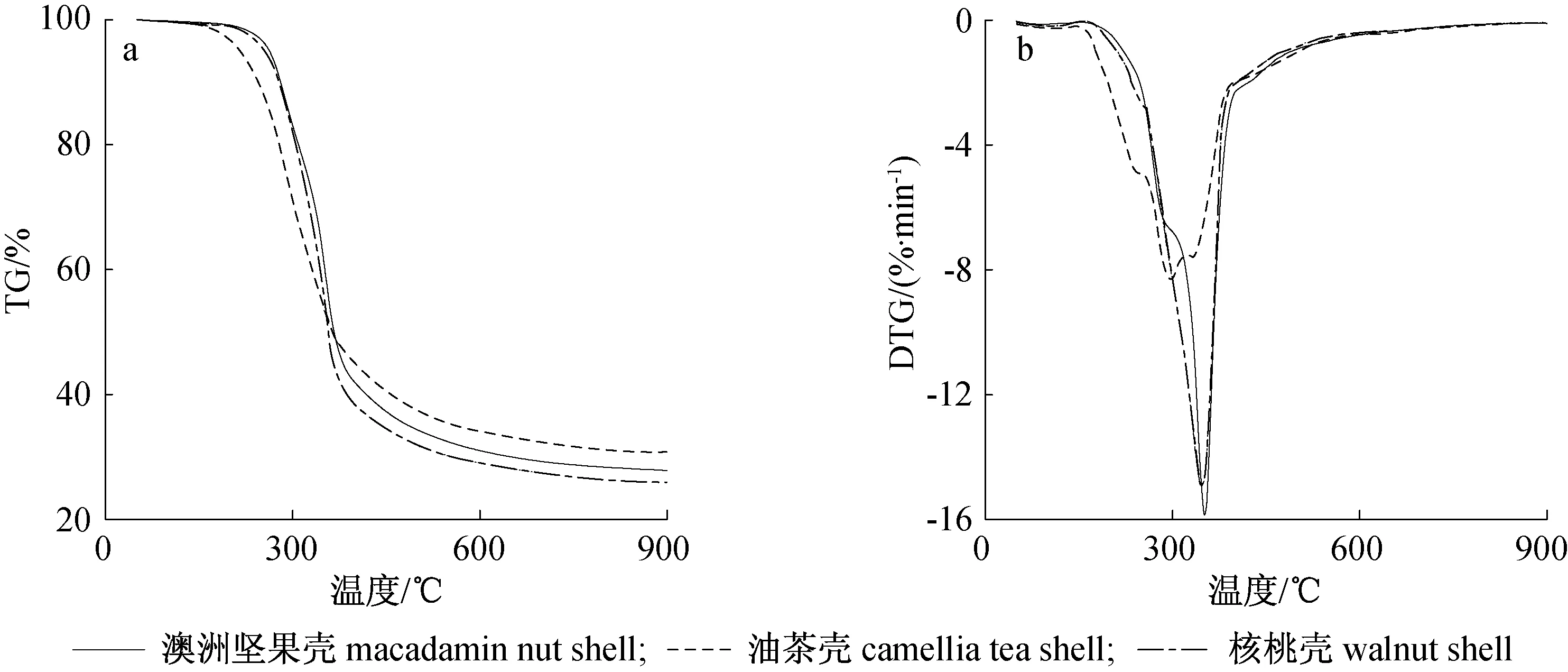
图1 果壳生物质热解TG(a)和DTG(b)曲线Fig. 1 TG(a) and DTG(b) curves of shells biomass pyrolysis
表2为3种果壳生物质热解特征参数。其中热解起始温度定义为热解过程中挥发分挥发率为0.02时的温度,结束温度定义为可挥发分挥发率为0.98时的温度。从表2可见,油茶壳热解起始温度低于澳洲坚果壳和核桃壳,这主要是由于油茶壳中含有较多的可溶性物质,如萜烯类等小分子物质,这些成分在较低的温度下就能挥发、热解[16]。同时,由于油茶壳挥发分含量低于澳洲坚果壳、核桃壳,且挥发过程跨度大,因此其最大失重速率小于澳洲坚果壳、核桃壳,仅为核桃壳、澳洲坚果壳最大失重速率的50%左右。澳洲坚果壳、核桃壳的热解特征参数仅有微小区别,原因为二者的元素分析、工业分析值差别不大。从表2还可看出,澳洲坚果壳的热解特征值,包括起始温度、结束温度、最大失重速率温度均略微大于核桃壳,最大失重速率、残留质量均比核桃壳大,这可能是由于二者的组分有微小区别。
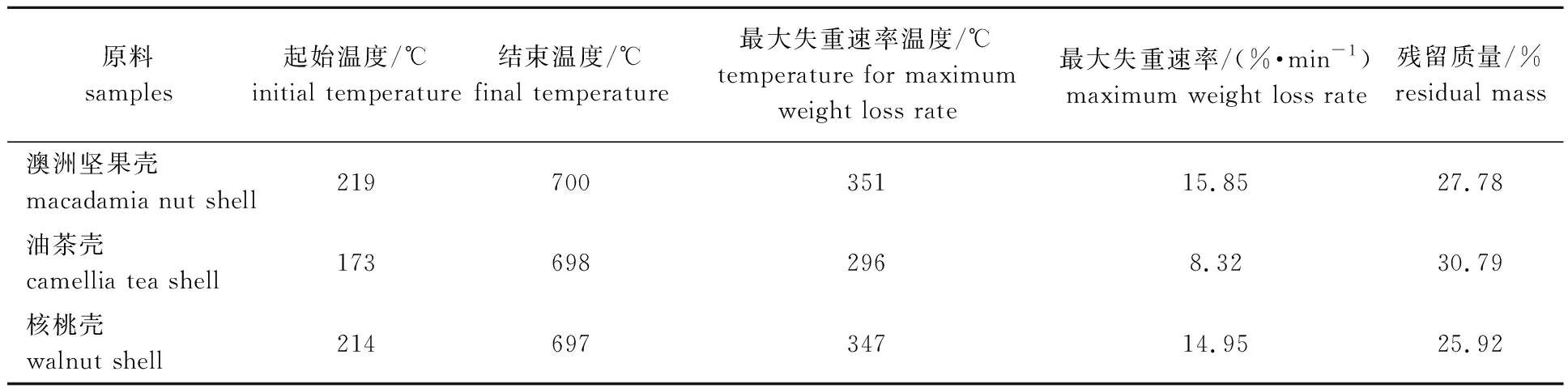
表2 3种果壳生物质热解特征参数
2.2不同升温速率热重分析
图2~4为不同升温速率时,澳洲坚果壳、油茶壳和核桃壳的TG和DTG曲线。由图可见,升温速率不同时,3种果壳生物质的TG、DTG曲线形状基本相同。随着升温速率的增加,热解过程整体向高温区移动,热解反应滞后,热解起始温度提高,且升温速率越大,热解速度越快,其最大失重速率越大。这主要是由于过快的升温速率不利于样品内外部能量及热解产物的传递,从而提高了热解起始温度;同时较快的升温速率使样品更快达到热解温度,挥发分在短时间内析出,因此失重速率变大[1]。
就澳洲坚果壳而言,10 ℃/min升温速率时,最大失重速率为9.85%/min;60 ℃/min升温速率时,最大失重速率为67.52%/min,提高了5.85倍。热解起始温度从206 ℃增加到216 ℃。
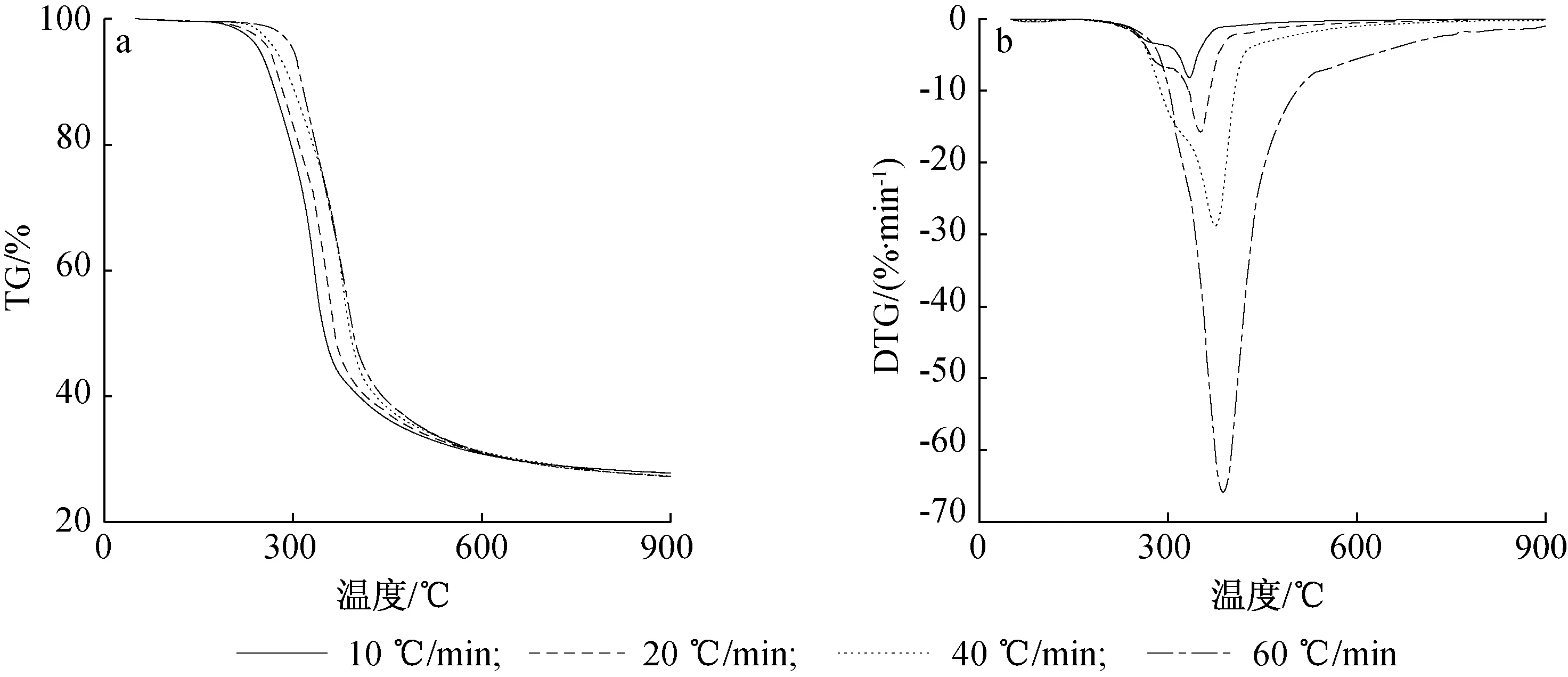
图2 澳洲坚果壳不同升温速率热解TG(a)和DTG(b)曲线Fig. 2 TG(a) and DTG(b) curves of macadamia nut shell pyrolysis at different heating rates
就油茶壳而言,10 ℃/min升温速率时,最大失重速率为4.98%/min;60 ℃/min升温速率时,最大失重速率为22.41%/min,提高了3.5倍。热解起始温度从164 ℃增加到197 ℃。
就核桃壳而言,10 ℃/min升温速率时,最大失重速率为7.25%/min;60 ℃/min升温速率时,最大失重速率为38.5%/min,提高了4.3倍。热解起始温度从194 ℃增加到222 ℃。
3种果壳生物质的热解结束温度随升温速率提高而增大,增大幅度均仅约10 ℃,说明升温速率对热解的结束温度影响小。从DTG图可见,当可挥发分析出达98%的结束温度时,生物质仍然继续热解,升温速率越快,其热解结束温度越高,这主要是由于较快的升温速率提高了热解颗粒内外温差,内部组分未完全热解,从而使剩余的2%的可挥发分物质析出时间延长,热解结束温度增大。
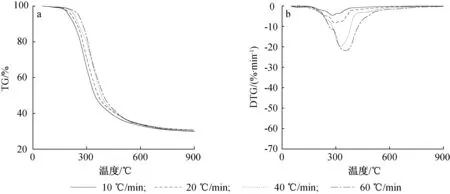
图3 油茶壳不同升温速率热解TG(a)和DTG(b)曲线Fig. 3 TG(a) and DTG(b) curves of camellia tea shell pyrolysis at different heating rates
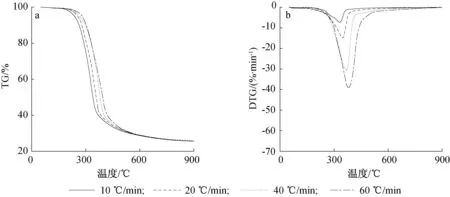
图4 核桃壳不同升温速率热解TG(a)和DTG(b)曲线Fig. 4 TG(a) and DTG(b) curves of walnut shell pyrolysis at different heating rates
2.3DAEM热解动力学分析
图5为3种果壳生物质DAEM热解动力学中ln(β/T2)与1/T作图所得的Arrhenius图。根据公式,由直线的斜率和截距计算出活化能(E)。表3列出了3种果壳生物质在不同转化率下的活化能(E)及相关系数(R2)。从表3可见,通过式(7)计算的R2在0.914~0.999之间,说明拟合度高,此模型适用于3种果壳生物质的热解动力学研究。

图5 澳洲坚果壳(a)、油茶壳(b)、核桃壳(c)不同转化率下ln(β/T2)-1/T 图Fig. 5 ln(β/T2) vs 1/T of macadamia nut shell(a), camellia tea shell(b) and walnut shell(c) at different conversion rate
由表3可见,澳洲坚果壳热解活化能83.91~211.86 kJ/mol,油茶壳热解活化能68.64~244.49 kJ/mol,核桃壳热解活化能98.69~267.75 kJ/mol,3种果壳生物质活化能在每一个转化阶段,其活化能变化幅度不同。在低转化率时3种果壳生物质热解过程的活化能均随转化率的增加而增大;当转化率增大到一定程度后(澳洲坚果壳0.4,油茶壳0.55,核桃壳0.35),活化能开始小幅降低;当澳洲坚果壳、油茶壳和核桃壳的转化率分别为0.65、 0.65和0.70时,活化能开始明显增加。呈现此现象的原因主要是热解初始阶段,半纤维素、纤维素为样品的主要成分,其活性强、热解活化能较低;当转化率较高时,主要为木质素的热解反应,焦炭是主要热解产物,其所需活化能高。此外,热解过程中气相产物穿过固体炭的空隙逸出,受固体产物结构的影响,阻力增大,使E值增大,反应缓慢[17]。这主要是由于3种生物质中的可溶性物质、纤维素、半纤维素、木质素以及灰分的量不同引起的。可溶性物质在热解时热解温度最低,其次是半纤维素、纤维素,而木质素在生物质热解的整个过程中都在热解,但热解速率慢[18-19]。表3中可见,低转化率时油茶壳活化能最低,主要是由于其所含可溶性物质[16]的量最高;高转化率时,核桃壳活化能最高,这可能是由于核桃壳中的木质素含量最高,从而使活化能最大。
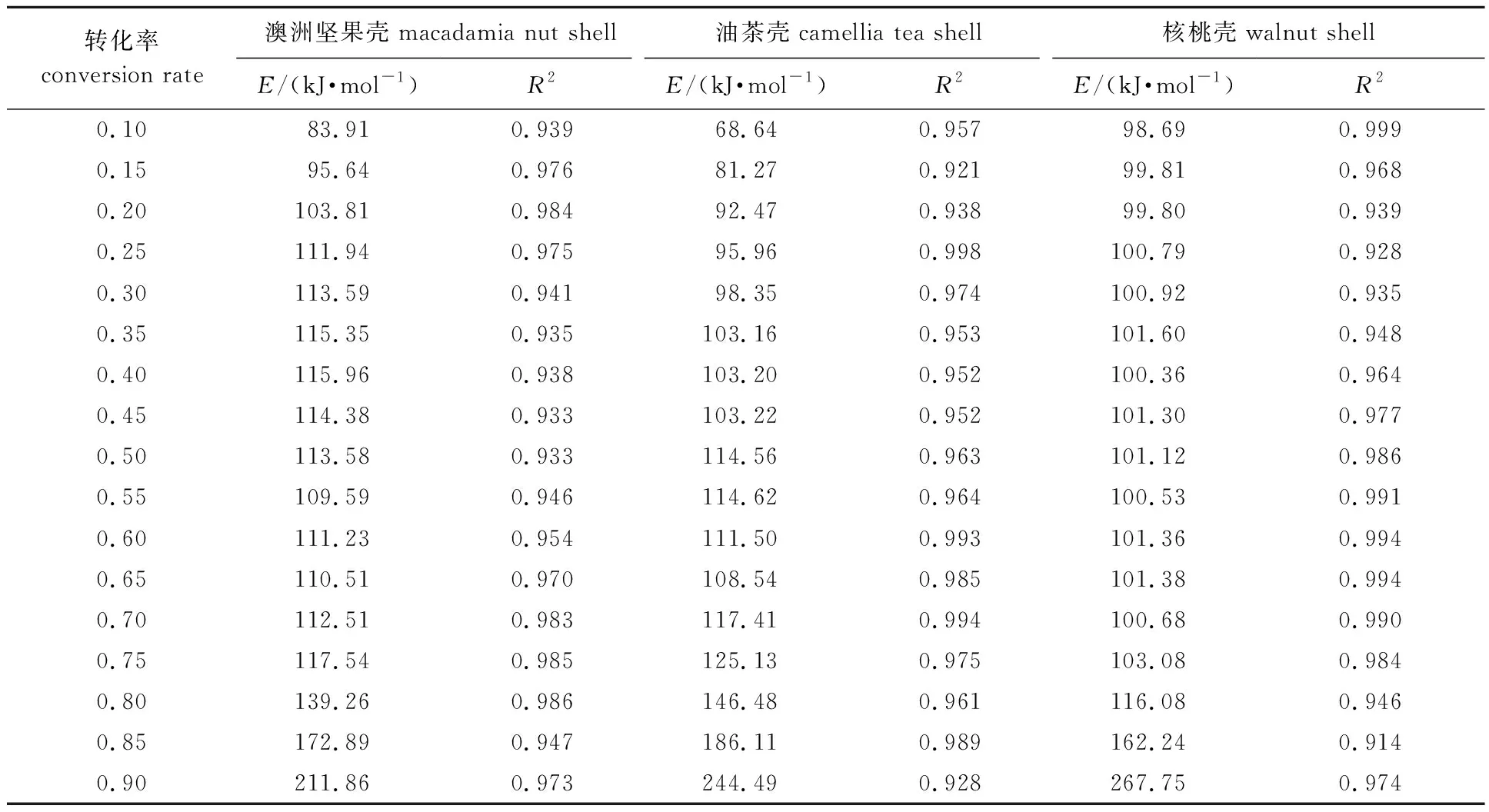
表3 果壳生物质热解动力学参数
3 结 论
3.1采用热重分析仪对林产果壳生物质(澳洲坚果壳、油茶壳、核桃壳)热解特性进行了研究,利用分布活化能模型(DAEM)分析了热解动力学。对3种果壳生物质在升温速率20 ℃/min时的热解情况下进行研究发现,油茶壳热解最大失重速率为8.32%/min,澳洲坚果壳热解最大失重速率为15.85%/min,核桃壳热解最大失重速率为14.95%/min。油茶壳热解起始温度、结束温度、最大失重速率温度均低于澳洲坚果壳和核桃壳;澳洲坚果壳和核桃壳热解特征参数近似。180~450 ℃是3种果壳生物质的主热解阶段。随着升温速率的增加,热解过程整体向高温区移动,热解反应滞后,热解起始温度提高,且升温速率越大,热解速度越快,最大失重速率越大。
3.2采用分布活化能模型(DAEM)研究了3种果壳生物质的热解动力学,结果表明升温速率为10、 20、 40、 60 ℃/min,转化率为0.1~0.9时,热解动力学相关系数R2在0.914~0.999之间,DAEM适用于研究3种果壳生物质的热解动力学。经计算,澳洲坚果壳、油茶壳、核桃壳热解活化能分别为83.91~211.86 kJ/mol、 68.64~244.49 kJ/mol、 98.69~267.75 kJ/mol。随转化率增加,3种果壳生物质的热解活化能呈现相同的变化趋势,但变化幅度不同。
