巨紫荆种子休眠原因及破眠技术研究
2019-01-02,,,,,
, , ,,,
(长江大学园艺园林学院,湖北 荆州 434025)
巨紫荆,学名:CercisgiganteaCheng et Keng f.,为豆科(Leguminosae)紫荆属高大落叶乔木,直径可达50 cm,树高可达15 m,是我国现存特有、极少的乡土树种,主要分布在湖北、浙江、河南、湖南等省,寿命较长,生长速度较快,耐修剪,能够适应干旱、水渍等较为恶劣的环境。巨紫荆春季观花,夏季观叶,秋季观果,冬季观干,具有极高的观赏价值,在景观、道路园林绿化等方面具有广阔的应用前景,巨紫荆具有质硬、耐腐蚀、少开裂等良好结构性能,是良好家具、建筑制作的用材。豆科紫荆属在自然条件下主要是靠种子进行繁殖,近些年来关于豆科紫荆属的种子研究较多,研究表明,种子具有硬实性和休眠特性[1-2]。有关巨紫荆研究主要集中于嫁接繁殖[3]、组织培养快繁[4]、引种栽培繁殖[5]以及园林植物应用[6]等方面,而有关巨紫荆种子休眠特性及快速萌发探究较少,金继良等[7]研究发现,以80 ℃热水结合250 mg/L 赤霉素进行沙藏,可促进种子萌发,但没有具体说明沙藏天数。卢芳等认为,浓硫酸腐蚀结合赤霉素浸泡再低温层积60 d能打破休眠[8]。目前关于巨紫荆种子形态解剖以及快速打破休眠的方法还未见报道。巨紫荆种子解剖结构探究、如何在较短时间打破休眠使其萌发鲜有报道。因此,通过实验对巨紫荆种子外观形态、种子解剖、破除种皮结合激素处理等方面进行探索研究,以期为巨紫荆种子休眠特性研究提供一定理论参考,并为种子快速育苗繁殖及其栽培提供实践生产指导。
1 材料与方法
1.1 供试材料
2017年11月,巨紫荆种子取自湖北省神农架林区五峰山上,海拔1 100 m左右。巨紫荆茎粗10 cm左右,高10 m以上,树上结有大量果荚。采收成熟果实带回长江大学实验室,将果实去壳、净种、阴干,放置常温干燥环境保存备用。
1.2 果实和种子形态指标观察与测定
1.2.1 百粒重
随机选取100粒正常种子在电子天平上称重,重复3次。
1.2.2 果实、种子类型观察与解剖
随机挑选出成熟完整的20个果荚和50粒种子,用电子游标卡尺和20 cm刻度尺测定果荚和种子的长度、宽度和厚度。挑选不同类型的种子,用解剖镜进行形态观察解剖并作比较分析。
1.2.3 种子形态解剖
随机选择种粒饱满、富有光泽的完整种子用解剖刀纵切,在体式显微镜下观察取照。
1.3 处理方法
1.3.1 种子吸水曲线测定
1) 种子处理。
A.浓硫酸腐蚀处理:精选完整饱满种子90粒,将样品每30粒分别放置于3个装有一定量浓硫酸的烧杯中浸没,并计时25,35,45 min取出样品并在流水下冲洗3 min左右。
B.种皮破皮处理:精选完整饱满种子30粒,用普通砂纸随机磨损种皮,使其有一定损伤,待用。2种处理同时以完整种子作为对照。
2) 吸水试验。
精选完整饱满种子30粒,将浓硫酸处理、砂纸处理、完整种子所有样品分类放入不同装有足够量水的容器中,置于25 ℃左右的室温内并开始计时,初始每隔3 h取出样品称重1次,后由吸水变化调整为每隔12 h、24 h取出样品称重1次,称重前吸干种子表面的水分,直至2次吸水测定的值接近恒值为止。
种子净吸水率(%)=(吸水后样品的重量-吸水前样品重量)/吸水前样品重量×100%。
1.3.2 种子发芽试验
1) 种子胚根端处理。
精选饱满种子3 200粒,放置在现配0.1%高锰酸钾溶液中消毒15 min,清水冲洗3次,放置在清水中常温浸泡3 d,每天定时更换清水,浸泡完毕后再清水冲洗3次,用解剖刀对所有种子的胚根端2 mm左右处进行切除,置于50,100,150 mg/L的赤霉素水溶液中,浸泡12 h和48 h,倒出浸泡液,反复清洗种子,以在清水中浸泡12 h和48 h的种子作为对照。
2) 种子子叶端处理。
参照刘雅琦等[9]的方法,种子子叶端处理中,要用解剖刀对所有种子的子叶端2 mm左右处进行切除,其余处理同种子胚根端处理。
3) 浓硫酸、破皮处理对巨紫荆种子发芽的影响。
以完整种子作为对照,以浓硫酸、破皮处理后种子为实验材料,其余条件保持相同。
以上处理的种子采用培养皿发芽法,置于生态培养箱(黑暗12 h/光照12 h交替进行,25 ℃)中进行发芽试验。每个处理选择100粒种子,平行做4次,连续进行10 d的培养。实验期间,逐日定时观察,记录种子发芽数和发霉数,仅以胚根长为种子的一半作为种子发芽标准,测定巨紫荆种子的发芽率。
1.3.3 数据统计与分析
用Microsoft Excel 2016软件录入试验数据,对种子净吸水率、种子萌发率进行曲线作图,然后根据数据及图表进行分析总结。
2 结果与分析
2.1 种子质量及形态与解剖
2.1.1 种子质量测定
经测定完整成熟的巨紫荆果荚长度平均为(11.39±0.698 0)cm,宽度平均为(13.24±0.652 2)mm,厚度平均为(0.908 5±0.174 9)mm;巨紫荆种子的百粒重平均为(2.162 8±0.051 58)g,长度平均为(4.999 2±0.189 4)mm,宽度平均为(4.405±0.147 0)mm,厚度平均为(1.496±0.109 1)mm。
2.1.2 种子形态观察
如版图所示,从果荚中收集种子有以下几种类型:1为完整饱满种粒,2为黑色空瘪种粒,3为绿色空瘪种粒,4为黄色空瘪种粒,5为昆虫幼虫蚕食种粒,6为病菌感染种粒,7为黑色圆润种粒,8为胚根端坏死种粒。其中1为完全可育类型,2~8属于皱缩、空瘪、病虫害等败育类型,在种子催芽试验前,应精挑完整饱满可育型种子作为供试材料,剔除空瘪皱缩病虫害等败育种粒。
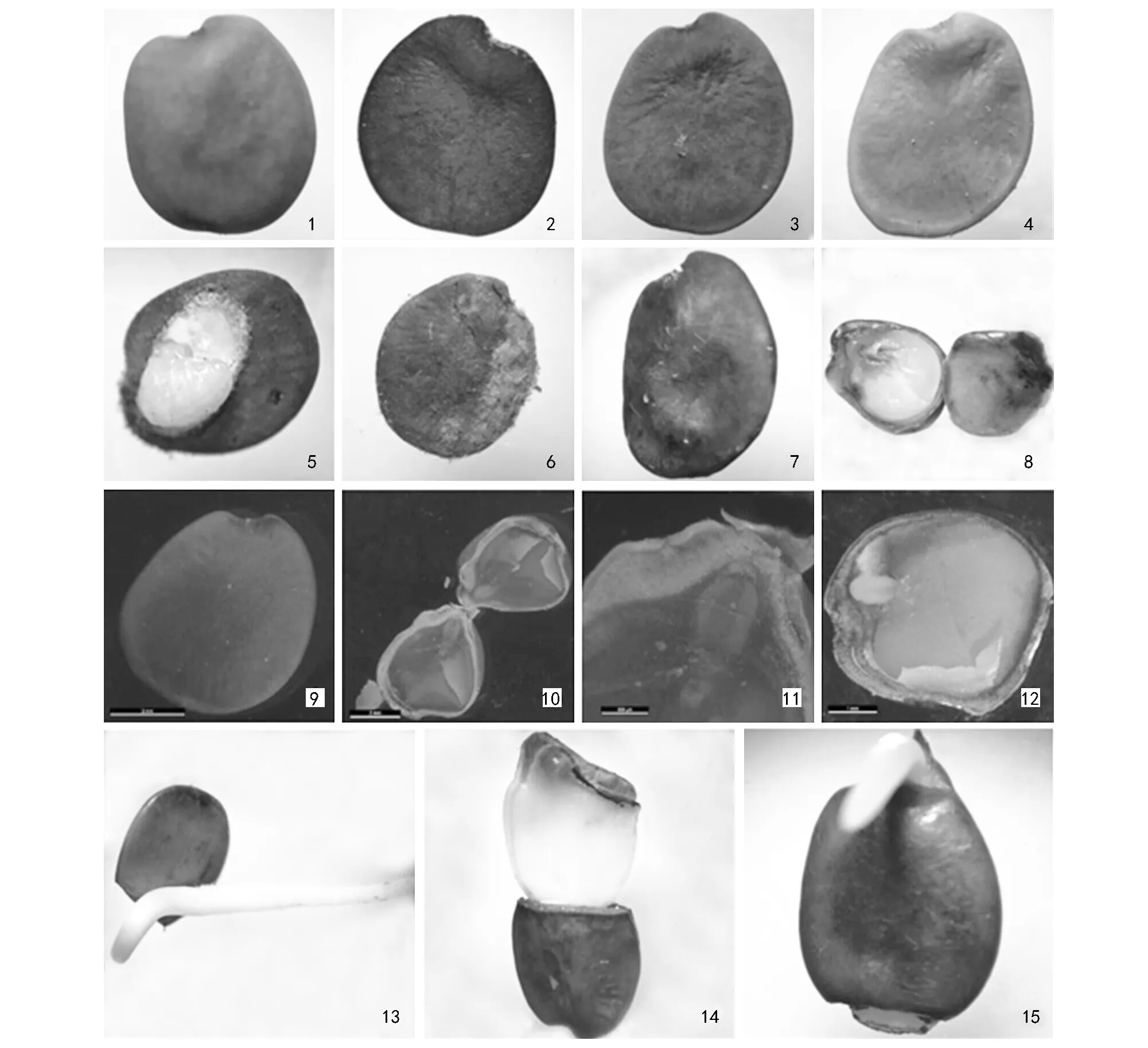
注:1为正常种子;2~4为不同颜色空瘪粒种子;5为虫食种子;6为病菌侵染种子;7为黑色圆润种子;8为胚根坏死种子;9~12为完整种子观察与解剖;13~15为不同处理下种子3种萌发方式。版图
2.1.3 种子形态观察与解剖
由版图-9可知,巨紫荆种子为卵圆形,种皮呈绿色,具有明显种脐,质密,种皮硬化。以完整种子进行纵切解剖观察,如版图-10和版图-11,种脐部位有较发达的维管系统,最外层是逐渐加厚的栅栏组织,其细胞壁紧缩,子叶占据着种子绝大部分,版图-12成熟硬实种子子叶呈黄色,种皮下方存在有透水透气白色管,子叶、胚根形态可见,子叶较大发育完全,为双子叶,胚根略偏于种脐,周围具有空室。高度木质化具有较厚的栅栏组织所形成的种脐,加强了种皮的厚度,也保证了巨紫荆种皮的致密性,因而阻碍了外界的水分、空气等渗透到种皮的内部,这可能是巨紫荆种子难透水透气的原因,也可能是导致种子休眠的主要原因。
2.2 不同处理对种子吸水率的影响
由图1可知:完整种子在前24 h内,吸水缓慢,24 h后吸水趋于平稳;浓硫酸处理不同时间后,在前24 h内吸水速率较快,随着浸泡时间越长,吸水速率越快,24 h后仍在少量吸水,但趋于平稳;破皮种子在前24 h内,吸水速率快,净吸水率明显升高,在24 h后吸水缓慢趋于平稳。完整种子、破皮种子、浓硫酸浸泡25,35,45 min处理最高吸水率分别为7.5%、102.6%、103.2%、101.4%、105.6%,浓硫酸浸泡处理45 min吸水率最高,为完整种子的14.08倍,为破皮种子的1.03倍。由此可见,种皮透水性能很差,用物理和化学方法处理种皮吸水率有明显提升,且处理时间越长,吸水率越大,表明种皮具有不透水不透气的特性,是巨紫荆种子休眠的一个重要原因。
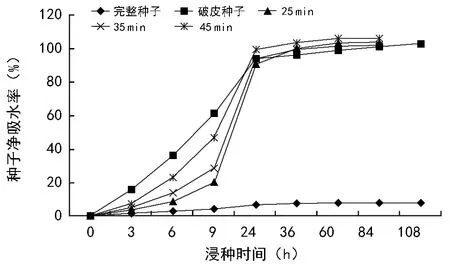
图1 不同处理下巨紫荆种子吸水速率
2.3 不同时间、浓度赤霉素对巨紫荆种子萌发的影响
紫荆属植物繁殖途径主要是以种子进行,其种子具有一定的休眠特性,参考刘雅琪等[9]有关对种子破皮的方法以及米建华等[10]破除紫荆种子休眠的方法,以完整种子作为对照,通过对巨紫荆种子进行砂纸破损种皮边缘、浓硫酸腐蚀打破种皮限制休眠,赤霉素溶液浸泡24 h;以及直接以不同浓度的赤霉素处理,在冰箱低温层积不同天数,在生态培养箱中进行发芽试验。
不同处理对巨紫荆种子萌发产生的3种出芽方式如版图-13~版图-15。版图-13为切除种子胚根端后,种子以胚根生长方式发芽,版图-14为切除种子子叶端后,种子发芽过程为子叶先出,这是一种异状发芽,不能算正常发芽。版图-15为切除种子子叶端结合赤霉素处理,以胚根突破种皮生长方式发芽。其中切除种子胚根端全部以版图-13方式发芽,切除种子子叶端大部分以版图-14方式发芽,而仅有少量种子以版图-15方式发芽,进一步说明种子萌发受种皮限制,存在机械障碍。
巨紫荆种子萌发情况见图2和图3。由图2、图3可知:种子消毒15 min,清水浸泡3 d,切除种子胚根端及子叶端的2 mm左右后,种子第4天开始发芽,能打破机械障碍,可快速促使种子萌发,在相同处理中使用赤霉素浸泡对种子萌发具有明显的促进作用;切除种子胚根端对比切除种子子叶端,对种子萌发有更好的效果,再使用激素浸泡12 h后,最高萌发率可达90%,使用激素浸泡48 h后,最高萌发率为6.67%;相同处理中,不同浓度激素对种子萌发效果不同,在种子最初萌发过程中,低浓度激素有一定促进作用,高浓度激素有一定抑制作用。较长时间激素浸泡切除之后的种子对萌发存在一定的毒害作用,清水浸泡切除子叶端种子对种子有一定促进作用。
试验结果表明,由于种皮限制,胚根较难突破种皮,种子不萌发或萌发率较低,萌发时间较长,种子污染发霉率高,不具备以巨紫荆种子作为快速育苗繁殖的条件,其中通过切除子叶端的种子,大部分以子叶先出,胚根不能正常生长,这属于异状发芽。因而,采用直接切除巨紫荆种子胚根端,形成一个不完整种子,快速打破由于种皮种脐限制产生的休眠,促使种子萌发,在赤霉素处理的条件下,使其快速萌发,提高萌发率。
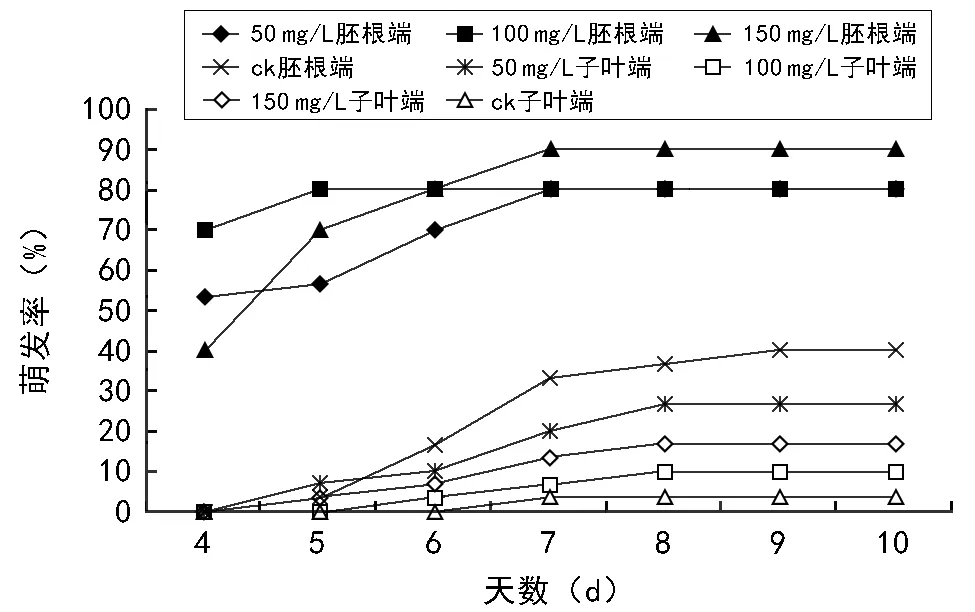
图2 不同浓度赤霉素处理12 h下破皮巨紫荆种子萌发情况
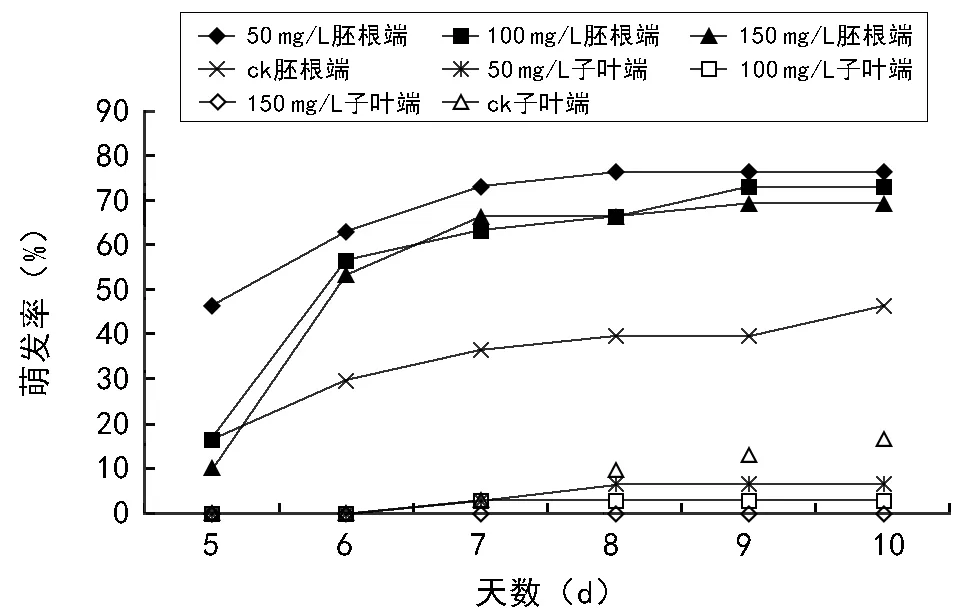
图3 不同浓度赤霉素处理48 h下破皮巨紫荆种子萌发情况
3 讨论与结论
3.1 巨紫荆种子休眠原因
豆科类植物种子普遍具有硬实性,由于大多硬实种子表皮坚硬,对种子产生机械障碍作用,从而导致种子休眠。Juan Niu等从分子角度发现,种子硬实性是与细胞壁生物合成相关[11];杨期和等认为,导致种子休眠与硬实种子透水透气性能较差相关,从而对胚的生长产生机械限制[12];Emine Burcu Yeilyurt等发现,通过对硬实种子进行机械损伤可以提高发芽率[13]。巨紫荆种子休眠原因也较复杂,由于巨紫荆种子表面光滑,质密,种皮硬化,从种子吸水速率曲线可以看出,其具有硬实性,完整种子吸水能力极弱,物理、化学方法处理种皮之后,吸水效果明显,说明种皮对种子吸水有严重阻碍作用;巨紫荆种子种脐部较厚,栅栏组织紧密,导致水分较难从种脐渗透,其透水、透气性极差,水分、气体等很难自由进入种子中。对于硬实种子,采用的方法主要有物理、化学和生物学的方法。本实验在切除种子胚根端及子叶端破除机械障碍后,种子能够萌发,但切除子叶端后,种子发芽过程是以子叶先出,胚根不正常生长,推测胚根端可能存在抑制物质或生理休眠,仅靠赤霉素处理,不能使胚根萌发启动。这是一种异状发芽,不能算正常发芽的种子。清水浸泡12 h最高萌发率为40%,浸泡48 h最高萌发率为73.3%。这进一步说明种子由于种皮的机械障碍而限制巨紫荆种子的萌发,是产生种子休眠的重要原因。
3.2 不同组合处理对种子发芽特性的影响
赤霉素处理48 h,较长时间浸泡对破损种皮的种子会有一定的毒害作用,表现为种子变黑坏死、长菌感染等,清水浸泡48 h后可能使种子抑制物浓度降低,对种子萌发具有一定促进作用,因而赤霉素处理时间以12 h为宜。对比切除种子胚根与子叶端在不同浓度激素处理下,切除胚根端较切出子叶端种子,萌发率高,萌发时间快,说明巨紫荆种子发芽方式主要靠胚根生长突破种皮限制,赤霉素处理能使种子快速萌发,增加发芽率,因此破除巨紫荆种子种皮限制休眠宜选择切除种子胚根端。由于种子受机械破损严重,在培养过程中能在较短时间内发芽,种子污染率低,种子利用效率高。说明破除种皮限制,打破种子机械障碍后,种子能直接萌发,一定浓度赤霉素的处理能够加快种子萌发,对巨紫荆种子萌发有促进作用,表现为萌发率大幅度增加、发芽整齐度提高、发芽速度加快,其中在切除胚根端,使用150 mg/L GA3处理12 h后,效果最好,萌发率最高为90%。
3.3 巨紫荆种子败育情况分析
自然条件下巨紫荆成年树所结果荚较多,但其种子空瘪、虫食、菌染等较严重,而且果荚存在落果现象,提早落的果荚,里面的种子败育更加严重,污染率也较高,果荚提前脱落可能是昆虫、病害所致。成年巨紫荆在结果数量与避免虫食方面达到一种平衡,树体营养对果实以及种子发育也有重要影响。巨紫荆结籽量巨大,对资源需求量较大,母株很难满足其资源需求,从而导致巨紫荆种子败育率高。而主要传粉昆虫影响豆科植物结实,胚珠败育可能导致结实率低[14],高成杰等认为,昆虫的寄生对果荚内种子的败育产生影响,败育种子数与被寄生种子数呈正相关[15],因此昆虫幼虫蚕食种子,可能是传粉昆虫在授粉过程中把卵传进子房,虫卵发育过程中以种子为食,导致种子败育率较高。在采集的巨紫荆果荚中,每个果荚平均含有种子(7.35±0.9333)粒,平均败育种子(2.95±1.099)粒,平均败育率为40.1%。种子败育率高是由多方面造成,可能与细菌感染、昆虫幼虫寄生蚕食,还可能与树体资源限制或者授粉受精不足有关,导致种粒皱缩空瘪坏死,还应开展传粉生物学的研究,对其授粉受精进行观察,进一步确定败育原因。因此在种子选育中,获得高质量的种子是比较重要的,在进行种子筛选时,选择体积膨大、完整无缺口、无病菌绿皮种子进行育苗,这类种子为有活力的种子。
3.4 幼苗移栽情况分析
对不同发芽程度的幼苗进行移栽,发现待子叶完全脱离种壳后再移栽至基质中,部分巨紫荆幼苗枯萎死亡。对其根系观察发现,根系出现表皮光滑无毛,或根毛死亡脱落形成黑色毛孔,或根系较短发育不良,原因可能存在移栽方法不当,使幼苗根系无法充分接触基质或部分根系被折断损伤,幼苗根系缺水,根毛死亡脱落最终导致幼苗死亡。对根系进一步观察发现,有根结线虫和红蜘蛛的存在,对巨紫荆的根系造成严重影响,原因可能是育苗基质未进行消毒杀菌处理,进而导致幼苗死亡。因此,在育苗过程中,应对育苗基质进行杀虫灭菌处理,以减少土传病害对幼苗的影响。而选择发芽种子带壳进行移栽,每天定时补充水分,幼苗正常生长,茎秆粗壮,扎土较深。所以,巨紫荆种子幼苗移栽以切除种子胚根端,100 mg/L GA3处理12 h,胚根长为种子长一半为宜。
4 结 论
巨紫荆种子具有硬实现象,在催芽前要先进行净种、剔除败育粒、消毒等处理,然后以清水浸泡巨紫荆种子3 d,清水要求每天换,切除巨紫荆种子胚根端2 mm左右,用100 mg/L赤霉素处理已切除胚根端种子12 h,在生态培养箱培养(黑暗12 h/光照12 h交替进行,25 ℃中进行培养,能够快速有效打破休眠,第3天开始萌发,第5天达到最高萌发率为80%。
