β-胡萝卜素抗氧化作用的研究
2018-12-29曲蕙名刘邦刚王振国刘建龙刘可春
■曲蕙名 王 莹 楚 杰* 刘邦刚 王振国 刘建龙 刘可春
(1.山东师范大学生命科学学院,山东济南250014;2.山东省科学院生物研究所山东省生物检测技术工程实验室山东省生物传感器重点实验室,山东济南250014;3.济南大学山东省医学科学院医学与生命科学学院,山东济南250014)
自由基在自然界中是客观存在的,适量的自由基有助于维持动物体内正常的生命活动,动物体可依靠内源性自由基清除系统多余的自由基,使自由基处于稳衡性动态,动物机体处于稳定的还原态[1]。但当内源性清除系统不能及时彻底的清除多余自由基时,过量的自由基诱发动物机体产生氧化应激,破坏细胞膜,使血清抗蛋白酶失去活性,诱发一系列疾病[2]。鱼类在养殖过程中易受到饲料组成、水体质量等因素的影响而产生应激反应,而所有较为强烈的应激都会伴随着氧化应激的产生。氧化应激对鱼类养殖业产生严重损害,影响鱼体正常生长,诱发疾病甚至死亡,因此利用天然的抗氧化饲料添加剂十分必要。
β-胡萝卜素属于类胡萝卜素,是维生素A的前体物质,因其多烯烃结构而有较好的抗氧化能力,能清除自由基,降低脂质氧化物的产生,使机体的抗氧化状态明显改善[3]。β-胡萝卜素具有抗氧化、提高免疫力和繁殖力等功效,是良好的饲料添加剂和营养增补剂。有研究报道,通过在饲料中添加不同水平的β-胡萝卜素,可改善禽蛋质量,提高生产性能和后代成活率[4-6]。目前β-胡萝卜素作为抗氧化剂在鱼类中的研究相对较少。斑马鱼作为一种新型模式脊椎动物,具有繁殖能力强、生殖周期短,胚胎透明、能在显微镜下进行实时观察等特点。斑马鱼被美国FDA列为继人和啮齿类鼠之后的第三大模式生物,已广泛应用于生命科学研究[7-9]。本文以转基因皮肤荧光斑马鱼为实验对象,研究了β-胡萝卜素体外抗氧化活性及对转基因斑马鱼抗氧化功能的影响,为鱼类养殖过程中避免氧化应激损伤和疫病预防提供实验依据。
1 材料与方法
1.1 材料与试剂
β-胡萝卜素,实验室由三孢布拉霉菌发酵后分离提取获得(纯度90%以上);1,1-二苯基-2-三硝基苯肼(DPPH)[梯希爱(上海)化成工业发展有限公司];VC、无水乙醇、30%H2O2、水杨酸、三羟甲基氨基甲烷(Tris)、邻苯三酚、铁氰化钾、三氯乙酸、氯化铁、二甲亚砜(DMSO)等均为国产分析纯(国药集团化学试剂有限公司);水为实验室自制双蒸水;转基因皮肤荧光斑马鱼CY-17(krt4:NTR-hKitGR)的养殖和繁殖参照Westerfield[10]的方法。
1.2 实验仪器
UV-2100型紫外可见分光光度计(上海合利仪器有限公司);恒温水浴锅(上海贺德实验设备有限公司);体式荧光显微镜SZX-16(日本Olympus公司);311型水套式二氧化碳培养箱(美国Thermo Forma公司)。
1.3 实验方法
1.3.1 β-胡萝卜素体外抗氧化活性实验
采用DPPH法、水杨酸法和邻苯三酚自氧法分别表征清除DPPH自由基(DPPH·)、羟基自由基(·OH)和超氧阴离子自由基(·)的能力;测定β-胡萝卜素的还原力,同时以VC做阳性对照。
1.3.1.1 DPPH·的清除实验
将β-胡萝卜素样品分别配制成质量浓度为20、40、60、80 μg/ml和100 μg/ml的待测样液,具体操作参照MüLler等[11]方法略作调整:准确称取DPPH 0.019 7 g,用无水乙醇溶解并定容至50.00 ml作储备液。将DPPH储备液配制成100 μmol/l的工作液,取1.0 ml待测样液与3.0 ml DPPH工作液充分混匀,于室温反应20 min,517 nm处测吸光度,VC组相同处理。清除率计算公式如下:
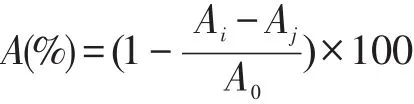
式中:A——DPPH·清除率(%);
Ai——加入β-胡萝卜素时溶液的吸光度;
Aj——β-胡萝卜素溶液在测定波长处的吸光度;
A0——未加β-胡萝卜素时溶液的吸光度。
1.3.1.2 羟基自由基的清除实验
实验前配制质量浓度 20、40、60、80 μg/ml和100 μg/ml的β-胡萝卜素样液,具体操作参照李全国等[12]方法略作调整:配制9.0 mmol/l的FeSO4溶液;9.0 mmol/l的水杨酸溶液,无水乙醇配制;30%的市售H2O2稀释为8.8 mmol/l。在反应体系中依次加入2.0 ml FeSO4溶液,2.0 ml水杨酸-乙醇溶液,2.0 ml受试样液,2.0 ml H2O2,充分混匀后在37℃下反应30 min,在510 nm处测吸光值,VC组相同处理。清除率计算公式如下:
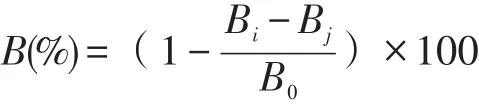
式中:B——·OH清除率(%);
Bi——加入β-胡萝卜素时溶液的吸光度;
Bj——β-胡萝卜素溶液在测定波长处的吸光度;
B0——未加β-胡萝卜素时溶液的吸光度。
1.3.1.3 超氧阴离子自由基的清除实验
实验前配制质量浓度 20、40、60、80 μg/ml和100 μg/ml的β-胡萝卜素样液,具体操作参照许申鸿等[13]方法略作调整:配制pH为8.2、浓度为0.05 mol/l的Tris-HCl缓冲液,25 ℃预热20 min;以10 mmol/l的HCl配制浓度为2.5 mmol/l的邻苯三酚,25℃预热20 min。在反应体系中依次加入4.5 ml Tris-HCl缓冲液、1.0 ml受试样液、0.5 ml邻苯三酚溶液,充分混匀后 25 ℃反应 5 min,立即加入8.0 mol/l的HCl(2~3滴)终止反应,在320 nm处测吸光值,VC组相同处理。清除率计算公式如下:
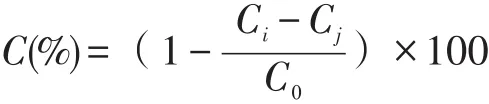
Ci——加入β-胡萝卜素时溶液的吸光度;
Cj——β-胡萝卜素溶液在测定波长处的吸光度;
C0——未加β-胡萝卜素时溶液的吸光度。
1.3.1.4 还原力的测定
实验前配制浓度为120、140、160、180、200 μg/ml的β-胡萝卜素溶液;配制0.2 mol/l pH值6.6的磷酸缓冲液、1%的铁氰化钾溶液、10%的三氯乙酸溶液、0.1%的氯化铁溶液。具体操作参照王春霞等[14]方法并略作调整:取不同浓度的β-胡萝卜素样品溶液2.5 ml,依次加入2.5 ml磷酸缓冲液和2.5 ml铁氰化钾溶液混匀,50℃水浴锅中反应20 min后,向反应体系中加入2.5 ml三氯乙酸溶液,充分混匀后以3 000 r/min的转速离心10 min。取上清液5 ml,加入0.5 ml氯化铁溶液和4 ml蒸馏水,混匀后室温放置10 min于700 nm处测定吸光度。同时以VC做对照。
1.3.2 转基因皮肤荧光斑马鱼体内抗氧化活性实验
1.3.2.1 实验动物
胚胎发育的初期,鱼类的皮肤只有两层:最外面的包膜层和内表皮基底层,这些就构成了针对病原体入侵的第一道防御线。当皮肤暴露于不利的外界环境中时,会触发细胞凋亡反应,以防止其层中致癌突变的积累,药物加入后能够激活修复途径,以恢复皮肤完整性[15]。
自由基可直接破坏糖类和磷脂等细胞膜组成结构,引起氧化应激,造成代谢障碍;改变线粒体膜渗透性,使大量细胞色素C被释放,造成蛋白水解,DNA降解[16-18]。抗氧化药物的加入可以淬灭细胞内多余的自由基,从而减少细胞凋亡。
转基因皮肤荧光斑马鱼是将表皮细胞特异性标记绿色荧光蛋白与硝基还原酶(NTR)共同表达在斑马鱼表皮细胞上,在体式荧光显微镜下皮肤会显示很多斑点。本研究对1dpf(days post fertilization,受精后天数)的转基因皮肤荧光斑马鱼胚胎给药脱膜,然后加入甲硝唑使得角质细胞凋亡,荧光斑点减少;抗氧化药物加入后,一部分角质细胞的荧光得以表达,通过计数荧光点数即可测定药物的抗氧化能力。
实验前将健康成熟的转基因皮肤荧光斑马鱼按雌雄比1∶1或1∶2比例放入交配缸中,中间放置隔板,次日清晨抽去隔板,光照刺激产卵后收集受精卵,消毒后放置于28℃恒温培养箱中孵育24 h备用。
1.3.2.2 给药处理
将恒温培养箱中孵育24 h的转基因皮肤荧光斑马鱼胚胎取出,1 mg/ml的链霉蛋白酶溶液进行脱膜。将脱去卵膜的转基因皮肤荧光斑马鱼胚胎随机分成溶剂对照组、甲硝唑组、β-胡萝卜素和VC组,β-胡萝卜素和VC组设置4个实验浓度(25、50、100、200 μg/ml),加入24孔板中,每组2个副孔,每孔5个胚胎,实验重复3次。
溶剂对照组加入5 μl的DMSO后,新鲜培养水补至2 ml;用DMSO将甲硝唑配制成4 mol/l的母液,使用时用新鲜培养水稀释至浓度为0.01 mol/l,甲硝唑组加入2 ml 0.01mol/l的甲硝唑溶液;将β-胡萝卜素用DMSO先配制成10、20、40、80 mg/ml的母液,每组分别加入5 μl不同浓度的母液后,用0.01 mol/l的甲硝唑溶液补至2 ml,配制成25、50、100、200 μg/ml 4个浓度的实验组。VC组同样处理。
1.3.2.3 统计分析
将给药孵育24 h之后的孔板取出,在荧光显微镜下观察转基因皮肤荧光斑马鱼的荧光点数,选择卵黄囊延伸区部位进行拍照。利用imagepro-plus软件统计各组斑马鱼的荧光点数,运用SPSS软件进行统计分析。
相对抗氧化能力(%)=(给药组皮肤荧光点数-甲硝唑组荧光点数)/(溶剂对照组荧光点数-甲硝唑组荧光点数)×100
2 结果与分析
2.1 β-胡萝卜素清除自由基的能力
2.1.1 清除DPPH·的能力
DPPH在有机溶剂中是一种稳定的以氮为中心顺磁化合物,并具有孤对电子,其醇溶液呈紫色。抗氧化药物的加入可使DPPH的孤对电子配对成电子对,而使其颜色变浅呈黄色,在最大光吸收波长处的吸光值下降,吸光度水平的降低表明抗氧化活性的增加[19],因此可以用分光光度计进行定量测定,以评价受试样品的抗氧化能力。

图1 不同浓度样品对DPPH·的清除作用
由图1可知,随β-胡萝卜素浓度的增大,其对DPPH·的清除率增大,样品浓度从20 μg/ml到100 μg/ml,对 DPPH·的清除率从 56.32%增大到71.22%,清除能力均遵循剂量-效应关系,有较好的清除能力。同等质量浓度的VC清除率最大为92.75%,与VC相比,β-胡萝卜素清除率小于VC,其抗氧化能力小于VC。
2.1.2 清除·OH的能力
羟基自由基(·OH)是生物体内活性氧代谢产生的物质,是一种氧化性很强的自由基,能引发不饱和脂肪酸发生脂质过氧化反应,使机体发生氧化损伤[20]。Fe2+和过氧化氢混合后反应产生·OH,水杨酸与·OH结合产生有色产物,在510 nm处有最大吸收。受试样液的加入同样会结合·OH,从而减少有色物的生成并降低吸光度。

图2 不同浓度样品对·OH的清除作用
由图2可知,样品浓度从20 μg/ml增大到100 μg/ml,β-胡萝卜素对·OH的清除率从20.36%增大到29.81%,对·OH有一定的清除能力,同等浓度VC样液的清除率从27.75%增大到41.12%,说明β-胡萝卜素抗氧化能力小于VC,对·OH的清除能力较弱。
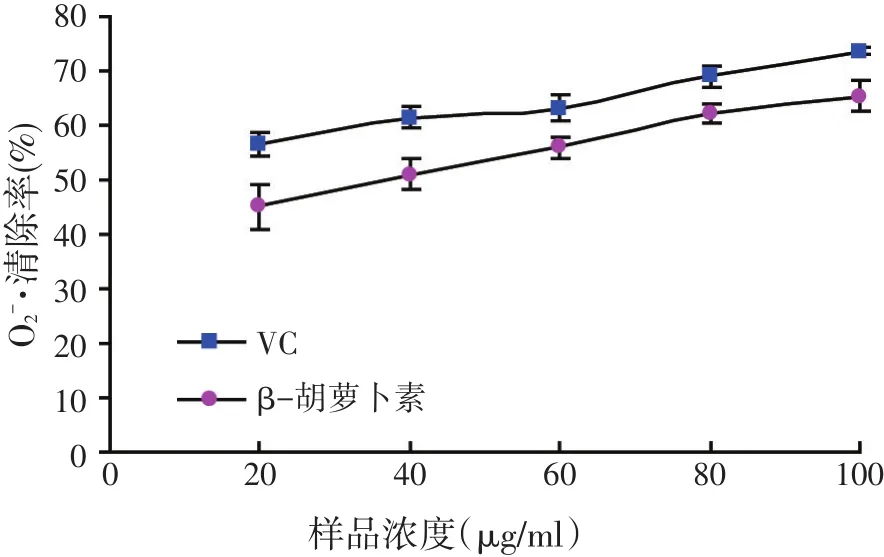
图3 不同浓度样品对O2-·的清除作用
2.2 还原力的测定
铁氰化钾还原法的原理为:K3Fe(CN)6+样品→K4Fe(CN)6+样品氧化物,K4Fe(CN)6+Fe3+→Fe4[Fe(CN)6]3,在波长700 nm条件下测定吸光度,吸光度越大,则样品的还原力越大,抗氧化能力越强。

图4 不同浓度样品的还原力大小
如图4所示,样品浓度从120 μg/ml到200 μg/ml,β-胡萝卜素组吸光度从0.50增大到0.74,VC组吸光度从0.86增大到1.18,还原力均随浓度的增大而增大。与VC相比,β-胡萝卜素有一定的还原能力,但还原能力相对较弱。
2.3 转基因皮肤荧光斑马鱼抗氧化活性
1dpf后观察到200 μg/ml实验组中转基因皮肤荧光斑马鱼畸形、死亡,其余实验组结果如表1所示。由图5可见,溶剂对照组中,转基因皮肤荧光斑马鱼的皮肤荧光点数最多;甲硝唑组荧光点数最少。加入受试样品后,重现观察到荧光斑点,说明该样品的抗氧化性有助于转基因皮肤荧光斑马鱼恢复荧光斑点,正常生长。随着受试样品浓度的增加,荧光点数增多,抗氧化能力逐渐增强。低、中、高(25、50、100 μg/ml)三个实验组,β-胡萝卜素相对抗氧化能力分别为30.43%、53.62%和73.91%,同等浓度的VC抗氧化能力分别为44.92%、62.32%和78.26,说明在转基因皮肤荧光斑马鱼体内抗氧化实验中,β-胡萝卜素与VC相比,抗氧化能力相差不大。

表1 β-胡萝卜素对转基因皮肤荧光斑马鱼胚胎生成的影响

图5 β-胡萝卜素对转基因皮肤荧光斑马鱼的抗氧化活性的影响
3 讨论
本研究中β-胡萝卜素体外抗氧化活性实验的结果表明,β-胡萝卜素对DPPH·、·OH和·有较好的清除作用,且随着浓度的增大,清除率升高,清除能力均遵循剂量-效应关系。当样品浓度在20~100 μg/ml范围内时,最大清除率分别为71.22%、29.81%和65.28%,同等浓度下VC清除率分别为92.75%、41.12%和73.58%,β-胡萝卜素抗氧化活性弱于VC。同时在还原力的测定实验中,β-胡萝卜素的还原力为0.74,与VC相比,β-胡萝卜素具有一定的还原能力,但还原能力相对较弱。
根据以上体外抗氧化实验结果,本研究以转基因皮肤荧光斑马鱼为研究对象,进行了β-胡萝卜素的体内抗氧化试验,试验中应用的转基因皮肤荧光斑马鱼CY-17(krt4:NTR-hKitGR),是将表皮细胞特异性标记绿色荧光蛋白与硝基还原酶(NTR)共同表达在转基因皮肤荧光斑马鱼表皮细胞上,形成一个条件性诱导的体系,在荧光显微镜下可观察计数荧光细胞,当加入甲硝唑时,与表皮细胞中的硝基还原酶结合,产生大量的自由基使机体产生氧化应激,诱发细胞毒作用,引起表皮细胞死亡,即绿色荧光点消失。再加入β-胡萝卜素后,清除了多余的自由基,减少了细胞毒性,部分细胞恢复活性,使荧光点能够重新在显微镜下观察到。
试验中采用了低、中、高三个实验组,β-胡萝卜素相对抗氧化能力分别为30.43%、53.62%和73.91%,同等浓度的VC抗氧化能力分别为44.92%、62.32%和78.26%;200 μg/ml实验组中,转基因皮肤荧光斑马鱼出现畸形和大量死亡,说明添加适量的β-胡萝卜素有助于转基因皮肤荧光斑马鱼的抗氧化损伤的修复,但过量添加可能会对动物体产生伤害甚至致死。原因可能是在动物体内,氧化还原反应是能量释放和储存的中心枢纽,许多细胞通路对氧化还原的环境非常敏感。适量添加抗氧化剂,有助于维持动物机体的氧化还原稳态。但过量使用会导致氧剥夺和机体缺氧引起还原应激,破坏细胞的能量供应和还原当量水平,影响细胞内的其他氧化还原系统,导致信号传导和基因激活的改变、线粒体功能障碍,最终导致细胞凋亡[21]。
目前,在饲料生产、运输和贮存过程中常常会发生氧化变质现象,降低了饲料品质和营养价值,引起动物机体产生氧化应激,从而导致种畜繁殖障碍,幼畜发病率高和成活率低、畜产品品质下降。抗氧化饲料添加剂的适量使用可以有效保护机体内的氧化平衡,减轻氧化应激的危害,有效维持畜禽良好的生产性能和繁殖性能。寻求高效安全的抗氧化饲料添加剂,提高动物的抗氧化防御能力,β-胡萝卜素作为常用的饲料添加剂,研究其抗氧化功能及作用机理对其在畜禽养殖中的应用具有指导意义。
4 结论
综上所述,适量添加β-胡萝卜素可提高转基因皮肤荧光斑马鱼抗氧化能力,可以作为天然有效的饲料添加剂应用于鱼类养殖业。
