发酵饲料对南美白对虾消化酶活性与肠道菌群的影响
2018-12-29袁春营毕建才崔青曼
■袁春营 孟 阳 毕建才 崔青曼
(天津市海洋环境保护与修复技术工程中心天津市海洋资源与化学重点实验室天津科技大学海洋与环境学院,天津300457)
南美白对虾学名凡纳滨对虾,生长速度快、营养价值高、投报率高,是我国重要的养殖品种之一。但是随着南美白对虾养殖的迅猛发展,病害问题日益突出,日渐污染的环境,同样威胁着养殖对虾的安全,抗生素的使用,不但扰乱了对虾消化道的正常菌群,使病原菌产生抗药性,药物在环境和对虾体内的残留最终威胁人类的健康与安全,已引起人们的广泛关注[1],一些学者将活的微生物添加到饲料中,通过改善肠道菌群平衡,而对动物产生有益影响[2-3]。但是,南美白对虾饲料加工过程中有高温熟化的过程,意味着添加的益生菌为抗高温的芽孢杆菌,而对虾的消化道短,大部分芽孢杆菌的芽孢经过对虾肠道时未来得及萌发就排除体外,致使其应用效果受到限制。对此,开发高效益生菌投喂技术,提高益生菌的养殖效果具有重要实践意义。
发酵饲料是以微生物为生物饲料发酵菌种,将饲料蛋白质转化为微生物菌体蛋白、生物活性小肽类氨基酸、微生物活性益生菌为一体的生物发酵饲料,同时还可以去除饲料中的抗营养因子,在畜禽养殖上广泛应用。鉴于此,我们通过将复合益生菌与饲料混合发酵,探讨发酵饲料对南美白对虾生长、消化酶活性和肠道菌群的影响,为发酵饲料的广泛应用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 对虾和菌种
南美白对虾来自天津鑫永丰水产养殖有限公司,规格(4.16±0.56)g,产朊假丝酵母菌、植物乳杆菌和地衣芽孢杆菌购自中国普通微生物菌种保藏管理中心。
1.1.2 实验仪器
立式双层小容量恒温培养摇床,上海新苗医疗器械制造有限公司;全温型多振幅轨道摇床,上海智城分析仪器制造有限公司;立式蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;PCR扩增仪,美国伯乐公司;高速冷冻离心机,湖南湘仪离心机仪器有限公司;生物显微镜,麦克奥迪实业集团有限公司;精密pH计,天津市盛邦科学仪器技术公司;CO2培养箱,美国Thermo公司;电子分析天平,梅特勒-托利多公司(瑞士)。
1.1.3 基础饲料
基础饲料为自行配制,配方见表1。饲料原料经粉碎后过80目筛,各原料按配比定量后混合均匀,然后加入适量的水揉匀,经双螺杆挤条机挤压出直径为1.0 mm粒径的饲料,60℃烘干后剪切成1.2 mm长的颗粒贮存备用。
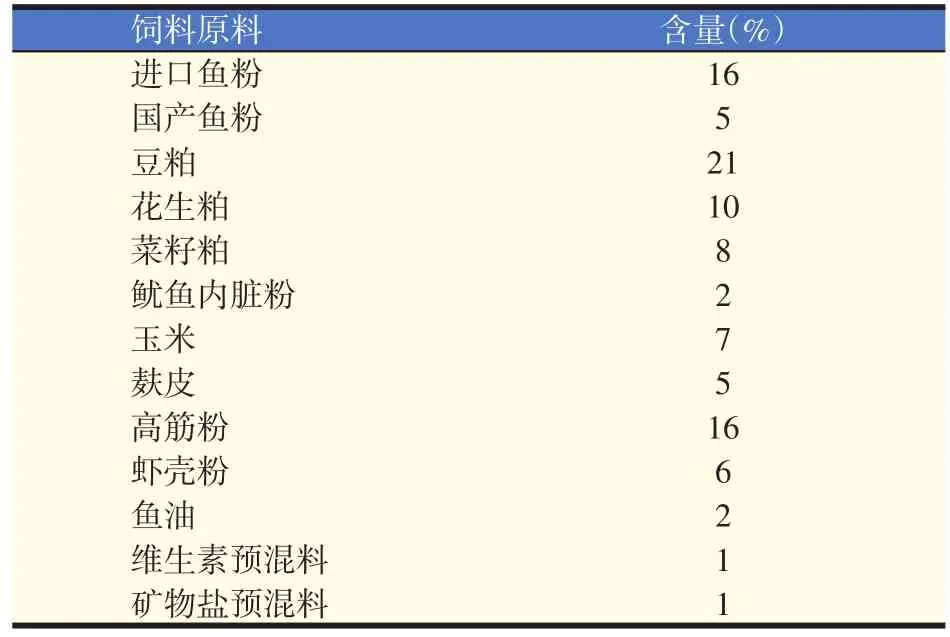
表1 基础饲料配方
1.2 实验方法
1.2.1 实验设计
本实验设置1个发酵饲料组和1个对照组,每组设3个平行,共计6个处理。水族箱规格720 mm×490 mm×380 mm,每个水族箱中投放40只对虾。
1.2.2 发酵饲料制备
将地衣芽孢杆菌、植物乳杆菌和产朊假丝酵母分别扩大培养,细菌数量分别为1.2×109、1.5×109cfu/ml和1.6×109cfu/ml,然后按照体积比1∶1∶1混合,混合菌液中加入红糖(2 g/1 000 ml)和自来水,菌种液与水的比例为1∶80,混合均匀,与对虾饲料,按照2∶5的比例搅拌均匀,塑料薄膜密封发酵24 h,制成发酵饲料。
1.2.3 饲养管理
饲养期间,投饵量按照对虾体重的4%~6%进行投喂,每天投喂4次,投喂时间:6:00、11:00、16:00和21:00,各时间点投喂量占日总投饵量的比值分别为30%、20%、30%和20%。饲养期间连续充气,水温27~29 ℃,盐度18~20,pH值7.8~8.1,溶解氧>6 mg/l。饲养时间为6周。
1.2.4 指标测定
1.2.4.1 对虾生物学指标
6周养殖结束,分别测定对虾的体长和体质量,计算对虾的特定生长率。
特定生长率(%/d,SGR)=100×(LnMt-LnMo)/t
式中:Mo和Mt——分别为初始体质量和终末体质量(g);
t——试验天数(d)。
1.2.4.2 消化酶活性
①样品处理
解剖南美白对虾,取出胃、肝胰腺和肠道,去除肠道的内容物并且在滤纸上将表面的水分吸干,所有操作均在冰浴中进行。分别称取适量肠道、胃及肝胰腺样品,加入9倍体积预冷的生理盐水匀浆,8 000 r/min、4℃离心10 min,取上清液,4℃备用。
②胃蛋白酶
1.0%牛血红蛋白-0.1 mol/l柠檬酸缓冲液(pH值3.0)1 ml,0.04 mol/l EDTA-Na20.05 ml,0.2 mol/l柠檬酸缓冲液(pH值3.0)0.2 ml,酶粗提液0.1 ml,置于37℃水浴中,反应15 min后加入30%三氯乙酸0.5 ml(空白在加入三氯乙酸后再加入酶粗提液),8 000 r/min离心4 min,取上清液1 ml,加入0.5 mol/l NaOH 2.5 ml,Folin试剂0.25 ml,混匀,37℃水浴显色15 min。680 nm波长测吸光值。胃蛋白酶活性用活力单位(U)表示,以1 mg蛋白的酶液每分钟水解牛血红蛋白产生1 μg酪氨酸为1个酶活力单位。
③蛋白酶
2%干酪素-0.1 mol/l磷酸盐缓冲液(pH值7.2)1 ml,酶粗提液1 ml,置于37℃水浴中,反应15 min后加入30%三氯乙酸0.5 ml(空白在加入三氯乙酸后再加入酶粗提液),8 000 r/min离心4 min,取上清液 1 ml,加入 0.4 mol/l Na2CO35 ml,稀释的 Folin 试剂(与蒸馏水1∶1稀释)1 ml,混匀,37℃水浴显色15 min。680 nm波长测吸光值。蛋白酶活性用活力单位(U)表示,以1 mg蛋白的酶液每分钟水解干酪素产生1 μg酪氨酸为1个酶活力单位。
④淀粉酶
1 ml 1.0%可溶性淀粉-0.1 mol/l磷酸盐缓冲液(pH值8.0),加酶粗提液0.1 ml,37℃水浴反应5 min,加入DNS(3,5-二硝基水杨酸)显色剂1.0 ml(空白在加入DNS后再加入酶粗提液),煮沸10 min终止反应,540 nm波长测吸光值。淀粉酶活性用活力单位(U)表示,以1 mg蛋白的酶液每分钟水解淀粉产生1 mg葡萄糖为1个酶活力单位。
⑤脂肪酶
5 ml 0.025 mol/l磷酸缓冲液(pH值7.5)加入4 ml聚乙烯醇橄榄油乳化液,置40℃水浴中预热10 min,然后加入酶粗提液0.5 ml,40℃保温30 min,立即加入95%乙醇15 ml终止反应。加酚酞指示剂3滴,用0.05 mol/l标准NaOH滴定至微红色,并同时做空白对照。脂肪酶活性用活力单位(U)表示,以1 mg蛋白的酶液每分钟催化脂肪产生1 μmol脂肪酸为1个酶活力单位。
1.2.5 肠道菌群分析
解剖取出对虾肠道,无菌水清洗,-20℃保存,送至北京诺禾致源科技股份有限公司测序。根据所扩增的16S区域特点,基于Illumina HiSeq测序平台,利用双末端测序(Paired-End)的方法,构建小片段文库进行双末端测序。对Reads拼接过滤,得到有效数据(Clean Data),对 OTUs(Operational Taxonomic Units)聚类,进行物种丰度、α-多样性计算,挖掘不同处理组之间的差异。
1.2.6 数据处理与分析
各处理组数据进行单因素方差分析。分析软件为SPSS 17.0,实验数据均以“平均值±标准差(Mean±SD)”表示
2 结果与分析
2.1 发酵饲料对南美白对虾特定生长率的影响(见图1)

图1 发酵饲料对南美白对虾生长性能的影响
发酵饲料投喂的南美白对虾特定生长率高于对照饲料,但未达显著性水平(P>0.05),可见饲料经过发酵后,能够提高南美白对虾生长性能。
2.2 发酵饲料对南美白对虾消化酶活性的影响
不同处理组南美白对虾胃、肝胰腺和肠道的消化酶活性测定结果见表1、表2、表3、表4。发酵饲料能够显著或极显著提高南美白对虾胃、肝胰腺和肠道中胃蛋白酶活性(P<0.05或P<0.01),极显著提高南美白对虾肠道中蛋白酶活性(P<0.01),显著或极显著提高南美白对虾肝胰腺及肠道中淀粉酶活性(P<0.05或P<0.01),显著提高南美白对虾肝胰腺和肠道中脂肪酶活性(P<0.05),提高其他组织器官中消化酶活性,但未达显著性差异(P>0.05)。

表1 不同处理组南美白对虾胃蛋白酶活性比较(U/mg)
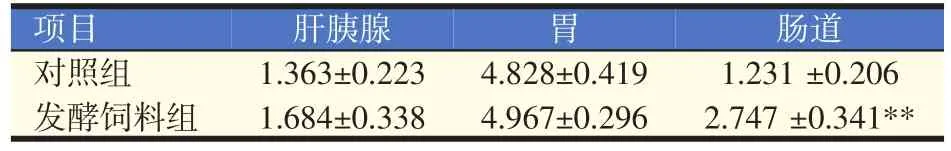
表2 不同处理组南美白对虾蛋白酶活性比较(U/mg)

表3 不同处理组南美白对虾淀粉酶活性比较(U/mg)

表4 不同处理组南美白对虾脂肪酶活性比较(U/mg)
2.3 发酵饲料对南美白对虾肠道菌群的影响
基于Illumina HiSeq测序平台,不同处理组南美白对虾肠道菌群分析结果见图2、图3及表5,其中对照组用Control表示,发酵饲料组用FD表示。
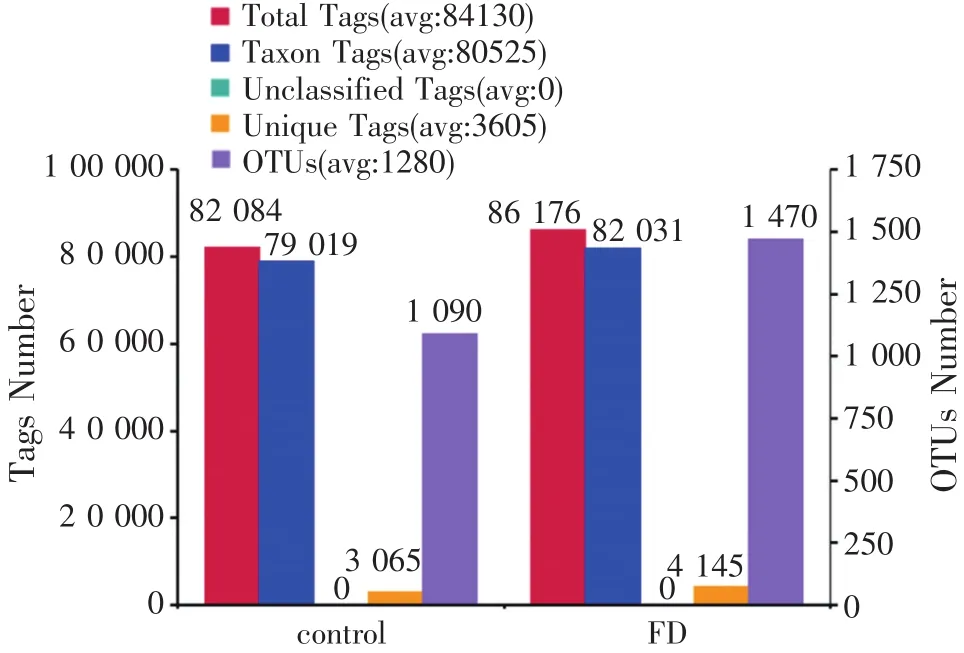
图2 南美白对虾肠道菌群中的OTUs聚类和注释情况
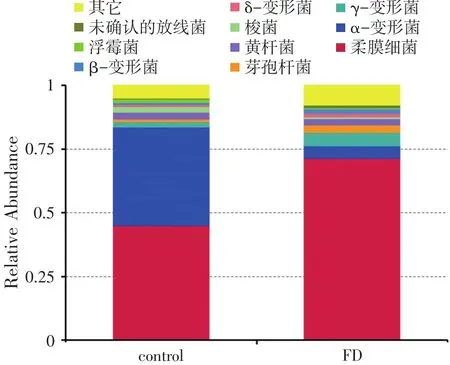
图3 南美白对虾肠道中门水平上的物种相对丰度柱形图

表5 南美白对虾肠道中α-多样性指数统计
2.3.1 OTU聚类及物种注释情况
对发酵饲料组和对照组南美白对虾肠道中的OTU聚类和注释结果进行了综合统计,结果见图2。发酵饲料组南美白对虾肠道共得到86 176条Tags,1 470个OTUs,对照组为82 084条Tags,1 090个OTUs,可见饲喂发酵饲料后,肠道菌群种类数明显增加。
2.3.2 物种相对丰度展示
根据物种注释结果,选取每个样品在各分类水平(Phylum、Class、Order、Family、Genus)上最大丰度排名前10的物种,生成物种相对丰度柱形累加图,以便直观查看各样品在不同分类水平上,相对丰度较高的物种及其比例。以门水平物种相对丰度柱形图为例展示如图3。对每个样品的物种分类结果,筛选特别关注的物种(默认选择最大相对丰度前10的属)进行物种分类树统计。与对照组相比,发酵饲料组南美白对虾肠道中的软壁菌门(Tenericutes)相对丰度(Rela⁃tive Abundance)明显增多(58.133%增加到70.04%),拟杆菌门(Bacteroidetes)相对丰度增加(2.251%增加到 2.71%),放线菌门(Actinobacteria)明显增多(0.375%增加到0.45%),变形菌门(Proteobacteria)明显减少(24.10%减小到20.002%),厚壁菌门明显减小(由2.69%减小到2.236%),疣微菌门(Verrucomicro⁃bia)明显减少,酸杆菌门(Acidobacteria)明显增多。尽管发酵饲料组对虾肠道中厚壁菌门相对丰度减小(由2.69%减小到2.236%),但是芽孢杆菌纲相对丰度增加(由1.147%增加到1.38%),乳杆菌属相对丰度增加(由1.147%增加到1.38%),其中植物乳杆菌由0.001%增加到0.01%。可见发酵饲料能够改变对虾肠道菌群组成,尤其提高了植物乳杆菌的相对丰度。
2.3.3 α-多样性指数
一般来说,在97%以上的序列一致性下聚类成为一个OTU的序列被认为可能是源自于同一个种的序列。因此,对不同样品在97%一致性阈值下的α-多样性分析指数进行统计,见表5。发酵饲料组的南美白对虾肠道菌群的香浓-威纳指数、辛普森指数、chao1指数、ACE指数、测序深度指数、谱系多样性指数均明显高于对照组,进一步说明发酵饲料投喂的对虾肠道菌群多样性较好。
3 讨论
3.1 南美白对虾的消化酶
甲壳动物消化酶的活性与其食性、发育阶段、营养、温度、pH值、盐度等诸因素密切相关,并同时受到内因和外因的调控。对甲壳动物消化酶学的深入理解,有助于了解甲壳动物消化生理状况,有效提高饲料的消化利用率,减轻对环境的污染[4]。黄凯等[5]研究了盐度(1、15和30)对凡纳滨对虾幼虾消化酶活性的影响,指出当盐度为1时,胃肠中的胰蛋白酶、胃蛋白酶、淀粉酶和脂肪酶及肝胰腺中的胃蛋白酶活性最高,各盐度组的肝胰腺淀粉酶活性很接近;盐度显著影响凡纳滨对虾肝胰腺中胃蛋白酶、脂肪酶、淀粉酶的活力,随着盐度增加,消化酶活力均不断下降[6]。刘明等[7]研究后指出,0.3%、0.5%和1.0%酵母培养物显著提高南美白对虾肝胰腺蛋白酶活性;南美白对虾胃、肝胰脏和肠道脂肪酶的最适温度分别为50、30、40℃,淀粉酶的最适温度均为30℃,蛋白酶的最适pH值分别为6.0、6.0、7.5,脂肪酶的最适pH值均为7.0,淀粉酶的最适pH值分别为6.0、7.0、6.5[8]。南美白对虾胃蛋白酶和类胰蛋白酶活力从Z1到M3期逐渐增大,淀粉酶和纤维素酶活力呈逐渐下降趋势,脂肪酶活力很低,在食性转化过程中,胃蛋白酶、胰蛋白酶和淀粉酶活力呈现较明显的变化,南美白对虾幼体消化酶对饵料中的营养物质有着明显的适应性[9]。乳酸菌能够显著提高凡纳滨对虾肝胰腺和肠道中的淀粉酶和脂肪酶活力及肠道中的蛋白酶活力[3]。我们经过研究发现,发酵饲料能够显著提高南美白对虾胃、肝胰腺和肠道中胃蛋白酶活性,显著提高对虾肠道中的蛋白酶、淀粉酶和脂肪酶活性及肝胰腺中的淀粉酶和脂肪酶活性。
3.2 南美白对虾的肠道菌群
沙玉杰[3]采用Illumina Miseq高通量测序技术分析了凡纳滨对虾肠道中的细菌组成,发现变形菌、疣微菌和放线菌是各个处理组中的优势菌群,但各个处理组中均存在其特有的细菌种类,并且饲料中添加乳酸菌发酵上清液后,显著增加了对虾肠道中放线菌的丰度。以类芽孢杆菌和双歧杆菌为益生菌,添加到凡纳滨对虾饲料中,明显改善对虾肠道的菌群组成[10],芽孢杆菌和中草药制剂也改变了凡纳滨对虾肠道菌群的数量与组成[11]。
本研究发现,软壁菌、变形菌、拟杆菌和厚壁菌是对照组和发酵饲料组南美白对虾肠道中的优势菌落,各个处理组中也存在其特有的细菌种类,发酵饲料能够明显增加软壁菌、放线菌、酸杆菌和拟杆菌的丰度,尤其提高了植物乳杆菌的相对丰度。可见,饲料经过发酵后投喂对虾,明显改善了对虾肠道的菌群组成。
