酶解工艺优化对南极磷虾蛋白功能特性的影响
2018-12-28史洲铭陈雪忠刘志东曲映红
史洲铭,陈雪忠,刘志东,曲映红
(1 中国水产科学研究院东海水产研究所,上海 200090;2 上海首源生物技术有限公司,上海 201101; 3 上海海洋大学食品学院,上海 201306)
南极磷虾(EuphausiasuperbaDana)是一种资源量巨大的战略性海洋生物资源,蛋白质含量高且符合联合国粮农组织(FAO)和世界卫生组织(WHO)定义的优质蛋白,开发应用前景广阔。近年来,国内外研究人员围绕南极磷虾蛋白的制备、生物活性肽等开展了较多研究。但关于南极磷虾蛋白功能特性改善的研究尚较少[1]。研究表明,南极磷虾蛋白作为一种新来源的动物性蛋白,其功能特性与已经商品化的蛋白(如大豆蛋白、乳清蛋白等)的功能特性还存在较大差距,应用性能较差,极大地限制了其在不同领域的应用[2]。
食品蛋白良好的功能特性是其工业化应用的前提和基础。目前,食品蛋白的改性方法主要有物理改性、化学改性和生物改性等方法。食品蛋白的酶法改性具有反应条件温和、特异性强、节能环保和安全性高的特点,已经成为食品蛋白功能特性改进的重要方法之一。研究表明:酶解可改变食品“原始蛋白”的空间结构和氨基酸序列,暴露蛋白基团内部“隐藏”的特定基团;酶解改性不仅能够显著改变乳蛋白、大豆蛋白、大米蛋白等的功能特性,而且其应用领域也得到了很好的拓展,提升了其应用价值[3-6]。
关于南极磷虾蛋白酶解对其功能特性影响的研究报道目前较少。本研究在前期研究的基础上,以食品蛋白的功能特性为评价指标,开展酶解对南极磷虾蛋白功能特性影响的研究,以期为南极磷虾蛋白功能特性的改进、应用领域的拓展提供新的思路。
1 材料与方法
1.1 材料与试剂
南极磷虾由上海开创远洋渔业有限公司2016年11月于南极设得兰群岛海域捕获,-18 ℃冷冻运回国内,-84 ℃贮存备用。碱性蛋白(≥20 U/mg)、中性蛋白酶(≥100 U/mg)、胰蛋白酶(≥50 U/mg)、木瓜蛋白酶(≥800 U/mg)等来自上海谷研实业有限公司;大豆油购于上海市杨浦区卜蜂莲花超市;其他化学试剂均为分析纯级等,来自国药集团化学试剂有限公司。
1.2 仪器与设备
TGl-16M高速台式冷冻离心机(湖南湘仪实验仪器开发有限公司),PRO250匀浆器(美国Pro Scientific公司),BM255搅拌机(美的集团有限公司),UV-8100可见分光光度计(日本岛津公司)。
1.3 试验方法
1.3.1 南极磷虾蛋白的制备
参照高飞等[7]的方法。制备流程:冷冻南极磷虾→室温解冻→加水(料液比1∶3)→匀浆(3 min)→调节pH至5.5→离心(10 000 r/min,10 min)→回收上清液→调节pH至11.5→离心(10 000 r/min,10 min)→取沉淀→调节pH至7.0→真空冷冻干燥(-52 ℃)→南极磷虾蛋白粉(-80℃贮存)。
1.3.2 南极磷虾蛋白的酶解
参照燕梦雅等[8]的方法酶解南极磷虾蛋白。按照南极磷虾蛋白与水之比(1 g∶20 mL) 配制底物,调节溶液至所用酶的最适pH和温度,加入蛋白酶酶解;酶解液100 ℃、灭酶 5 min;冷却至室温,4 ℃、1×104g,离心25 min后收集上清液,喷雾干燥,测定其水解度。
1.3.3 南极磷虾蛋白水解度的测定
南极磷虾蛋白的水解度(DH)测定采用pH-state法[9],该法的原理是基于蛋白水解过程中为保持体系pH恒定而加入碱/酸的量。因此,通过加入碱/酸的量来计算水解度:
(1)
式中:MDH—南极磷虾蛋白水解度,%;C—消耗NaOH溶液物质的量浓度,mol/L,本试验中采用1 mol/L氢氧化钠溶液;V—所用NaOH溶液的体积,mL;mp—底物蛋白的质量,g;htot—底物蛋白的肽键含量,mmol/g,本试验中南极磷虾蛋白的htot为4.27 mmol/g;α—蛋白的氨基解离度,可以通过如下公式计算。
(2)
(3)
式中:pH—酶解过程中体系的pH;T—水解过程的绝对温度;pK—解离常数。
1.3.4 蛋白酶筛选试验
根据酶的专一性及规模化使用的现实可行性及成本确定试验用酶。选取中性蛋白酶、胰蛋白酶、碱性蛋白酶和木瓜蛋白酶作为备选用酶,在其最适酶解温度和pH的条件下,按照南极磷虾蛋白∶水(1 g∶20 mL),酶与底物比3 %,酶解时间4 h进行酶解,以南极磷虾蛋白酶解物的水解度为指标筛选蛋白酶。
1.3.5 单因素试验
根据蛋白酶筛选试验的结果,根据所选酶的最适pH开展单因素试验。南极磷虾蛋白与水之比为1 g∶20 mL。各因素的水平梯度为:酶与底物比分别为2.5%、3.0%、3.5%和4.0 %,温度分别为40 ℃、45 ℃、50 ℃和55 ℃,时间分别为2.5 h、3 h、4.0 h和4.5 h。
1.3.6 响应面试验
基于单因素试验的结果,采用Design-export软件的Box-Behnken设计,以南极磷虾蛋白的水解度为因变量,以温度(A)、酶与底物比(B)和时间(C)3个因素为自变量,研究因素水平对南极磷虾蛋白水解度的影响(表1)。

表1 响应面试验设计因素水平表
1.4 功能特性评价方法
1.4.1 吸水性(WAC)
100 mg/mL南极磷虾蛋白、南极磷虾蛋白酶解物溶液,室温下放置1 h后体积记为V1;离心(5 000 g、25 ℃、30 min),50 mL离心管倾斜45°保持10 min,倒出上清液,上清液体积记为V2。样品的吸水性采用每g样品吸收水的体积表示[10]。
WAC=(V1-V2)/W0
(4)
式中:WAC—吸水性,mL/g;V1—室温下放置1 h后体积,mL;V2—保持10 min,倒出上清液,上清液体积,mL;W0—样品质量,g。
1.4.2 吸油性(OAC)
称取 0.10 g南极磷虾蛋白、南极磷虾蛋白酶解物与1 mL大豆油,旋涡混匀 2 min,室温下放置30 min后体积记为V1;离心(13 600 g、25 ℃、10 min),50 mL离心管倾斜45度保持20 min,倒出上清液,上清液体积记为V2。样品的吸油性采用每g样品吸收油的体积表示[11]。
OAC=(V1-V2)/W0
(5)
式中:OAC—吸油性,mL/g;W0—样品质量,g。
1.4.3 乳化性指数(EAI)及乳化稳定性(ES)
称取1 mg/mL的南极磷虾蛋白、南极磷虾蛋白酶解物溶液30 mL和10 mL大豆油混合,体系的pH调整至7.0;室温均质1 min,静置15 min。从由乳浊液底部吸取50 μL液体,与5 mL、0.10 % SDS(十二烷基磺酸钠)(W/V)溶液充分混匀,以0.10 % SDS溶液作为空白。在波长500 nm处分别测定吸光度A0,A15。EAI和ESI计算公式[11]:
(6)
(7)
式中:XEAI—乳化性指数,m2/g ;XESI—乳化稳定性,%;0.25为油相体积分数;C—蛋白浓度,g/mL;Δt-静置时间(15 min),10 000是比色皿光径的换算数,2.303为经验常数;A0和A15为乳状液在0和15 min时,波长500 nm处的吸光值。
1.4.4 起泡性(FC)及泡沫稳定性(FS)
1 mg/mL的南极磷虾蛋白、南极磷虾蛋白酶解物溶液120 mL,采用1.00 mol/L盐酸和NaOH溶液分别溶液调节pH 7.0。吸取20 mL溶液以10 000 r/min均质1 min;将溶液倒入100 mL量筒,分别记录0、30 min时的泡沫体积V0和V30。分别按照下式计算起泡性(FC)和泡沫稳定性(FS)[11]。
(8)
(9)
式中:XFC—起泡性;XFS—泡沫稳定性;V0—0 min时泡沫体积;V30—30 min时泡沫体积。
1.5 数据处理
试验结果采用平均值±标准偏差表示,每个试验重复3次。采用Excel进行统计学分析。
2 结果与讨论
2.1 蛋白酶筛选试验结果
选取木瓜蛋白酶、碱性蛋白酶、中性蛋白酶和胰蛋白酶作为酶解用酶,以南极磷虾蛋白酶解物的水解度为评价指标,分别在其最适条件下对南极磷虾蛋白进行酶解(图1)。

图1 不同酶对南极磷虾蛋白水解度的影响
南极磷虾蛋白的木瓜蛋白酶酶解物水解度明显高于其他蛋白酶的酶解物,最大水解度为31.48 %;然后依次是碱性蛋白酶、胰蛋白酶和中性蛋白酶酶解物。木瓜蛋白酶是一种底物特异性内切酶,属巯基蛋白酶,作用位点广泛,已经用于多种蛋白酶解并获得功能特性较好的酶解产物[12]。因此,后续实验采用木瓜蛋白酶作为实验用酶。
2.2 单因素试验结果
2.2.1 酶解时间对南极磷虾蛋白酶解物水解度的影响
在酶与底物比3.5 %,酶解温度50 ℃,酶解时间分别为3.5、4、4.5、5和5.5 h的条件下,分别测定南极磷虾蛋白酶解物的水解度,以确定酶解时间对蛋白水解度的影响(图2)。
水解度随着反应的进行而提高,当达到某点后水解度增加变缓;此后,随着水解时间的延长,水解度保持相对稳定并呈下降趋势。分析原因可能是由于反应初期蛋白质在酶作用下,反应进程较快。在0~3.5 h时,水解度增加较快;反应4 h时水解度达到最大;此后,南极磷虾蛋白酶解反应进程减慢,宏观表现为蛋白水解度降低。此时南极磷虾蛋白的酶解过程处于一种动态平衡状态[13]。因此,考虑到实际操作的可行性,酶解时间4 h较合适。
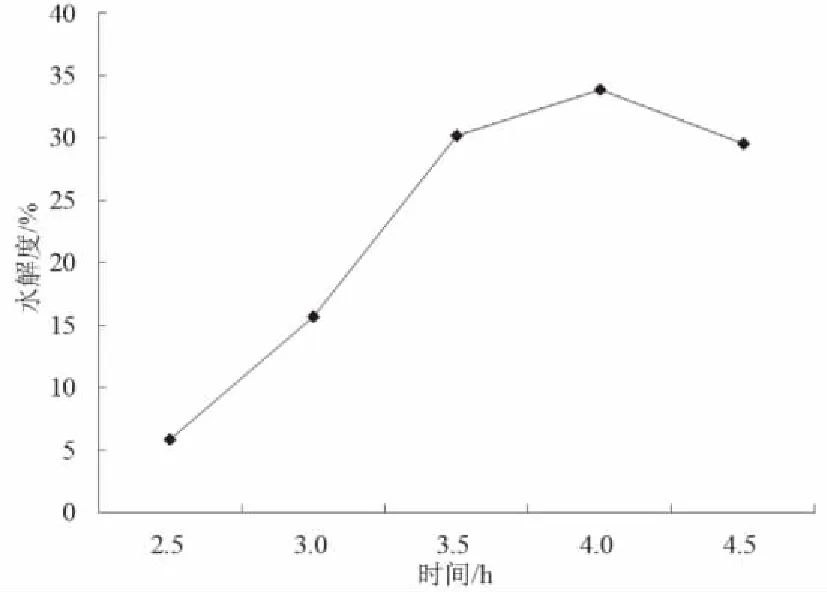
图2 酶解时间对南极磷虾蛋白水解度的影响
2.2.2 酶与底物比对南极磷虾蛋白酶解物水解度的影响
在酶解温度50 ℃,酶与底物比分别为2.5%、3.0%、3.5%和4.0%,酶解时间4 h的条件下,分别测定南极磷虾蛋白酶解物的水解度(图3)。水解度随着酶与底物比的增加而增加,酶与底物比在3.5%时水解度达到最大;此后,继续增加酶与底物比,水解度保持相对稳定并呈下降趋势[14]。此外,用酶量的增加并没有明显增加水解度但会提高生产成本。因此,综合考虑成本和实际生产需要,确定实验用酶与底物比为3.5%。

图3 酶与底物比对南极磷虾蛋白水解度的影响
2.2.3 酶解温度对南极磷虾蛋白酶解物水解度的影响
在酶与底物比3.5 %,酶解时间4.0 h,酶解温度分别为40 ℃、45 ℃、50 ℃、55 ℃和60 ℃的条件下,分别测定南极磷虾蛋白酶解物的水解度(图4)。由图4可知,最大水解度出现在50 ℃。酶解温度的升高会导致酶的变性失活、部分蛋白链断裂成水溶性的亚基或肽,宏观表现水解度降低。随着酶解温度的升高,水溶性的亚基或肽含量增加,抑制了南极磷虾蛋白酶解物的进一步水解[15]。因此,综合考虑实际情况,选择50 ℃作为最适酶解温度。

图4 酶解温度对南极磷虾蛋白水解度的影响
2.3 响应面结果分析
在单因素试验基础上,以A(酶解温度)、B(酶与底物比)和C(酶解时间)为自变量,以DH(南极磷虾蛋白水解度)为因变量,采用Design Expert软件的Box-Behnken设计进一步优化南极磷虾蛋白的酶解条件(结果见表2)。

表2 响应面试验设计与结果
利用Design-export 软件对表2的试验结果进行回归分析,获得酶解对南极磷虾蛋白水解度影响的回归模型:DH=32.34+1.80×A+1.28×B+1.40×C-0.20×A×B-0.35×A×C-0.45×B×C-2.75×A2-2.84×B2-2.54×C2。
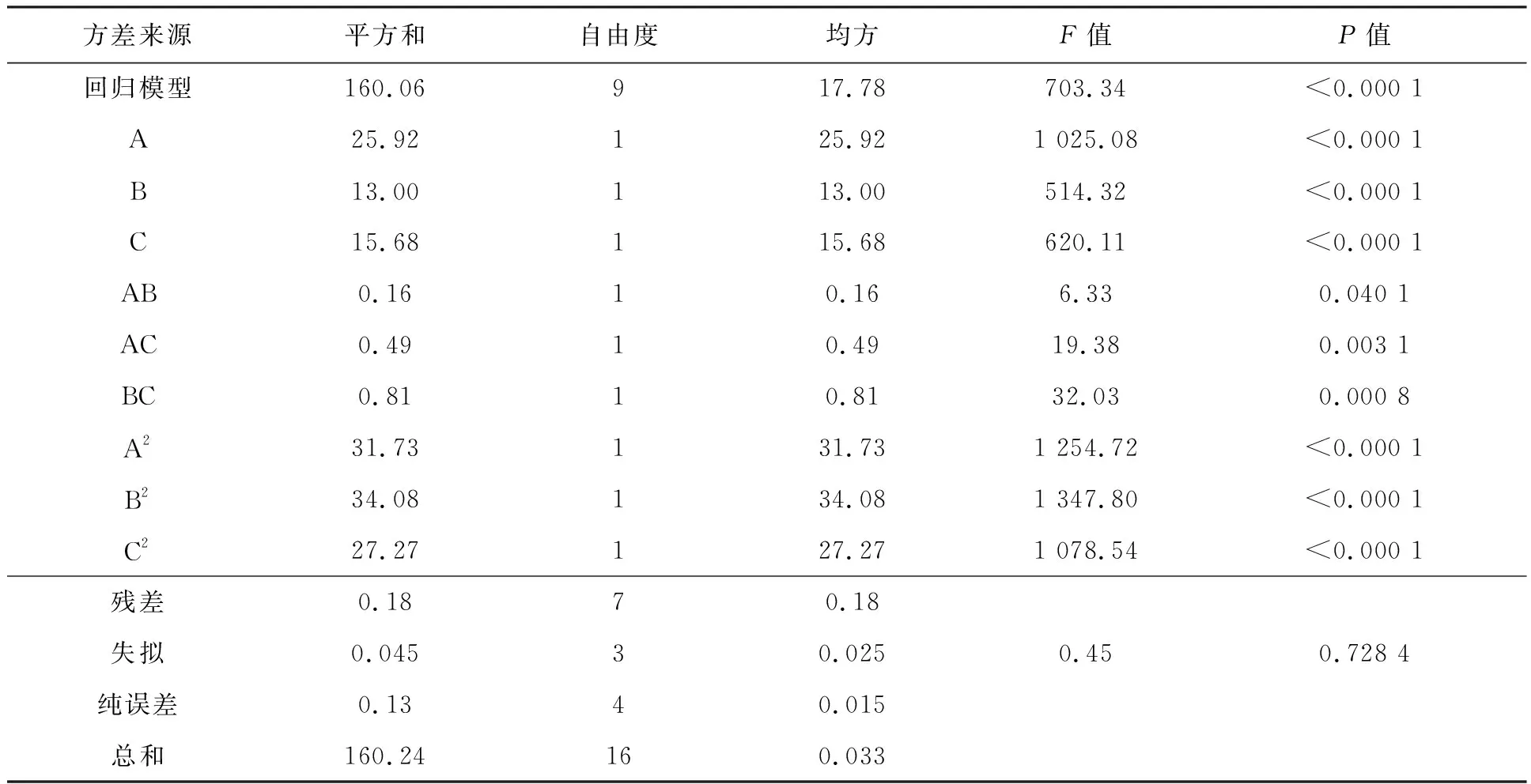
表3 回归方程的方差分析

由表3可以看出,在因素交互项中,温度与时间、温度和酶与底物比的交互作用最为显著,即此项交互作用对南极磷虾蛋白的水解度影响明显。根据回归方程,利用Design-export分析软件进行温度、酶与底物比、时间两两因子间的响应面分析图和等高线图,酶解南极磷虾蛋白时,温度、酶与底物比和时间之间交互作用对南极磷虾蛋白水解度的影响(图5)。
研究表明,响应面分析的等高线与响应面图能够直观深入地反映自变量之间的交互作用。椭圆形等高线表示两种自变量交互作用显著,而圆形等高线则表示两种自变量交互作用不显著。从图5可以看出,温度与酶与底物比和酶与底物比与时间之间交互作用非常显著,直观表现为等高线图为椭圆形,优化条件下酶解南极磷虾蛋白水解度的结果为:温度49.86 ℃,酶与底物比3.41%,时间4.03 h。
2.4 模型验证试验
为了检验所得回归方程的合理性和有效性,在实验因素水平范围内对该回归方程进行验证。该回归方程在实验范围内获得的木瓜蛋白酶酶解南极磷虾蛋白的最佳工艺为:酶与底物比3.41 %、时间4.03 h、温度49.86 ℃;此条件下南极磷虾蛋白水解度的预测值为32.40 %。考虑现实操作的可行性,优化南极磷虾蛋白的最佳酶解工艺:酶与底物比3.4 %、时间4.0 h、温度50 ℃,优化条件下进行3次平行验证试验,实际测得的水解度为(32.12 ± 1.46) %,与预测值的误差为0.87 %。结果表明该回归方程在一定范围内能够有效预测木瓜蛋白酶酶解南极磷虾蛋白的水解度。

图5 交互作用对南极磷虾蛋白酶解物水解度影响的响应面图和等高线图
2.5 酶解对南极磷虾蛋白功能特性的影响
从南极磷虾蛋白酶解物的功能特性结果(表6)可知,南极磷虾蛋白酶解物的吸水性、泡沫稳定性和乳化性等较南极磷虾蛋白明显增强,酶解南极磷虾蛋白的吸油性和起泡性下降。食品蛋白的乳化性和溶解性之间通常呈正相关关系[16]。研究表明,随着蛋白水解度的提高,酶解产物的吸水性、起泡性和泡沫稳定性增加。但过度的水解反应也会导致蛋白分子间会出现强烈的交联作用,会降低蛋白表面黏度,导致吸油性、泡沫稳定性、乳化性和乳化稳定性的下降[17-20]。因此,应该根据不同的应用领域对南极磷虾蛋白的水解度进行靶向性控制,实现南极磷虾蛋白的特定功能特性最优化。
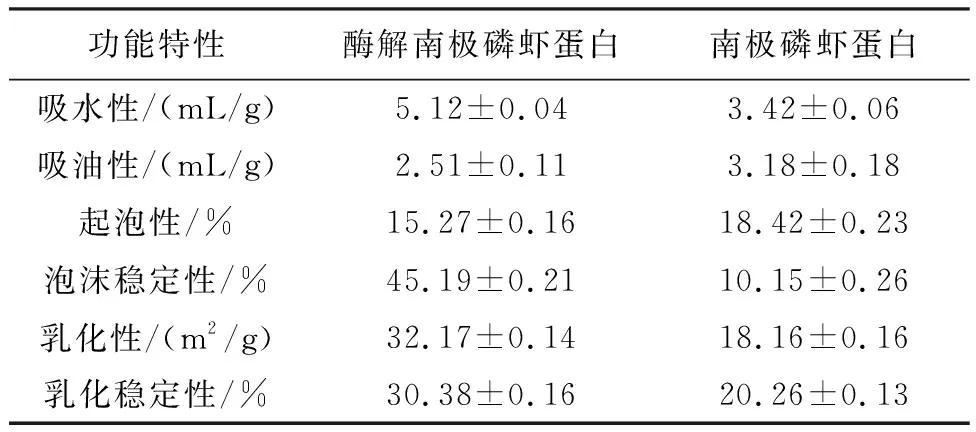
表6 酶解对南极磷虾蛋白功能特性的影响
3 结论
以南极磷虾蛋白酶解物的水解度为评价指标,筛选确定木瓜蛋白酶作为实验用酶;基于单因素试验和响应面试验优化南极磷虾蛋白的最适酶解条件:酶与底物比为3.41 %、时间为4.03 h、温度为49.86 ℃,构建了水解度预测回归方程。考虑到实际操作的可行性,确定实验条件下木瓜蛋白酶酶解南极磷虾蛋白的最优工艺为:酶与底物比为3.4 %、酶解时间4.0 h、酶解温度50 ℃。在此条件下南极磷虾蛋白酶解物的预测水解度最高(32.40 %),与验证值(32.12 %)具有较好的一致性。南极磷虾蛋白及其酶解物的功能特性评价结果表明,酶解能改善南极磷虾蛋白的功能特性,有助于南极磷虾蛋白附加值的提升和应用领域的拓展。
□
