肝癌患者肝移植术后感染病原菌的流行特征及相关因素分析
2018-12-28胥萍瑶张为利赖巍张忠伟吴思颖刘雅康梅
胥萍瑶,张为利,赖巍,张忠伟,吴思颖,刘雅,康梅
610041成都,四川大学华西医院 实验医学科临床微生物室(胥萍瑶、张为利、吴思颖、刘雅、康梅);610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 检验科(胥萍瑶);610041成都,四川大学华西医院 重症医学科(赖巍、张忠伟)
近年来,肝移植已成功应用于多种终末期肝脏疾病,包括肝脏恶性肿瘤、急慢性肝功能衰竭及先天性代谢性疾病等。随着对排斥反应认识的不断加深,外科手术技术的不断发展,以及围手术期护理的逐渐完善,手术的成功率得到极大提高。但由于肝移植患者全身情况较差,抗感染能力弱,术前长期存在免疫功能缺陷或肝功能损害,加之肝移植手术时间较长,术后病人需要长期使用免疫抑制剂、糖皮质激素,使得感染成为影响患者预后的主要原因[1-2]。为研究肝癌患者肝移植术后感染的流行病学特征及其相关因素,现收集2010~2016年在华西医院接受肝移植手术的肝癌患者相关资料进行回顾性分析,现报道如下:
1 资料与方法
1.1 一般资料
采用回顾性分析的方法收集2010~2016年因肝脏恶性肿瘤在华西医院进行肝移植病例244例,排除术前已合并感染且尚未治愈,术后一月内因非感染因素死亡,术后出现其他严重并发症自动放弃治疗患者,共收集到完整病例222例。其中,男194例,女28例。年龄分布1~72岁,平均年龄(48.2±10.3)岁。原发性疾病包括原发性肝癌212例,肝内胆管癌8例,肝母细胞瘤1例,肝脏多发上皮样血管内皮细胞瘤(低-中度恶性)1例。
1.2 感染分组
依据卫生部颁布的《医院感染诊断标准(试行)》(2001年),结合患者全身及局部症状及体征,痰液、血液、腹水及其他体液、分泌物培养结果,实验室感染监测指标[c反应蛋白(c-reaction protein,CRP)、降钙素原(procalcitonin,PCT)等]及影像学检查结果进行综合判断,将222例肝移植病例分为对照组(162例)和感染组(60例),其中对照组男145人,女17人,感染组男49人,女11人。
1.3 标本及菌株来源
60例感染组患者术后送检包括痰液、血液、尿液、胆汁、腹腔引流液等各种形式标本,剔除一周内同病人同部位分离出的相同菌种,共分离出病原菌126株,进行常规细菌鉴定及药敏试验。
1.4 细菌鉴定、药敏试验及其质量控制
采用法国梅里埃Vitek Compact全自动细菌鉴定和药敏仪进行细菌鉴定及药敏试验,补充药敏试验采用KB法,抗生素纸片来源于英国Oxoid公司。药敏试验结果按照美国2016年版CLSI标准[3]进行判定。涉及的质控菌株包括:大肠埃希菌ATCC25922,金黄色葡萄球菌ATCC25923,铜绿假单胞菌ATCC27853,粪肠球菌ATCC29212。
1.5 统计学变量及统计方法
根据现有资料,选取性别、年龄、住院时间及术前白蛋白水平、凝血酶原时间(prothrombin time,PT)、终末期肝病模型评分(model for end-stage liver disease,MELD)[4]进行两组间比较。采用SPSS 21统计学软件,进行独立样本t检验、非参数检验、卡方检验及Logistic回归分析。
2 结 果
2.1 感染情况
222例患者术后有60人共出现125例次感染,感染率为27.03%(60/222),平均每个病人出现(2.08±1.45)次感染,且感染多发生在术后4周内(58.9%)。病原菌主要来源于呼吸道,占比50.4%,其次是腹腔感染和血流感染,分别占比17.6%、16.8%。感染病原菌分析提示,单一病原菌感染29人(48.3%),两种及两种以上病原菌混合感染31人(51.7%),5例患者混合真菌感染;从感染部位分析,单一部位感染23人(38.3%),多部位感染37人(61.7%)。常见病原菌分布见表1。
表1病原菌的来源分布
Table1.SourcesofPathogens
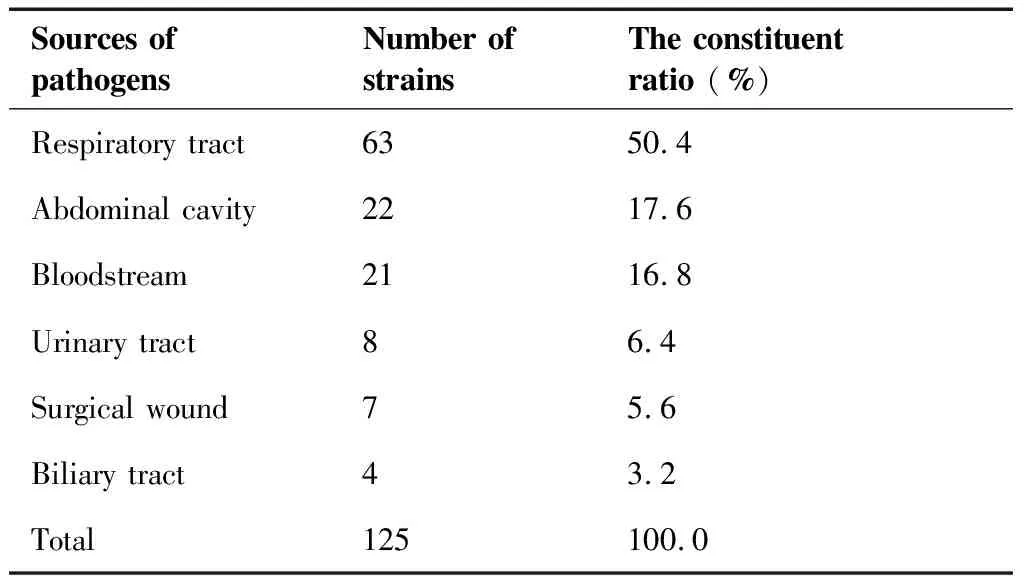
Sources of pathogensNumber of strainsThe constituent ratio (%)Respiratory tract6350.4Abdominal cavity2217.6Bloodstream2116.8Urinary tract86.4Surgical wound75.6Biliary tract43.2Total 125100.0
2.2 感染因素分析
经独立样本t检验及非参数检验,提示感染组住院时间、术前PT值及MELD高于对照组,差异有统计学意义(P<0.05)。而卡方检验显示两组性别构成差异无统计学意义(P>0.05)。将单因素差异有统计学意义的指标纳入多因素Logistic回归分析,显示住院时间(P<0.01)是引起术后感染的主要危险因素。详见表2、3。
表2移植术后感染危险因素单因素分析
Table2.Uni-variateAnalysisofRiskFactorsforInfectionafterLiverTransplantation
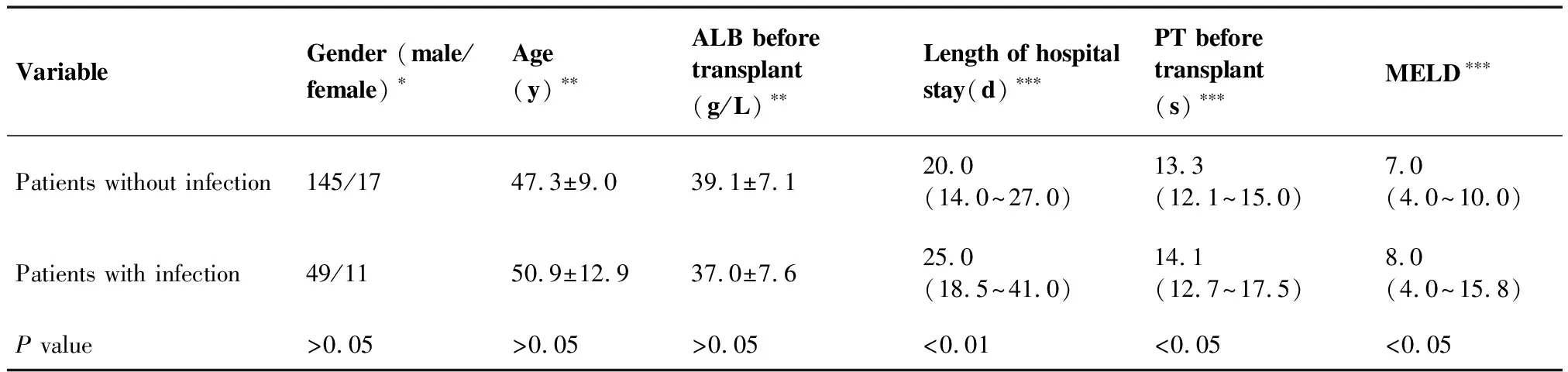
Variable Gender (male/female)∗Age (y)∗∗ALB before transplant (g/L)∗∗Length of hospital stay(d)∗∗∗PT before transplant(s)∗∗∗MELD∗∗∗Patients without infection145/1747.3±9.039.1±7.120.0(14.0~27.0)13.3(12.1~15.0)7.0(4.0~10.0)Patients with infection49/1150.9±12.937.0±7.625.0(18.5~41.0)14.1(12.7~17.5)8.0(4.0~15.8)P value>0.05>0.05>0.05<0.01<0.05<0.05
*Measurement variables are presented as number,Pvalues are calculated with the Chi-square test.
**When data are in accordance with the normal distribution,t-test is applied to independent samples to compare the differences. These variables are expressed as mean values±SD.
***Data, which is not in accordance with the normal distribution, are presented as the median (M), the upper quartile (Q25) and the lower quartile (Q75).Pvalues are calculated with non-parametricUtest.
ALB: albumin; PT: prothrombin time; MELD: model for end-stage liver disease
表3移植术后感染多因素回归分析
Table3.MultivariateAnalysisofRiskFactorsforInfectionafterLiverTransplantation

VariableβSEWalsP ValueLength of hospital stay0.0480.01314.628<0.01PT0.0110.0820.018>0.05MELD0.0190.0460.177>0.05
PT:prothrombin time; MELD:model for end-stage liver disease
2.3 病原菌分布
共分离126株病原菌,以革兰阴性杆菌为主,占比75.4%(95/126),其次为革兰阳性球菌,占比20.6%(26/126),共分离出5株真菌,占比4.0%。前5位细菌分别为鲍曼不动杆菌、肺炎克雷伯菌、屎肠球菌、大肠埃希菌和铜绿假单胞菌,分别占26.2%、14.3%、12.7%、9.5%、9.5%。5株真菌中包括2例白色念珠菌,1例分离自手术切口,1例分离自尿液标本;1例热带念珠菌,1例近平滑念珠菌和1例烟曲霉菌,分别来自于腹水、血液和痰液(表4)。呼吸道感染主要病原菌为鲍曼不动杆菌、肺炎克雷伯菌、铜绿假单胞菌,分别占比39.7%、15.9%、14.3%;腹腔感染常见病原菌为屎肠球菌(31.8%)和鲍曼不动杆菌(18.2%);而屎肠球菌(23.8%)、肺炎克雷伯菌(19.0%)及头状葡萄球菌(9.5%)位列血流感染病原菌前3位(表5)。
表4移植术后感染病原菌总体分布
Table4.DistributionofPathogensforInfectionafterTransplantation

MicroorganismsNumber of strainsThe constituent ratio(%)Gram-negative bacilli75.4 Acinetobacter baumannii3326.2 Klebsiella pneumoniae1814.3 Escherichia coli129.5 Pseudomonas aeruginosa129.5 Stenotrophomonas maltophilia43.2 Enterobacter aerogenes21.6 Enterobacter cloacae21.6 Serratia marcescens21.6 Others107.9Gram-positive bacilli20.6 Enterococcus faecium1612.7 Staphylococcus aureus21.6 Staphylococcus capitis21.6 Others64.8Fungi4.0 Candida albicans21.6 Candida parapsilosis10.8 Aspergillus fumigatus10.8 Candida tropicalis10.8Total126100
表5常见感染部位病原菌分布
Table5.DistributionofPathogensinCommonSitesofInfection

Site of infection MicroorganismsNumber of strainsThe constituent ratio(%)Respiratory tractAcinetobacter baumannii2539.7Klebsiella pneumoniae1015.9Pseudomonas aeruginosa914.3Escherichia coli69.5

Site of infection MicroorganismsNumber of strainsThe constituent ratio(%)Stenotrophomonas malto-philia34.8Others1015.9Total63100AbdominalcavityEnterococcus faecium731.8Acinetobacter baumannii418.2Escherichia coli29.1Pseudomonas aeruginosa29.1klebsiella pneumoniae29.1Others522.7Total22100BloodstreamEnterococcus faecium523.8Klebsiella pneumoniae419.0Staphylococcus capitis29.5Others1047.6Total21100Urinary tractEnterococcus faecium337.5Acinetobacter baumannii225Escherichia coli225Others112.5Total8100
2.4 主要病原菌耐药率
对分离率占前5位的细菌进行耐药率统计,具体情况见表6、7。
共分离到多重耐药鲍曼不动杆菌29株,占比87.9%;分离出产超广谱B-内酰胺酶(extended-spectrum β-lactamases,ESBL)的肺炎克雷伯菌共12株,占比66.7%,非ESBL肺炎克雷伯菌共6株,其中3株来自于血液标本,2株来自痰液,1株来源于手术切口。共分离出1株肺炎克雷伯菌对亚胺培南、美罗培南耐药,耐药率为5.6%;ESBL大肠埃希菌感染8例,占比66.7%,4株非ESBL大肠埃希菌分别来自于痰液(2株)、手术切口(1株)和腹水标本(1株),未分离出耐碳青霉烯类大肠埃希菌。多重耐药的铜绿假单胞菌(CR-PA)共6株,占比50%。
革兰阳性球菌中,屎肠球菌16株,占比61.5%,未分离出对万古霉素、利奈唑胺和替加环素耐药的屎肠球菌。2株金黄色葡萄球菌均为甲氧西林耐药株(methicillin-resistant stphylococcus aureus,MRSA),分别分离自血液和腹水。
表6主要革兰阴性杆菌对临床常见抗生素耐药率(%)
Table6.ResistanceRatesofMajorGram-negativeBacteriatoClinicallyUsedAntimicrobialAgents(%)

Antimicrobial agentsAcinetobacter baumannii (33)Klebsiellapneumoniae (18)Escherichia Coli (12)Pseudomonas aeruginosa (12)NR(%)NR(%)NR(%)NR(%)Ampicillin/sulbactam2479.21526.7850--Amikacin3050170120128.3Ciprofloxacin3387.9--1258.31225Cefepime3387.91844.412501216.7Gentamicin3384.81866.71136.4128.3Levofloxacin3363.61838.91163.61216.7Imipenem3387.9185.61101250Meropenem3387.9185.61101250Compound sulfamethoxazole3259.4--1163.6--Cefotaxime209516751080--Ceftazidime2788.91643.810501118.2Tobramycin3375.81822.21127.3128.3Piperacillin tazobactam2788.9175.9119.11127.3Cefoperazone sulbactam2343.5------Tigecycline2114.3------Polymyxin190------Minocycline1631.3------
R:number of strains; R:resistance rate
表7屎肠球菌对临床常见抗生素耐药率(%)
Table7.ResistanceRatesofEnterococcusfaeciumtoClinicallyUsedAntimicrobialAgents(%)

Antimicrobial agentsEnterococcus faecium (16)NR(%)Ciprofloxacin16100Ampicillin16100Erythromycin1687.5Linezolid160Moxifloxacin16100Penicillin16100Quinupristin/Dalfopristin1612.5Tetracycline1637.5Vancomycin160Nitrofurantoin1662.5Tigecycline160Levofloxacin16100Gentamicin(high concentration)1656.3Streptomycin(high concentration)1662.5
R:number of strains; R:resistance rate
3 讨 论
本研究显示,肝移植术后感染率为27.03%,与国内报道的20%~70%感染率相似[5-6],但低于国外Kim等[7]相关报告,其研究表明肝移植术后感染率高达37%~66%。原因可能为本研究选择的研究群体是肝脏恶性肿瘤患者,而国外大多数文献其研究群体基础疾病除了肝癌,还包括肝硬化、代谢性疾病、急慢性肝功能衰竭等,有基础疾病谱的差异。文献显示,肝移植术后感染可发生在术后任何时期,但在术后第1个月发生率最高[8-9]。本研究中,58.9%的感染发生在术后4周内,与报道吻合。提示加强预防术后早期感染相关措施,围手术期合理使用抗生素,以及注重早期感染监测应作为术后管理重点措施。
对肝移植术后感染的危险因素分析结果提示:患者住院天数、术前PT水平及MELD是患者术后感染的危险因素(P<0.05),而病人年龄、性别及术前白蛋白水平与感染无关。PT在一定程度上能反映患者术前肝功能水平,而MELD评分与患者血胆红素、血肌酐、国际标准化比率及病因相关,是患者术前状态的综合反映。另一方面,患者住院天数,尤其是在ICU住院天数增加,以及气管插管、机械通气等有创操作均增加肝移植术后感染风险[10]。其他研究[11]提示感染相关因素还有:术前抗菌药物使用情况、免疫抑制剂使用情况、术后呼吸机使用时间、ICU住院天数、白蛋白用量、腹腔出血量、血糖水平和预防感染用药天数等。可通过预防和控制这些因素来有效降低肝移植术后感染率;本研究尚未对感染组和对照组进行生存曲线分析,因此无法评价感染是否影响肝癌肝移植患者的术后生存期,在进一步研究将加以分析。
从菌种的来源和分布上看,收集到的126株病原菌主要来源于呼吸道(50.4%),与国内史宪杰等研究结果一致[12],其次是腹腔和血液,分别占比17.6%、16.8%。本组资料中,术后感染的病原菌仍以革兰阴性杆菌为主,占75.4%,其次是革兰阳性球菌(20.6%)与真菌(4.0%),分离率占前5位的细菌是鲍曼不动杆菌、肺炎克雷伯菌、屎肠球菌、大肠埃希菌和铜绿假单胞菌,分别占26.2%、14.3%、12.7%、9.5%、9.5%,与张莹等[13]相关研究一致。排名靠前的病原菌均为院内感染常见的条件致病菌,这可能与患者自身免疫低下,免疫抑制剂的使用及医院环境相关。肝移植手术本身对患者免疫力影响较大,加之整个围手术期患者都要使用大量免疫抑制剂,使得院内机会性感染增多。
肺部感染前5位细菌分别是鲍曼不动杆菌、肺炎克雷伯菌、铜绿假单胞菌、大肠埃希菌及嗜麦芽窄食单胞菌,均为革兰阴性杆菌,可能与手术时间较长,术后排痰困难,免疫抑制,呼吸机的使用及营养不良相关[7]。因此,严控呼吸机使用时间,严格落实院感消毒措施,加强手卫生有利于有效预防术后肺部感染。一旦出现术后细菌性肺炎,提示临床应选用主要针对革兰阴性杆菌的抗菌素以提高疗效,缩短病程。腹腔感染是继肺部感染后最为常见的感染部位,有报道显示肝移植术后腹部感染率高达27%~47%[8]。本文中腹腔感染以屎肠球菌为主,其次是鲍曼不动杆菌及其他革兰阴性杆菌,感染因素可能与肠道粘膜屏障受损,菌群易位,合并肠瘘、腹腔出血,血液透析及再次手术有关[14]。临床可表现为发热、腹痛、白细胞上升,术后出现腹膜炎、腹腔脓肿等,结合B超、CT及细菌培养有利于腹腔感染的早期诊断,情况允许时应尽早拔除引流管,加强伤口护理及术后营养,有利于改善患者预后。本组资料显示,移植术后血流感染占到16.8%,略低于国外相关报道[15],常见感染菌为屎肠球菌、肺炎克雷伯菌等。 腹腔、呼吸道和胆道是菌血症常见的可能来源,尽早去除腹腔脓肿及相关感染病灶,及时拔除静脉置管及导尿管,结合药敏试验结果给予抗感染治疗是常用手段[16]。呼吸道、腹腔、血流感染的主要病原菌分布有所差异,提示不同部位病原菌的分布有一定倾向性,因此医生在抗生素选择上一定要基于感染部位的不同及药敏试验结果。研究中发现,无论革兰阴性杆菌还是革兰阳性球菌均存在多重耐药现象,与相关研究一致[17]。肝移植患者术后易发生深部真菌感染,多为混合感染,主要病原菌为念珠菌,其次为曲霉菌,致死率较高[8]。此次研究共分离出5株真菌,均为混合感染。
药敏结果显示,除了头孢哌酮/舒巴坦、替加环素、多粘菌素和米诺环素,鲍曼不动杆菌对临床绝大多数常用抗生素耐药率均高于50%,尤其对亚胺培南、美罗培南的耐药率高达87.9%,明显高于肿瘤患者中调查的相关数据[18],同时也高于四川地区平均水平[19]。而多粘菌素、替加环素对鲍曼不动杆菌显示出较高的抗菌活性。肠杆菌科中的肺炎克雷伯菌及大肠埃希菌对抗生素的敏感性要明显好于鲍曼不动杆菌,尤其是对碳青霉烯类抗生素的耐药性均低于6%;但其对三代头孢、喹诺酮类、氨基糖苷类抗生素显示出较高的耐药性,不容乐观。铜绿假单胞菌除对亚胺培南、美罗培南显示出较高耐药性外(50%),对其余临床常用抗生素敏感性尚好。原因一方面可能因为调查医院对碳青霉烯类抗生素使用较为广泛,提示临床在治疗非发酵菌感染时慎用碳青霉烯类抗生素;另一方面,本次研究分离的铜绿假单胞菌数量较少,不排除有统计学方面的偏倚,需要在今后的研究中进一步扩大样本量,降低偏倚。阳性球菌中,屎肠球菌对氨苄青霉素、红霉素和喹诺酮类均显示出极高的耐药性,但未分离出对万古霉素、利奈唑胺、替加环素耐药的肠球菌。
综上所述,肝癌患者肝移植术后感染率较高,感染主要集中在呼吸道、腹腔及血液系统,病原菌以革兰阴性杆菌为主,但常为混合感染,对临床常用抗生素表现为多重耐药。患者住院天数、PT水平及MELD与感染密切相关。因此,对感染相关因素的预防和控制,对早期感染的有效识别,病原菌的积极送检,对耐药菌株的正确判断及治疗对降低肝癌患者肝移植术后感染率至关重要。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
