元素及其化合物专项训练(A卷)
2018-12-28湖南省长沙县实验中学唐梓雲
■湖南省长沙县实验中学 唐梓雲
■湖南省辰溪县第二中学 蔡俊来
1.化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用。下列做法不正确的是( )。
A.研制开发燃料电池汽车,降低机动车尾气污染,某种程度可以减少PM2.5污染
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.铁强化酱油可通过膳食补充人体所需的铁元素
D.地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油成分与从石油中提取的柴油成分不同
2.化学反应中,反应物用量、浓度或反应条件不同可能对生成物产生影响。下列反应的生成物不受上述因素影响的是( )。
A.铜与硝酸反应
B.钠与氧气反应
C.氢气与氯气反应
D.氯化铝与氢氧化钠溶液反应
3.C、Si、S都是自然界中含量丰富的非金属元素,下列有关说法中正确的是( )。
A.三种元素在自然界中既有游离态又有化合态
B.元素的+4价氧化物都属于酸性氧化物,都能与碱反应而不能与任何酸反应
C.最低价的气态氢化物都具有还原性,易与O2发生反应
D.其最高价氧化物对应的水化物的酸性强弱:H2SO4>H2SiO3>H2CO3
4.下列各组物质,不能按a→b→c(“→”表示反应一步完成)关系转化的是( )。

选项 a b cA Al2O3 NaAlO2 Al(OH)3 B AlCl3 Al(OH)3 NaAlO2 C Al Al(OH)3 Al2O3 D MgCl2 Mg(OH)2 MgO
5.下列离子方程式正确的是( )。
①氯气与水反应:Cl2+H2O==2H++Cl-+ClO-
②氯气与氢氧化钠溶液反应:Cl2+2OH-==Cl-+ClO-+H2O
③浓盐酸与二氧化锰共热:MnO2+
④漂白粉溶液中通入少量的二氧化碳气体:Ca2++2ClO-+H2O+CO2==CaCO3↓+2HClO
A.①③ B.②④ C.②③ D.①④
6.从淡化海水中提取溴的流程如下:
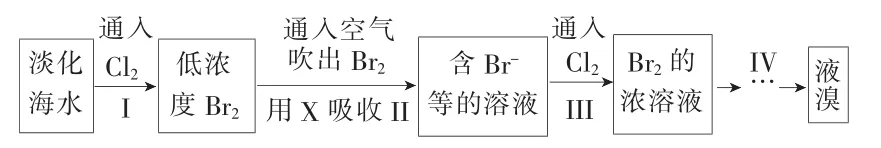
下列有关说法不正确的是( )。
A.X试剂可以为Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2==2Cl-+Br2
C.工业上每获得1 molBr2,需要消耗Cl244.8L
D.步骤Ⅳ包含萃取、分液和蒸馏
7.图1是检验气体性质的实验装置。向装置中缓慢通入气体X,若关闭活塞K,品红溶液无变化,澄清石灰水变浑浊;若打开活塞K,品红溶液褪色。据此判断,气体X和液体Y可能是( )。

图1
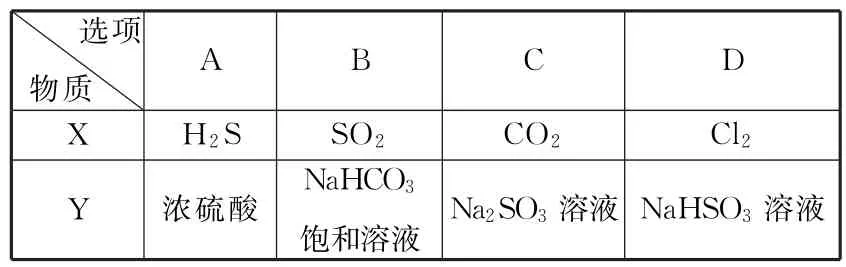
A B C DX H2S SO2 CO2 Cl2 Y 浓硫酸 NaHCO3饱和溶液 Na2SO3溶液 NaHSO3溶液
8.砷(As)及其化合物可用于制半导体材料及除草剂等。回答下列问题:
(1)砷是氮的同族元素,比氮多2个电子层,砷在周期表中的位置为第____周期第____族;AsH3的热稳定性比NH3________(填“强”或“弱”)。砷在自然界中丰度最大的核素的中子数为40,该核素为____(用元素符号表示)。
(2)砷化镓是常见的半导体材料,Ga与As同周期,Ga最外层有3个电子,砷化镓的化学式为____。
(3)某工业废水中含有少量的As2O3,向该废水中通入硫化氢可将其转化为更难溶的As2S3,该反应的化学方程式为____。
9.食用碱是人们生活中常用的食品疏松剂和肉类嫩化剂,其成分为纯碱和小苏打。甲、乙两位同学想根据高中阶段学习的知识设计实验,测定食用碱中小苏打的质量分数。
甲同学认为可以根据食用碱中两成分的热稳定性差异,利用加热前后的质量差求小苏打的质量分数。
(1)写出小苏打受热分解的化学方程式:____。
(2)甲同学的实验方案中需要使用的仪器有____(填字母)。
①三脚架 ②托盘天平 ③瓷坩埚④坩埚钳 ⑤泥三角 ⑥石棉网 ⑦烧杯⑧蒸发皿 ⑨铁坩埚 ⑩干燥器 ⑪酒精灯
A.①②③④⑤⑥⑪ B.①②④⑤⑨⑩⑪
C.①②⑥⑦⑧⑪
(3)如果该食用碱在测定前已经受潮,则用甲同学的实验方案测得的NaHCO3的质量分数会____(填“偏大”“偏小”或“无影响”)。
乙同学设计了另一种实验方案来测定13.7g食用碱中NaHCO3的质量分数,其流程如下。

(4)操作Ⅱ的名称是____,最终称量的物质的化学式是____。
(5)如果最终称量固体质量为11.7g,则该食用碱中NaHCO3的质量分数为____。
10.工业上利用菱镁矿 MgCO3(含杂质Al2O3、FeCO3)制取镁的工艺流程如下。

回答有关问题:
(1)菱镁矿送入酸浸池前需要粉碎,目的是____。
(2)氧化池中通入氯气的目的是氧化____,工业上不选用硝酸作氧化剂的原因是____和____。
(3)沉淀混合物为____和____(填化学式)。
(4)利用熔融氯化镁制取金属镁,选用的方法是____(填字母)。
A.电解法 B.氢气还原法
C.碳还原法 D.分解法
11.图2是实验室制备氯气并进行一系列相关实验的装置(夹持装置已略)。

图2
(1)制备氯气选用的药品为漂粉精固体和浓盐酸,则相关反应的化学方程式为____。
(2)装置B中饱和食盐水的作用是____。同时装置B也是安全瓶,监测实验进行时装置C是否发生堵塞,请写出发生堵塞时装置B中的现象:____。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中Ⅰ、Ⅱ、Ⅲ处依次放入____(选填表1中字母选项)。

表1
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D装置中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为____色,说明氯的非金属性强于溴。
(5)打开活塞,将装置D中少量溶液加入装置E中,振荡后静置。观察到的现象是____。
