基础与素养并举 物质与应用交融
——以元素化合物知识复习为例
2018-12-28湖南省长沙县实验中学黄景华张水强
■湖南省长沙县实验中学 黄景华 张水强
最新的全国高考考试大纲明确指出:“了解常见金属元素(如 Na、Mg、Al、Fe、Cu等)和常见非金属元素(如 H、C、N、O、Si、S、Cl等)的单质及其重要化合物的制备方法,掌握其主要性质及其应用。”从近几年的高考试题看,元素化合物知识渗入到了大部分试题中,是实验类试题、工艺流程类试题,乃至化学反应原理类试题的载体和素材;从考查熟悉的物质悄悄地演变成考查陌生的物质,如近几年高考考查的陌生物质有H3BO3、LiFePO4、Na2S2O5、NaClO2、As2S3、As2O5、H3AsO3、H3AsO4、Na3AsO3等。这就要求我们复习时不仅要注意元素化合物基础知识的储备,更要注重从原子结构和元素周期律(表)等学科核心素养层面掌握其性质和应用。
一、诊断基础知识,促进有效落实
2016年高考全国Ⅰ卷第13题的题干中出现了“二元化合物”一词,2014年高考全国Ⅰ卷第27题中出现了“一元中强酸”“正盐”和“酸式盐”等词汇……在解析相关的高考试题时,有不少同学对试题中出现的这些学科专业词汇感到茫然。下面,把这些专业词汇逐一巩固。
1.厘清几个重要的学科专业词汇。
无机物:单质和无机化合物的统称。(摘自《现代汉语词典》)
二元化合物:由两种不同元素组成的化合物。
一元酸:一个酸分子最多只能电离出一个氢离子。(摘自“百度百科”)
中强酸:电离常数(Ka)在10-1~10-4之间的酸(pKa=1~4)。(摘自“百度百科”)
正盐:既不含能电离的氢离子,又不含氢氧根离子的盐。正盐只含金属阳离子(或NH+4)和酸根离子。正盐是酸和碱完全中和的产物,但正盐的水溶液不一定显中性。(摘自“百度文库”)
酸式盐:电离时产生的阳离子除金属离子(或NH+4)外还有氢离子,阴离子为酸根离子的盐。(摘自“百度文库”)
涉及到元素及其重要化合物推断的高考试题已屡见不鲜,解答好这类试题的前提是,能够根据题意准确地推断出相应的元素或者物质,这一般需要“调度”哪些基础知识呢?
2.梳理元素及其化合物推断的必备知识。
(1)理解常见单质及其重要化合物的转化关系。
①借助转化关系图,定性掌握物质的化学性质。《化学1·必修》的“金属及其化合物”和“非金属及其化合物”两章章末处的“归纳与整理”板块,都有常见单质及其重要化合物的转化关系图,这些图都比较充分地表现出了常见单质及其重要化合物的化学性质,落实好了,应用起来便能得心应手。
②构建定量关系,深入理解重要物质的化学性质。以典型的两性氢氧化物Al(OH)3为例,其电离过程为:
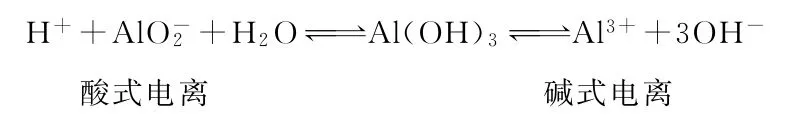
由此可见,Al(OH)3若作酸参加反应时,它是一元弱酸,Al(OH)3若作碱参加反应时,它是三元弱碱。据此便可建立如下定量关系:

可知1molAl3+与足量OH-作用时,最多消耗4molOH-。同理:

(2)了解渗透到有机化学中的一些无机物体现的性质和用途,以及化学反应。Cl2、Br2、Na、NaOH、Na2CO3、CO2、HNO3、H2SO4、H2S、CuSO4、NH3·H2O、AgNO3、KMnO4等无机物都在有机化学中有相关的应用,这其中当属 Br2、NaOH、H2SO4和KMnO4应用最为广泛。近几年的高考试题已经涉及这些方面,要引起关注。
(3)了解常见金属的活动顺序和常见非金属单质的活动顺序。常见金属活动顺序:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au;常见非金属单质活动顺序:F2>O2>Cl2>Br2>I2>S。识记这两个顺序关系,在进行比较、分析、推断一些物质时,往往能够提供有效的帮助,尤其是在跟氧化还原反应关联度特别大的“电化学基础”板块,更可大显其神功。
(4)彰显原子结构和元素周期律(表)对无机物的性质和用途的理论支撑。原子的结构决定了元素在周期表中的位置,也决定了元素的性质,借助“结构—位置—性质”三者的神秘关系,可比较顺利地进行元素的推断。同理,常见元素的单质及其重要化合物的结构,也决定了相应物质的物理性质和化学性质,进而决定了相应物质的用途等。利用这层关系推断(或判断)物质的性质和用途的高考试题早已层出不穷。
纵观近几年的高考试题,除了推断类型的试题,利用已经给定物质的性质分析问题,进而解决问题的试题也逐渐热起来了,如2017年高考全国Ⅰ卷第27题的第(3)小题和2018年高考北京卷第26题的第(4)小题都考查了同一个知识点——温度稍高时,因H2O2分解而使物质的转化率降低。
3.对应典型无机物的性质与用途,性质与基本实验操作。
H2O2可作氧化剂,但受热易分解;当H2O2遇到较强的氧化剂(如酸性KMnO4溶液)时,H2O2也可作还原剂。NH3·H2O不稳定,受热易分解。NH3易液化,液氨常用作制冷剂,这在2017年高考全国Ⅰ卷第12题考查了。HF可刻蚀玻璃,这在2018年高考全国Ⅰ卷第12题考查了。复习H2O2、NH3·H2O、液氨、HF、ClO2、SO2等典型无机物的性质时,注意跟其用途对应起来,在分析和解答问题时就不会有阻碍。
把无机物的性质与一些化学实验基本操作对应起来考查,也已经成为近年高考试题的新时尚,如2016年高考全国Ⅰ卷第26题第(1)小题的第②问,考查了吸收尾气中的NH3要选择那个倒扣漏斗的防倒吸装置,因为NH3极易溶于水;又如2018年高考天津卷第9题的第(3)小题,要求画出装有NaOH溶液的洗气瓶,用于吸收含有NOx的尾气。
会推断元素或者物质,也会用“对应”等方法分析和解决一些疑难问题了,还得学会用化学语言(如化学方程式等)进行规范表达,而这个前提是能够理解基本的化学方程式。
4.透析复分解反应和氧化还原反应两大类基本化学方程式。
就复分解反应而言,酸、碱、盐、氧化物之间的转化要求非常熟练,这在最新的高考考试大纲中也是“理解”的能力层次要求,从其中还可以深挖出“强酸制弱酸”“强碱制弱碱”和竞争反应等基本规律。
就氧化还原反应而言,首先,要熟悉常见元素的化合价,能根据化合价正确书写化学式(分子式),或根据化学式判断元素的化合价。其次,要了解常见的氧化还原反应,这当然也包括《化学·选修4》中的H2C2O4溶液与KMnO4酸性溶液作用,Na2S2O3溶液与稀硫酸作用等在近几年高考试题中已经频繁亮相的一些重要的氧化还原反应(前者出现在2015年高考全国Ⅱ卷第13题中,后者出现在2017年高考全国Ⅰ卷第12题中)。再次,要熟练掌握常见氧化还原反应方程式的配平和相关计算。
二、提升学科素养,促进思维发展
1.科学阅读,引发思考。
欲解答好试题,读懂题意,看清设问是前提,否则,要么因无法对题目引发思考而造成不会解题或者胡乱地解题,要么因曲解设问而导致解题时答非所问。培养主动去抓题干中和设问中的关键词的科学阅读能力,往往会带来三个方面的益处:其一是不会因答非所问等非智力因素而造成丢分;其二是对于难度不是很大的试题,往往能够借助几个显性的关键词而迅速架构好清晰的答题逻辑;其三是对于难度较大的试题,也需要借力一些关键词来引发思考(这是什么→为什么这样),甚至会将思维引向更深处(怎样做到的),进而一些被命题人隐藏的信息和知识将逐一暴露出来,这样就可以解答好试题。
例1次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:____。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中,P元素的化合价为____。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为____(填化学式)。
③NaH2PO2为____(填“正盐”或“酸式盐”),其溶液显____(填“弱酸性”“中性”或“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式:___。
解析:(1)其关键词是“一元酸”“中强酸”,一个H3PO2分子最多只能电离出一个H+,且将其视为弱酸,因此其电离方程式为,而且第(2)小题的第③问的NaH2PO2为正盐,其溶液显弱碱性。(2)只要熟悉常见的H元素和O元素的化合价,根据化学式H3PO2容易判断出其中P元素的化合价为+1;主题干明示了H3PO2有较强的还原性,与Ag+反应时,Ag+作氧化剂,还原产物为 Ag,H3PO2作还原剂,即,依据氧化还原反应方程式中得失电子守恒容易判断氧化产物中P元素的化合价为+5,氧化产物为H3PO4。(3)题干明示了该氧化还原反应中与电子转移直接相关的全部反应物和生成物,因此这实际上是在考查氧化还原反应方程式的配平。
答案:(1)
(2)①+1 ②H3PO4③正盐 弱碱性
(3)2P4+3Ba(OH)2+6H2O==3Ba(H2PO2)2+2PH3↑
2.学会读图,思路畅通。
涉及“图”的高考试题当下正盛行,主要表现为化学实验装置图、电化学工作原理图、坐标图像、图表和化学工艺流程图等形式,尤其是化学工艺流程图以大题的形式连续出现在了最近两年的高考试题中。训练并提高读图能力,方可确保解题思路畅通。
例2NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下。

回答下列问题:
(1)NaClO2中Cl的化合价为____。
(2)写出“反应”步骤中生成ClO2的化学方程式:___。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 Mg2+和Ca2+,要加入的试剂分别为____、____。“电解”中阴极反应的主要产物是____。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为____,该反应中氧化产物是____。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
解析:(1)略。(2)从工艺流程图可以看出,反应物是NaClO3、SO2和H2SO4,产物为ClO2和NaHSO4,根据得失电子守恒、原子守恒配平化学方程式:2NaClO3+SO2+H2SO4==2ClO2+2NaHSO4。(3)粗盐提纯中加入NaOH溶液沉淀Mg2+,加入Na2CO3溶液沉淀Ca2+。结合工艺流程图和氧化还原反应原理,电解过程中,Cl-(NaCl)在阳极放电得到Cl2,ClO2在阴极放电得到。(4)结合工艺流程图和题意,用含NaOH的H2O2溶液与ClO2作用,
答案:(1)+3 (2)2NaClO3+SO2+H2SO4==2ClO2+2NaHSO4(3)NaOH溶液 Na2CO3溶液(4)2∶1O2(5)1.57
3.创新思维,学会书写陌生情境方程式。
近些年的高考试题,更多的是要求能够在陌生的素材和情境中提炼出有价值的信息,结合已经积累的基础与经验,创新思维方式,快速准确地书写相应的方程式。
例3(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式:___。
(2)磷精矿湿法制备磷酸的一种工艺流程如下。

①H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间、不同温度下的有机碳脱除率如图1所示。80℃后脱除率变化的原因:___。

图1
②脱硫时,CaCO3稍过量,充分反应后仍
解析:(1)Na2S2O5是中学化学教材中从未出现过的陌生物质,但对题干稍加提炼,不难看出该化学方程式的反应物为NaHSO3,生成物为Na2S2O5和H2O,然后配平即可。
(2)①有机碳的脱除率受两个因素的共同影响:一方面,温度越高,反应速率越快,在相同投料比、相同反应时间内,有机碳的脱除率越高;另一方面,温度升高可使较多的H2O2分解,氧化剂的量减少,使得有机碳的脱除率降低。80℃后,H2O2分解对有机碳脱除率的影响超过了温度升高的影响,导致脱除率逐渐降低。
②从工艺流程图不难看出,脱硫是用CaCO3除去剩余的 H2SO4,由于生成的CaSO4是微溶物,所以即使CaCO3过量,充分反应后仍有残留。加入BaCO3,使CaSO4转化为更难溶的BaSO4,因此可进一步提高硫的脱除率。但要写出其离子方程式,思维需要不断地深入。首先,题干直接提及沉淀的转化,即;其次,H3PO4的酸性强于H2CO3,所以H3PO4会与继续反应产生H2CO3(但要写成“CO2+H2O”);再次,需要思考H3PO4与反应后的生成物是,还是呢,由于之前加入的“CaCO3稍过量”,相对而言,H3PO4的量远远大于的量,从而H3PO4反应后应该变成。经过这样深思熟虑,便可得出其离子方程式。
答案:(1)2NaHSO3==Na2S2O5+H2O
(2)①80℃后,H2O2分解速率大,浓度显著降低 ②CaSO4微溶
通过把脉元素化合物的基础知识,敦促自己有针对性地落实到位,并在解题训练中不断使自己的阅读能力、读图能力和书写新情境方程式的能力得到提升,这样在高考中才能够稳操胜券。
