p38蛋白激酶信号通路对骨桥蛋白介导的三阴性乳腺癌细胞自噬、凋亡活性的影响
2018-12-27翟晓建李伟汉
郭 满,翟晓建,张 浩,李伟汉,刘 明
(1.南阳市中心医院乳腺外科,河南 南阳 473003;2.新乡医学院研究生院,河南 新乡 453003)
乳腺癌发病率居女性恶性肿瘤首位,病死率居第2位[1]。三阴性乳腺癌是乳腺癌的一种亚型,指雌、孕激素受体和人表皮生长因子受体-2均为阴性的乳腺癌,具有恶性程度高、预后差等特性[2]。研究显示,骨桥蛋白(osteopontin,OPN)与乳腺癌增殖、迁移及放射治疗和化学治疗耐受有关,但其确切机制仍有待探索[3]。自噬在多种肿瘤中广泛存在,是调控肿瘤细胞命运的重要过程[4]。研究表明,Beclin 1蛋白参与自噬体的形成,是一种自噬特异性蛋白。本研究拟探讨OPN和自噬相关蛋白Beclin 1在三阴性乳腺癌组织中的表达意义,并建立OPN低表达三阴性乳腺癌细胞模型,探讨OPN下调对三阴性乳腺癌细胞自噬、凋亡活性的影响及其机制。
1 材料与方法
1.1标本来源选取南阳市中心医院2015年1月至2016年12月收治的60例女性三阴性乳腺癌患者的癌组织标本为研究对象,年龄27~61(45.0±7.6)岁;另选取同期手术治疗的40例女性乳腺纤维腺瘤或乳腺增生结节患者的正常乳腺组织作为对照,年龄21~64(41.0±10.3)岁。本研究经医院伦理委员会批准,且所有患者签署知情同意书。
1.2细胞、试剂与仪器MDA-MB-231细胞株购自中国科学院上海细胞生物学研究所;质粒pLVTHM、pCMV、pMD2G和cDNA反转录试剂盒购自美国Invitrogen公司,OPN、p38蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)、Beclin 1抗体购自美国Abcam公司,链霉菌亲和素-过氧化物酶链结(streptavidin-peroxidase conjugated,SP)免疫组织化学检测试剂盒购自上海鼎杰生物科技有限公司,SYBR Green 试剂盒购自德国Qiagen公司,反转录引物由上海生工生物股份有限公司合成;FACS440型流式细胞仪购自美国BD Biosciences公司,7500 型实时荧光定量聚合酶链反应(polymerase chain reaction,PCR)系统购自美国ABI公司,BOND-Max全自动免疫组织化学染色机购自德国Leica公司,H600透射电子显微镜购自日本日立公司。
1.3实验方法
1.3.1免疫组织化学检测乳腺癌组织和正常乳腺组织中OPN和Beclin1蛋白表达组织标本经100 g·L-1多聚甲醛固定,石蜡包埋,5 μm连续切片。石蜡切片经脱蜡、梯度水化后,置10 mmol·L-1枸橼酸缓冲液(pH6.0)中,热平台抗原修复3 min,凉至室温。然后按照SP试剂盒说明检测OPN和Beclin 1蛋白在乳腺癌组织和正常乳腺组织中的表达。采用双盲法随机选择连续10个高倍视野,每个视野计数100个肿瘤细胞,以阳性细胞所占百分比及染色程度进行结果判定。以细胞中出现黄色及棕黄色颗粒为阳性表达,按阳性细胞所占百分比评分,0分:阳性细胞百分比<10%;1分:10%≤阳性细胞百分比≤25%;2分:26%≤阳性细胞百分比≤50%;3分:阳性细胞百分比>50%。按染色深度评分:无染色为0分,淡黄色为1分,黄色为2分,棕黄色为3分。总分等于阳性细胞百分比和染色程度评分之和,0分为阴性(-);1~2分为弱阳性(+);3~4分为阳性(++);≥5分为强阳性(+ + +)。
1.3.2OPN基因敲除模型制备参照文献[5]所述方法制备OPN低表达MDA-MB-231细胞株。用含体积分数10% 胎牛血清的达尔伯克改良伊戈尔培养基培养MDA-MB-231细胞,置于37 ℃、含体积分数5%CO2的无菌培养箱中培养。当细胞密度至满视野的70%时,胰蛋白酶消化用于传代培养。将处于对数生长时期的MDA-MB-231细胞用胰蛋白酶消化,以每孔2×105个细胞接种于6孔板中,培养24 h,当细胞生长融合至80%时,将细胞分为特异性OPN小干扰RNA(small interfering RNA,siRNA)实验组(OPN-siRNA组)、非同源阴性CON-siRNA对照组(CON-siRNA组)和mock空白对照组(mock组)进行转染。采用酶切技术将OPN-siRNA序列(5′-CGAGTCAGCTGGATGACC-3′)和CON-siRNA序列(5′-ATTGCGTTCGCAG TAATCT-3′)两端嵌入Mlu I位/Cla I酶切位点重组到pLVTHM载体,将混合质粒转染至293T细胞,培养获得所需siRNA慢病毒,并浓缩滴度至5×1010pfu·L-1。采用CON-siRNA 和OPN-siRNA慢病毒分别感染MDA-MB-231细胞,mock组细胞只加转染试剂,48 h后应用实时荧光定量PCR技术和Western blot法检测OPN基因敲除效果。
1.3.3实时荧光定量PCR检测各组细胞中OPN、p38MAPK、Beclin1mRNA的表达转染病毒48 h后用mRNA提取试剂盒提取各组细胞总RNA,用反转录PCR试剂盒进行反转录。用实时荧光定量PCR系统试剂盒进行cDNA扩增。荧光定量PCR扩增条件:95 ℃ 10 min;95 ℃ 15 s、60 ℃ 45 s,40个循环。使用2-ΔΔCt法参照甘油醛-3-磷酸脱氢酶(glyceraldehyde3-phosphate dehydrogenase,GAPDH)定义产物相对量。OPN上游引物序列:5′-TCCAACGAAAGCCATGACCA-3′,下游引物序列:5′-CTGTGGGGACAACTGGAGTG-3′,扩增片段长度226 bp;p38 MAPK上游引物序列:5′-CCCGAACGATACCAGAACC-3′,下游引物序列:5′-GCGTGAATGATGGACTGAAA-3′,扩增片段长度135 bp;Beclin 1 上游引物序列:5′-GGCTGAGAGACTGGATCAGG-3′,下游引物序列:5′-CTGCGTCTGGGCATAACG-3′,扩增片段长度127 bp;GAPDH上游引物序列:5′-CACCATCTTCCAGGAGCGAG-3′,下游引物序列:5′-AGAGGGGGCAGAGATGATGA-3′,扩增片段长度154 bp。
1.3.4Westernblot检测各组细胞中OPN、p38MAPK、Beclin1蛋白表达转染48 h后用全细胞蛋白提取试剂盒提取各组细胞总蛋白,二喹啉甲酸法测定蛋白浓度,然后依次进行电泳、转膜、封闭,一抗、二抗孵育,最后电化学发光法显影。免疫反应带采用Image J分析软件参照β-actin进行量化。抗OPN、抗p38MAPK、抗Beclin 1的稀释浓度均为11 000,抗β-actin的稀释浓度为1500。
1.3.5透射电镜技术观察各组细胞自噬体形成情况病毒转染48 h后调整3组细胞密度为 2×108L-1,体积分数1%戊二醛溶液固定2 h,体积分数1%锇酸固定1 h,丙酮梯度脱水[6]、浸透、包埋和切片,切片厚度约60 nm,超薄切片用醋酸铀溶液染20 min,铅染液处理5~6 min,透射电镜观察细胞自噬体形成情况。自噬体特征:新月状或杯状双层或多层膜结构,存在包绕细胞质成分的现象。采用双盲法随机选取连续10个高倍视野(×1 000),计数每个视野中的自噬体个数,取均数。
1.3.6流式细胞术检测各组细胞凋亡情况病毒转染48 h后调整3组细胞密度为2×108L-1。取 1 mL 细胞悬液,于4 ℃下1 000 r·min-1离心 10 min,弃上清液。加入1 mL冷的磷酸盐缓冲液(phosphate buffered solation,PBS),轻轻震荡使细胞悬浮,于4 ℃下1 000 r·min-1离心10 min,弃上清液。对于贴壁细胞,先用胰蛋白酶消化,再用PBS洗涤。将细胞重悬于200 μL Binding Buffer。加入10 μL AnnexinV-异硫氰酸荧光素 (fluorescein isothiocyanate,FITC),轻轻混匀,避光室温反应15 min或4 ℃反应30 min。加入300 mL Binding Buffer,再加入 5 μL 碘化丙啶(propidium iodide,PI),使用流式细胞仪在488 nm的氩离子激光下进行检测。

2 结果
2.1OPN和Beclin1蛋白在三阴性乳腺癌组织及正常乳腺组织中的表达免疫组织化学染色结果显示,OPN蛋白阳性表达呈淡黄或棕黄色,定位于细胞质(图1)。OPN蛋白在乳腺癌组织和正常乳腺组织中的阳性表达率分别为68.3%(41/60)和12.5%(5/40),OPN蛋白在乳腺癌组织中的阳性表达率高于正常乳腺组织,差异有统计学意义(χ2=56.881,P=0.000)。Beclin 1蛋白表达主要见于细胞质,强阳性时细胞膜亦可见表达(图2)。Beclin 1蛋白在乳腺癌组织和正常乳腺组织中的阳性表达率分别为18.3%(11/60)和42.5%(17/40),Beclin 1蛋白在乳腺癌组织中的阳性表达率低于正常乳腺组织,差异有统计学意义(χ2=54.692,P=0.000)。Spearman相关性分析结果显示,三阴性乳腺癌组织中OPN和Beclin 1表达呈负相关(r=-0.713,P=0.003)。
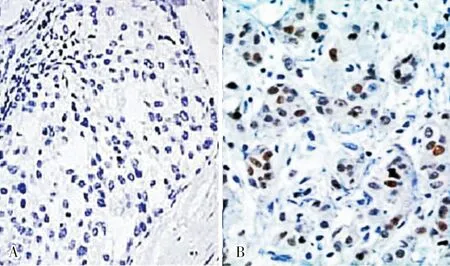
A:正常乳腺组织;B:乳腺癌组织。
图1OPN蛋白在三阴性乳腺癌组织和正常乳腺组织中的表达(SP,×100)
Fig.1ExpressionofOPNproteinintriplenegativebreastcancerandnormalbreasttissues(SP,×100)

A:正常乳腺组织;B:乳腺癌组织。
图2Beclin1蛋白在三阴性乳腺癌组织和正常乳腺组织中的表达(SP,×100)
Fig.2ExpressionofBeclin1proteinintriplenegativebreastcancerandnormalbreasttissues(SP,×100)
2.2MDA-MB-231细胞OPN敲除效果病毒转染48 h后,OPN-siRNA组、CON-siRNA组、mock组细胞中OPN mRNA相对表达量分别为0.31±0.08、0.99±0.05和1.10±0.10,OPN-siRNA组OPN mRNA 相对表达量显著低于CON-siRNA组和mock组,差异有统计学意义(F=57.170,P=0.001),CON-siRNA组与mock组细胞中OPN mRNA相对表达量比较差异无统计学意义(P=0.537)。病毒转染 48 h 后,OPN-siRNA组、CON-siRNA组、mock组细胞中OPN蛋白相对表达量分别为0.35±0.06、0.97±0.07和1.03±0.10,OPN-siRNA组细胞中OPN 蛋白表达显著低于CON-siRNA组和mock组,差异有统计学意义(F=50.410,P=0.001),CON-siRNA 组与mock组细胞中OPN蛋白相对表达量比较差异无统计学意义(P=0.613);见图3。结果证实构建的OPN-siRNA对MDA-MB-231细胞OPN表达具有良好的抑制效果。

图3OPN表达敲除效果鉴定
Fig.3IdentificationofknockouteffectofOPNexpression
2.3OPN下调后自噬体形成情况结果见图4。OPN-siRNA组、CON-siRNA组、mock组细胞中自噬体个数分别为6.50±1.43、2.40±1.35和2.90±1.66,OPN-siRNA组细胞中自噬体个数显著高于CON-siRNA组和mock组,差异有统计学意义(F=17.590,P=0.004);CON-siRNA组与mock组细胞中自噬体个数比较差异无统计学意义(P=0.459)。
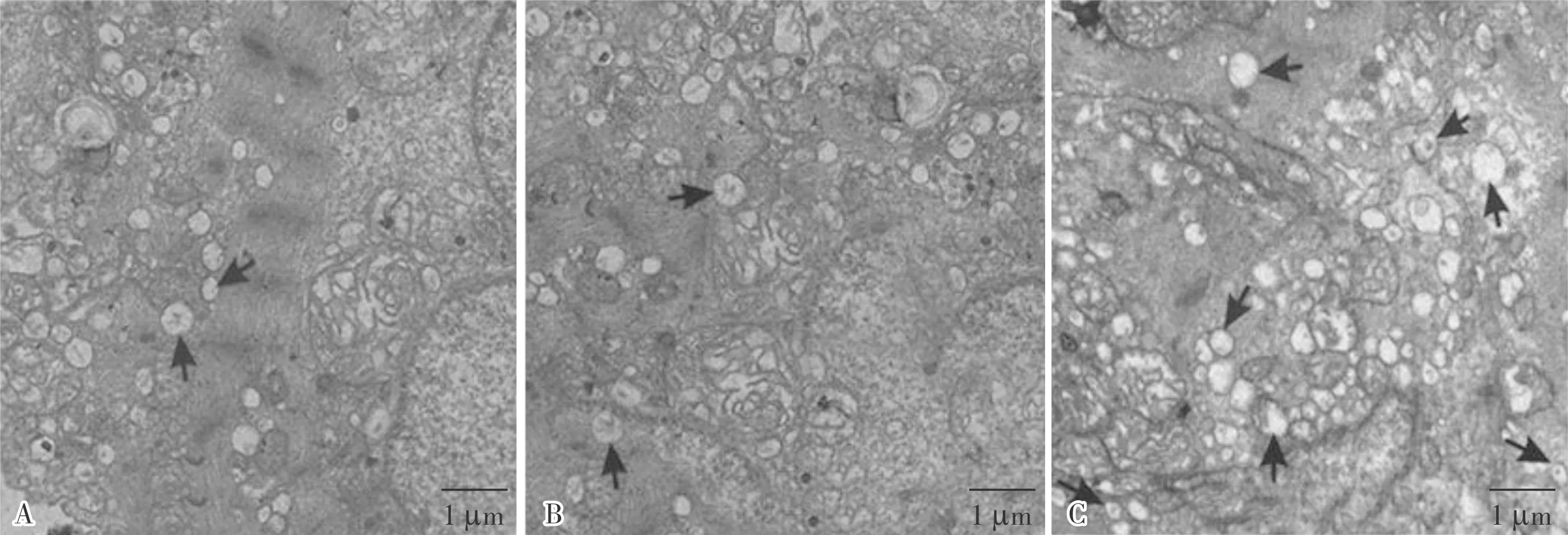
A:mock组;B:CON-siRNA组;C:OPN-siRNA组;箭头示自噬体。
图4OPN下调后各组细胞自噬体形成情况(×1000)
Fig.4AutophagyformationofthecellsineachgroupafterOPNdown-regulation(×1000)
2.4OPN下调后各组细胞凋亡率比较结果见图5。OPN-siRNA组、mock组、CON-siRNA组细胞早期凋亡率分别为0.425±0.017、0.056±0.007和0.049±0.005。OPN-siRNA组细胞早期凋亡率显著高于mock组和CON-siRNA组(F=23.180,P=0.003),CON-siRNA组与mock组细胞早期凋亡率比较差异无统计学意义(P=0.173)。
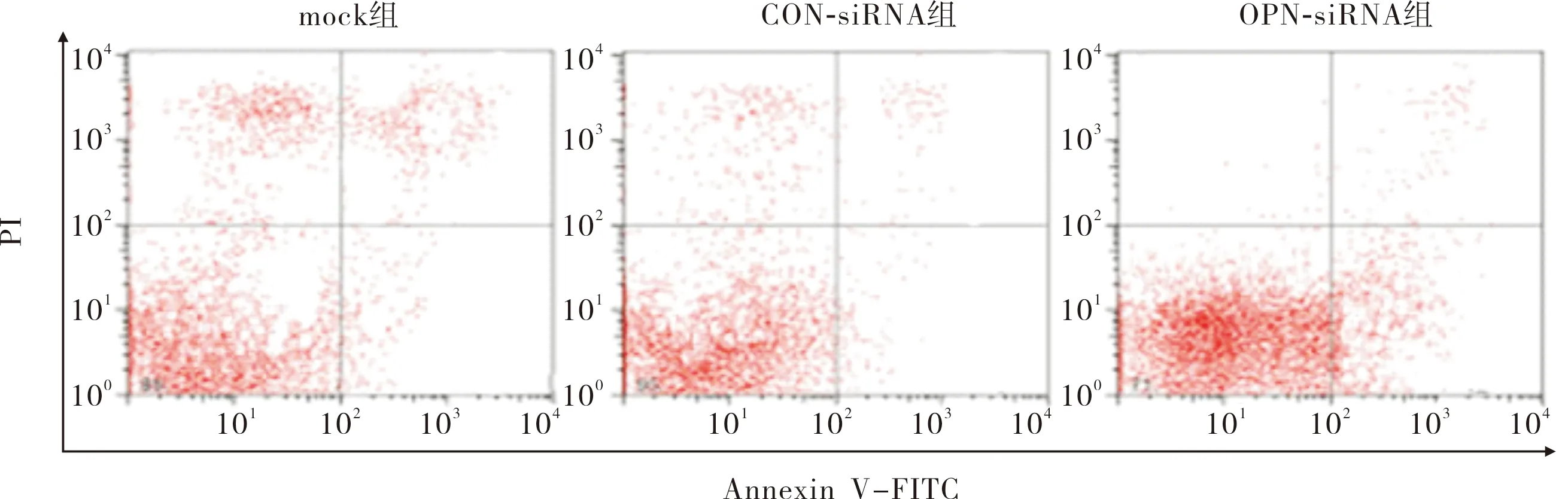
图5流式细胞术检测OPN下调后各组细胞凋亡情况
Fig.5ApoptosisofthecellsineachgroupafterOPNdown-regulationdetectedbyflowcytometry
2.5OPN下调后各组细胞中p38MAPK和Beclin1比较结果见图6和表1。OPN-siRNA组细胞中Beclin 1 mRNA和蛋白相对表达量明显高于CON-siRNA 组和mock组,差异有统计学意义(F=29.873、32.174,P=0.001);CON-siRNA组与mock组细胞中Beclin 1 mRNA和蛋白相对表达量比较差异无统计学意义(P=0.114);OPN-siRNA组细胞中p38MAPK mRNA和蛋白相对表达量低于 mock组和CON-siRNA组,差异有统计学意义(F=32.735、37.110,P=0.000);mock组与CON-siRNA组细胞中Beclin 1 mRNA和蛋白相对表达量及p38MAPK mRNA和蛋白相对表达量比较差异无统计学意义(P=0.997)。
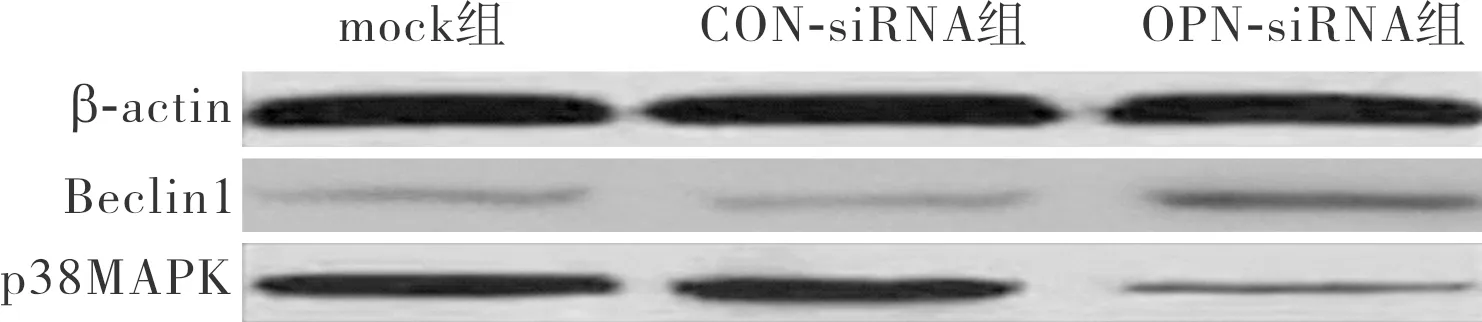
图6OPN下调后各组细胞中Beclin1和p38MAPK蛋白表达情况(Westernblot)
Fig.6ExpressionofBeclin1andp38MAPKproteinsinthecellsofeachgroupafterdownregulationofOPN(Westernblot)
表1OPN下调后3组细胞中p38MAPK和Beclin1相对表达量比较


组别mRNA相对表达量Beclin 1p38MAPK蛋白相对表达量Beclin 1p38MAPKmock组0.37±0.04a0.93±0.11a0.39±0.06a0.97±0.11aCON-siRNA组0.41±0.06a1.07±0.07a0.43±0.07a1.01±0.09aOPN-siRNA组0.97±0.070.39±0.050.99±0.050.31±0.07F29.87332.73532.17437.110P0.0010.0000.0010.000
注:与OPN-siRNA组比较aP<0.05。
3 讨论
精准医疗时代更加注重根据乳腺癌不同分子特征施行个体化治疗[7],而不同的分子特征对应的是癌细胞不同的胞内信号转导路径和生物学活性。研究发现,三阴性乳腺癌MDA-MB-231细胞中OPN表达下调后S期细胞比例由22.77%增长至43.67%,凋亡率由3.60%增长至4.91%[8]。且有研究显示,三阴性乳腺癌组织中OPN与细胞间黏附分子1(intercellular adhesion molecule 1,ICAM-1)、血管内皮生长因子(vascular endo-thelial growth factor,VEGF)表达呈正相关,OPN-siRNA可抑制三阴性乳腺癌MDA-MB-468细胞中ICAM-1和VEGF的表达及细胞增殖[9]。本研究结果发现,三阴性乳腺癌组织中OPN和Beclin 1表达呈负相关,同时,当MDA-MB-231细胞中OPN表达下调后细胞自噬及凋亡率也显著增强。
焦庆丽等[10]研究发现,自噬在乳腺癌组织中呈低表达,并与人表皮生长因子受体2、增殖细胞核抗原表达和TNM分期均呈负相关。许杜娟等[11]研究认为,抑制自噬可以增加顺铂诱导的乳腺癌MCF-7细胞凋亡。而沉默微小RNA-21表达则可以促进自噬性细胞死亡,从而增强雌激素受体阳性乳腺癌细胞对他莫昔芬和氟维斯群的敏感性,而该作用的发挥依赖于微小RNA-21沉默后对磷脂酰肌醇3激酶-蛋白激酶B-雷帕霉素靶蛋白信号转导通路的抑制[12]。因此,自噬对肿瘤发生、发展的影响是复杂而多变的。有学者认为,自噬相关蛋白Beclin 1的表达依乳腺癌分子亚型而不同[13]。本研究发现,三阴性乳腺癌MDA-MB-231细胞系OPN表达下调后Beclin 1蛋白表达显著增加,同时细胞自噬和凋亡率显著增强,这提示针对三阴性乳腺癌进行OPN靶向性抑制可能是一种有效的治疗选择。LI等[14]应用Aurora激酶抑制剂MLN8237处理MCF-7和MDA-MB-231细胞,发现癌细胞出现G2/M期停滞、凋亡和自噬活性增强,同时LC3和Beclin 1表达增加,磷脂酰肌醇3激酶/蛋白激酶B和p38MAPK信号通路受到抑制。本研究发现,OPN表达下调后p38MAPK表达随之下调,而Beclin 1表达则上调,这表明OPN对Beclin 1的调节可能是依赖p38MAPK信号通路发挥作用。
综上所述,抑制OPN表达可促进乳腺癌细胞自噬和凋亡,该作用的发挥可能通过p38MAPK信号通路调节Beclin 1表达而实现。本研究初步探讨了OPN调节乳腺癌发生、发展的信号转导机制,为以OPN为靶点的三阴性乳腺癌的治疗提供了理论支持。
