苦荞凝集素的稳定性及体外消化性
2018-12-26,,,,,,*
,,, ,,,*
(1.山西大学生命科学学院,山西太原 030006; 2.山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西太原 030006)
凝集素是一类能与红细胞表面特异糖基进行可逆结合并促使细胞凝集的蛋白质,在自然界广泛分布[1]。1975年Becker等[2]首次解析了刀豆凝集素(Concanavalin A,Con A)分子的三级结构,掀起了凝集素研究的热潮。人们对凝集素的结构、分类、糖结合特性、生物活性等进行了深入研究[3],发现凝集素在信号识别、胚胎发育、免疫应答、植物防御等多方面均有重要作用[4]。由于其特异性结合能力,凝集素已广泛应用于分离纯化、结构分析及免疫细胞化学技术,是研究细胞膜结构的有利工具,有望开发为二代生物粘附药物传输系统[5]。同时,凝集素具有抗真菌、抑制HIV-1逆转录酶、诱导肿瘤细胞凋亡等多种能力,在全胃肠外营养期可以用于预防胃肠粘膜萎缩,还可用于开发新型减肥药物[6]。因此,凝集素在生物、医学及农业等多个领域应用前景广阔[7]。然而,1988年首次发现的蓖麻凝集素具有极强的细胞毒性,大豆凝集素是大豆主要的抗营养因子,凝集素的安全性也一直是人们关注的焦点问题[8]。
苦荞为廖科杂粮作物,药食同源,有“五谷之王”的美称,含有丰富的矿物质、类黄酮、抗菌肽等生物活性物质,已开发出一系列相关保健品和辅助药物[9-10]。本课题组从苦荞中分离纯化得到一种凝集素(tartary buckwheat lectin,TBL),对其理化性质进行了初步研究[11]。TBL是一种糖结合蛋白,分子质量约为 62 kDa,特异性凝集人的O型血红细胞,凝血活性可被D-甘露糖和D-葡萄糖抑制,具有磷酸酯酶活性和类似核糖体失活蛋白的功能。然而,作为一种抗营养因子,TBL的稳定性、消化特性等与食品安全关系密切,目前尚未有对TBL稳定性和消化性的报道。体外消化模型成本低、周期短、重复性好,是代替体内研究食品蛋白消化的一种重要手段。
本实验采用人工胃液和肠液模拟消化模型,联合十二烷基硫酸钠-聚丙烯酰氨凝胶电泳技术(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析消化后TBL蛋白条带的变化,研究TBL的消化特性,并进一步探索TBL的pH稳定性和热稳定性,以及热处理对TBL消化性的影响,将为深入研究凝集素的开发应用奠定一定理论基础。
1 材料与方法
1.1 材料与仪器
苦荞种子 云荞一号,由云南省农业科学院生物技术与种质资源研究所馈赠;胃蛋白酶、胰蛋白酶 美国Sigma公司;其他试剂 均为国产分析纯;实验用水 为去离子水。
BioLogic LP低压层析系统 美国Bio-Rad公司;5804R高速冷冻离心机 德国艾本德公司;FE28-Standard精密pH计 梅特勒-托利多仪器(上海)有限公司;AR124CN精密电子天平 奥豪斯仪器(上海)有限公司;TU-1810紫外可见分光光度计 北京普析通用公司;DYCZ-24D垂直板电泳槽和电泳仪 北京六一生物科技有限公司;HH SY21-Ni恒温水浴锅 北京市长风仪器仪表公司;HP-02无油真空泵 天津市恒奥科技发展有限公司;DEAE FF离子交换层析柱(1 mL) 美国Bio-Rad公司;透析袋(10 kDa) 生工生物工程(上海)股份有限公司;超滤浓缩管(30 kDa) 美国Millipore公司。
1.2 实验方法
1.2.1 苦荞凝集素的制备 参考申剑等[11]方法,略作改动。称取150 g苦荞麦种子,粉碎,用40目筛筛选粉末,加入500 mL乙醚搅拌脱脂1 h,抽滤得到脱脂粉。称取100 g粉末于烧杯中,加入1.5 L 浸提缓冲液(0.02 mol/L乙酸钠-乙酸缓冲液,pH4.7),4 ℃搅拌提取8 h,于4 ℃,11 000 r/min离心30 min,收集上清液。往上清液中边搅拌边加入硫酸铵,使其饱和度达到80%,使用磁力搅拌器继续搅拌8 h,11000 r/min离心30 min收集沉淀。用少量平衡缓冲液(0.02 mol/L磷酸盐缓冲液PBS,pH7.0)溶解沉淀,并以相同缓冲液作为外液,使用截留分子量为10 kDa的透析袋于4 ℃进行透析,每隔30 min更换外液,并用BaCl2检测透析外液,至无法检测到硫酸钡沉淀,透析结束,得到蛋白粗品。继续使用阴离子交换层析柱DEAE FF在蛋白纯化系统上进行纯化,即得到苦荞凝集素。平衡缓冲液中加入0.5 mol/L NaCl为洗脱缓冲液,流速为2 mL/min,收集洗脱峰并进行SDS-PAGE及凝血实验鉴定。将纯化的目的蛋白用超滤浓缩管(30 kDa)浓缩后,分装于2 mL离心管中,于-20 ℃保存备用。
1.2.2 苦荞凝集素热稳定性研究 向1.5 mL离心管中分别加入20 μL 1 mg/mL苦荞凝集素(溶剂为20 mmol/L PBS,pH7.0),于沸水浴中分别加热0、10、20、30、40、50、60 min后,迅速置于冰浴中冷却,加入SDS-PAGE样品缓冲液(pH6.8 0.25 mol/L Tris-HCl、10% SDS、0.5%溴酚蓝、50%甘油、5%β-巯基乙醇),继续用沸水浴加热5 min,使蛋白充分变性,与SDS结合,进一步进行SDS-PAGE分析,并按照以下公式计算保留率。
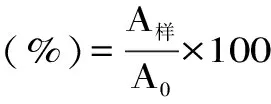
其中,A样为不同加热处理时间后样品的灰度值,A0为TBL的灰度值。
1.2.3 苦荞凝集素pH稳定性研究 将苦荞凝集素分别于37 ℃,pH为2、4、6、8、10、12的缓冲液中处理30 min后,加入SDS-PAGE样品缓冲液,立即沸水浴中加热5 min,进行SDS-PAGE分析,以灰度值最大组的灰度值为100%,按照上式计算保留率。
1.2.4 苦荞凝集素体外消化实验 人工模拟胃液(simulated gastric fluid,SGF)根据美国药典配制,成分为胃蛋白酶(3.2 mg/mL,1000 U/mg)和NaCl(2.0 mg/mL)的水溶液,用盐酸调至pH1.2[13]。实验主要按照Thomas等[14]的方法进行,并做了适当修改。在1.5 mL离心管中加入15 μL SGF,于37 ℃预热10 min,分别加入10 μL 1 mg/mL的苦荞凝集素,混匀,开始模拟消化,反应不同时间(0、10、20、30、40 min)后,加入5 μL终止液(20 mmol/L Na2CO3水溶液,pH11.0)终止反应。对照组的加样顺序为先向SGF中加入终止液,再加入10 μL苦荞凝集素,以保证消化反应不会进行。向各管样品中分别加入5 μL 6×SDS-PAGE样品缓冲液,在沸水浴加热5 min,进行SDS-PGAE分析。实验分为两组,即未经加热的苦荞凝集素组和预加热组,预加热组中样品为沸水浴加热处理30 min后的TBL。
人工模拟肠液(simulated intestinal fluid,SIF)为10 mg/mL胰蛋白酶溶液(pH6.8±0.1,含6.8 mg/mL KH2PO4)。分别将10 μL凝集素样品(1 mg/mL)加入到15 μL 37 ℃预热的模拟肠液中,反应不同时间(0、10、20、30、40、50 min)后,立即煮沸5 min终止反应。对照组(即反应0 min)的处理是先向15 μL胰蛋白酶中加入样品缓冲液,煮沸3 min后再加入10 μL苦荞凝集素。终止反应后分别加入5 μL样品缓冲液,沸水浴加热5 min后进行SDS-PAGE分析。同样,本实验中的样品分为未经过加热的TBL组和预加热组,预加热组中样品为沸水浴加热处理30 min后的TBL。
1.2.5 SDS-PAGE分析 SDS-PAGE参考Laemmli等的方法[12],采用12%分离胶和4%浓缩胶,考马斯亮蓝R250染色脱色后拍照,进行分析。
1.3 数据处理
所有实验进行3次重复,绘图用Origin 8.6进行,灰度分析用Image J进行。
2 结果与分析
2.1 苦荞凝集素的纯化及鉴定
苦荞粉过脱脂、浸提、硫酸铵沉淀、透析脱盐后,得到蛋白质粗提物,上样于DEAE FF阴离子交换层析柱,结果如图1所示。在洗脱时间5~15 min时出现穿透峰1。充分洗去未结合蛋白后,提高盐离子浓度,换用含0.5 mol/L NaCl的缓冲液进行洗脱,在33~40 min出现蛋白峰,收集洗脱峰2。对峰2组分进行SDS-PAGE分析,结果见图2A。泳道1为苦荞粗品蛋白,条带相对较少,说明苦荞粉经过浸提后,便有效去除了较多的杂蛋白,有利于后续纯化。本研究在前期工作的基础上,利用苦荞凝集素较好的稳定性,对提取工艺进行了优化,采用偏酸性缓冲液进行浸提,简化了纯化方法。泳道2为纯化后的蛋白样品,电泳结果显示为一条带,蛋白表观纯度达到了95%以上,根据相对迁移率和分子质量对数的回归方程,计算出蛋白的相对分子质量为62 kDa,与预期结果一致,并经凝血实验证明,纯化的蛋白即为苦荞凝集素[11]。
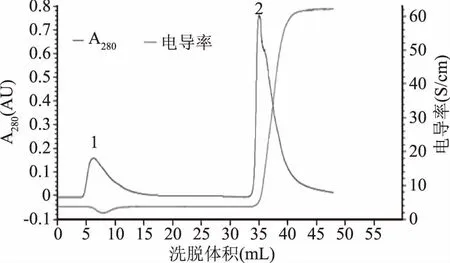
图1 苦荞凝集素的离子交换层析图谱Fig.1 Ion exchange chromatography of TBL
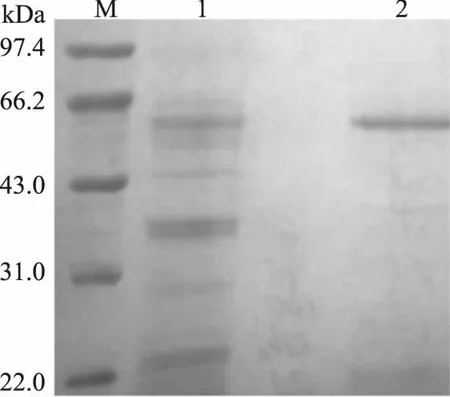
图2 苦荞凝集素的SDS-PAGE分析结果Fig.2 SDS-PAGE analysis result of TBL注:1为苦荞粗品蛋白;2为纯化后蛋白。
2.2 热处理对苦荞凝集素的影响
将苦荞凝集素在沸水浴中分别加热0、10、20、30、40、50、60 min后进行SDS-PAGE,结果见图3。加热不同时间后,TBL的条带仍清晰可见,但相比未加热组(泳道1),加热后的蛋白条带亮度有所降低,尤其加热50、60 min(泳道6、泳道7)后,目的条带的变化肉眼可见。灰度扫描分析结果表明,TBL的降解与加热时间呈线性关系,随着加热时间延长,降解程度升高。日常生活中,对食物的蒸煮时间为60 min左右。在本研究中,当加热时间达60 min时,仍有50%以上TBL未发生降解。由此可见TBL对热不敏感,较为稳定,常规的食品热加工手段并不能完全消除TBL。
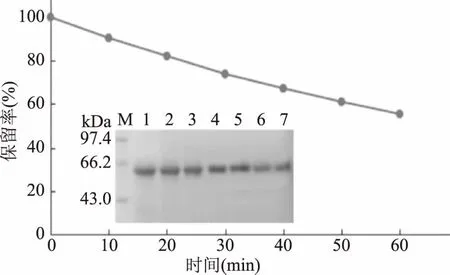
图3 热处理对苦荞凝集素保留率的影响Fig.3 Effect of heat treatment on retention rate of TBL注:1~7:TBL沸水浴中分别加热0、10、20、30、40、50、60 min。
2.3 pH对苦荞凝集素的影响
将苦荞凝集素在不同pH缓冲液中分别处理30 min后进行SDS-PAGE,结果见图4。不同pH处理后,TBL电泳结果仍为一条带,条带的位置相同。在pH8.0时,TBL有最大保留率,当酸度为pH4.0时,TBL的保留率仍在80%左右。TBL在pH4~12环境条件均有很高的保留率,表明该蛋白具有很好的酸碱稳定性。同时,也进一步验证了在优化提取工艺时选择pH4.7浸提缓冲液是可取的。
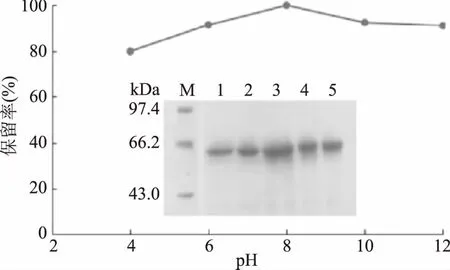
图4 pH对苦荞凝集素保留率的影响Fig.4 Effect of pH on retention rate of TBL注:1~5:TBL分别在pH4、6、8、10、12处理30 min。
2.4 体外模拟消化实验
苦荞凝集素分别经体外模拟人工胃液和肠液消化后进行SDS-PAGE分析,结果如图5和图6所示。模拟胃液和肠液中,胃蛋白酶和胰蛋白酶的电泳条带清晰可见(图5、图6)。从TBL电泳条带可知,模拟胃液对TBL的降解作用明显强于模拟肠液。对蛋白条带进行灰度分析,并以模拟消化实验中反应0 min时TBL的灰度值为100%,计算苦荞凝集素的保留率。由图5可知,随着SGF处理时间延长,TBL保留率迅速降低,40 min时基本消化完全,降解一半TBL所需时间仅为10 min。由图6可知,TBL在SIF中很难消化,即使作用时间为50 min时,TBL也未发生明显变化(泳道8)。
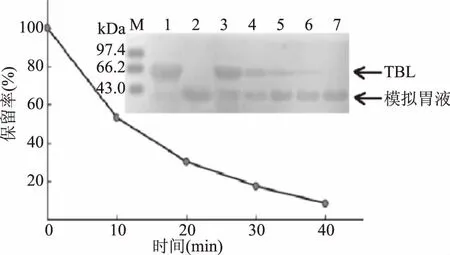
图5 苦荞凝集素的SGF消化Fig.5 SGF digestion profiles of TBL注:1:TBL;2:模拟胃液;3~7:TBL在SGF中分别消化0、10、20、30、40 min。

图6 苦荞凝集素的SIF消化Fig.6 SIF digestion profiles of TBL注:1:模拟肠液;2:TBL;3~9:TBL在SIF中分别消化0、10、20、30、40、50 min。
为探索加热过程对蛋白消化性的影响,将苦荞凝集素加热处理后,进行体外模拟消化实验,SDS-PAGE结果如图7和图8所示。由图7可知,加热后的TBL在SGF中仅处理10 min后,电泳条带基本完全消失,蛋白被消化完全。即使在SIF中的消化也非常迅速,仅处理10 min,加热后的TBL被SIF完全降解,没有任何可见的残留蛋白条带(图8)。因此,预加热过程可以明显增强消化酶对TBL的降解。这一结果与黑龟豆[13]、肾小豆[15]中凝集素的消化性类似。许多豆类蔬菜不能生吃,很重要的一个原因是其含有大量凝集素,直接食用不易消化。经过100 ℃蒸煮后,蛋白对消化酶的敏感性明显增强,易被降解消化。因此,加热是消除抗营养因子及过敏原的一个重要控制手段。可能是由于天然凝集素形成特定的空间结构,将消化酶的识别位点折叠包围于分子内部,不易被消化酶识别并作用。加热后,虽然蛋白一级结构未发生改变,没有降解,但空间结构发生较大变化,如由紧密变得更为松散,易被胃蛋白酶或胰蛋白酶识别、结合、分解。
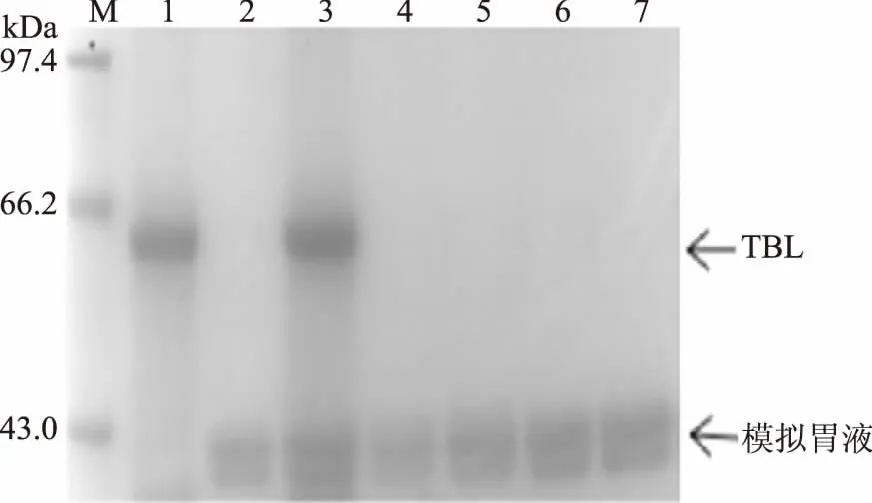
图7 热处理后苦荞凝集素的SGF消化结果Fig.7 SGF digestion profiles of the heated TBL注:1:TBL;2:模拟胃液;3~7:加热后TBL在SGF中分别消化0、10、20、30、40 min。
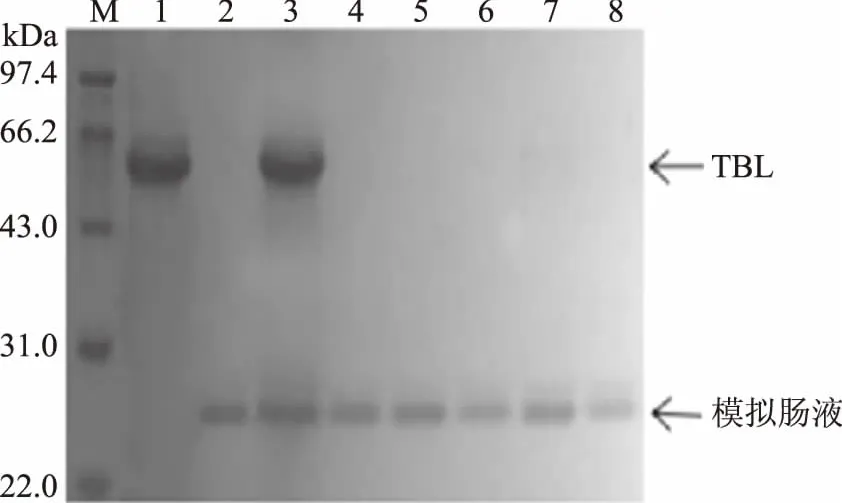
图8 热处理后苦荞凝集素的SIF消化结果Fig.8 SIF digestion profiles of the heated TBL注:1:TBL;2:模拟肠液;3~8:加热后TBL在SIF中分别消化0、10、20、30、40、50 min。
3 讨论与结论
本实验对苦荞凝集素的稳定性及体外消化性进行了初步研究。TBL对热不敏感,沸水浴中加热60 min时,蛋白仍可保留一半以上。同时TBL还具有很好的酸碱稳定性,在pH4~12环境条件下处理30 min时仍具有较高的保留率。天然TBL对人工胃液的消化有一定耐受性,在人工肠液中表现出更强的稳定性,即使消化时间为50 min时,TBL也未发生降解。以上结果显示TBL具有很好的稳定性。然而,加热处理促使TBL空间结构发生改变,使其对胃蛋白酶及胰蛋白酶的敏感性明显增强。
作为一种抗营养因子,TBL的稳定性及消化特性与荞麦制品的安全性息息相关。从食品加工工艺角度出发可知,经过充分蒸煮加热处理后,有利于提高荞麦制品的食品安全性。另外,糖及其衍生物对凝集素活力有抑制作用,如核桃凝集素的凝集活性可被N-乙酰-D-葡萄糖胺和N-乙酰-D-半乳糖胺抑制[16],D-甘露糖和D-葡萄糖可抑制TBL的凝集活性。此外,由于金属离子对凝集素的结构及结合糖的活性均有影响,失去金属离子后凝集素稳定性降低。如Con A脱去金属离子后,通过主链Ala-Asp肽键的顺反异构,其空间结构由“锁定”状态转变为“打开”状态,使得Con A对胰蛋白酶的敏感性显著增强[17]。同样,使用金属螯合剂可提高木瓜蛋白酶对加纳籽II型凝集素的消化性[18]。因此,除了常规的酸碱及热处理加工手段,是否可通过配合使用某些糖类或金属螯合剂抑制凝集素活性以提高食品安全性,还有待进一步探索。
由于对胃肠道的消化具有一定抵抗作用,植物凝集素有望发展为二代生物粘附药物传输系统,减少非特异性蛋白损失。课题组之前的研究发现,TBL识别HCT116细胞表面的galectin-3受体,通过内吞作用进入细胞,调控miR-135a&b的表达并影响Wnt信号通路,可以显著抑制结肠癌细胞的增殖[19]。TBL具有良好的稳定性及耐消化性,具备开发成抗肿瘤药物的优势条件。
