低能量LED蓝光对人根尖乳头干细胞体外增殖的影响
2018-12-26杨瑶瑶朱婷婷
杨瑶瑶,朱婷婷,王 瑶
(1西南医科大学附属口腔医院口腔预防保健科,四川泸州 646000;2烟台市口腔医院儿童牙科)
2006年Sonoyama W从人年轻恒牙根尖乳头中成功分离出根尖乳头干细胞(stem cells from apical papilla,SCAPs),有研究发现SCAPs具有自我更新及形成牙本质、成骨等多向分化能力[1]。低能量LED蓝光照射生物组织,可调节细胞功能[2],提高不同类型细胞的增殖和分化能力[3],如乳牙牙髓干细胞[4]、骨髓间充质干细胞及心肌干细胞[5]、人皮肤细胞[6]等。LED蓝光是一种安全、有效的窄谱光源,对正常组织细胞几乎无毒性,其促进细胞分化抑制细胞增殖的作用要强于红光[7]。但既往研究主要集中在红光和激光,对LED蓝光的涉入较少,在牙源性干细胞方面的研究更少。目前,LED蓝光对SCAPs增殖的影响尚不明确,评估LED蓝光对SCAPs增殖的影响,为实验研究和临床治疗方法提供参考具有重要意义。
1 材料与方法
1.1 主要试剂和仪器
胎牛血清(四季青,中国);DMEM/LOW(Hy-Clone,美国);I型胶原酶(Biosharp,美国);Dispase酶(Yeasen,美国);小鼠抗人CD146、小鼠抗人CD45(Ebioscience,美国);小鼠抗人 CD90、小鼠抗人CD105(三箭生物,中国);MTT粉剂(Biosharp,美国);流式细胞仪(Biorad,美国);LED蓝光(桂林市啄木鸟,中国);能量测光表(桂林市啄木鸟,中国);全光谱分光光度计(SBK-YLQX,美国)。
1.2 SCAPs的分离、培养、鉴定
细胞组织取自根尖未闭合的年轻恒牙,主要来源于本地口腔医院因正畸治疗需要拔除的前磨牙或阻生牙。患者健康无全身性疾病,牙体完整无病变,根尖未闭合无炎症。将根尖乳头组织清洗、剪碎、离心,加入1 mL I型胶原酶(3 mg/mL)和1 mL Dispase酶(4 mg/mL),370C孵育15~30 min,吹打呈絮状,终止消化,离心后接种培养。镜下见组织块周围细胞爬出,每3 d换液。单克隆纯化原代SCAPs,消化扩大培养。取生长状态旺盛的第2代SCAPs,流式细胞仪检测SCAPs表面抗原CD90、CD146、CD105、CD45。
1.3 MTT法检测低能量LED蓝光干预下SCAPs的增殖情况
低能量LED蓝光420~470 nm,光源距细胞层面1 cm,光功率密度100 mW/cm2。实验分为成骨诱导(ODM)组与普通培养基(DMEM)组,每组又分为非光照组A及光照组B~E,光照组分别以1、2、3和4 J/cm2为照射剂量,暗房内同一个人定时定点隔天光照。光照能量密度计算公式:能量密度=能量功率×时间。
取对数生长期第3代SCAPs,以4×103/孔接种于96孔板,设5个复孔,次日随机分组并进行光照,ODM组更换成骨诱导液,DMEM组更换普通培养液,每3 d换液。光照时细胞均移出孵箱,置于暗房内,根据不同光照强度进行光照。MTT检测第1、3、5、7和9 d的各组OD值。移除孔内原培养基,各孔分别注入200 μL低糖DMEM,避光下各孔再注入20 μL 5 mg/mL MTT液,避光孵育4 h。去尽孔内培养液,加入150 μL/孔二甲基亚砜(dimethyl sulfoxide,DMSO)。摇床上震摇10~20 min,全光谱分光光度计490 nm波长下检测各孔的吸光值(OD),根据时间和OD值,绘制SCAPs的生长曲线图。
1.5 统计学分析
采用SPSS 17.0软件进行统计学分析。计量资料用均数±标准差表示,采用Type III Tests of Fixed Effectsa统计分析数据,P<0.05表明各组间差异有统计学意义。
2 结 果
2.1 人根尖乳头干细胞(SCAPs)的分离培养、纯化及鉴定
年轻恒牙根尖牙乳头组织呈淡粉红色,质软,易与牙髓组织分离(图1);原代培养5 d后镜下见细胞从组织块边缘长出,细胞形态多为长梭形,形成生长晕(图2);流式细胞仪鉴定第2代SCAPs表面抗原测定结果为:CD105阳性率98.31%、CD146阳性率45.20%、CD90阳性率99.90%和CD45阴性率0.02%(图3)。

图1 人根尖牙乳头组织

图2 第5 d细胞从贴壁组织块长出(×40)

图3 流式细胞仪鉴定第2代SCAPs表面抗原测定结果
2.2 低能量LED蓝光干预下SCAPs增殖情况
根据MTT检测数据绘制SCAPs的生长曲线(图4)。可见各实验组SCAPs第1~3 d为缓慢增殖期、第3~7 d为快速增殖期、第7~9 d为稳定期,各组总增殖趋势近似“S”形曲线。每个组SCAPs增殖情况结果见表1、2。相同培养基中,ODM组中第3、5、7和9 d各时间点光照组增殖速率低于非光照组,其中2、3和4 J/cm2与0 J/cm2具备统计学意义(P < 0.05),第3、5 d各光照能量梯度之间增殖速率也存在一定差异。DMEM组中1、2、3、4 J/cm2增殖速率高于0J/cm2,但并无完全具有统计学意义,第5、7、9 d光照组4 J/cm2增殖速率高于非光照组,差异具有统计学意义(P<0.05)。如图5示相同光照强度下,DMEM组SCAPs增殖速率均高于ODM组,第3、5、7和9 d光照组2、4 J/cm2差异具有统计学意义(P < 0.05)。

图4 低能量LED蓝光干预下SCAPs生长曲线
表1 低能量LED蓝光对SCAPs ODM组增殖能力的影响(OD490值)
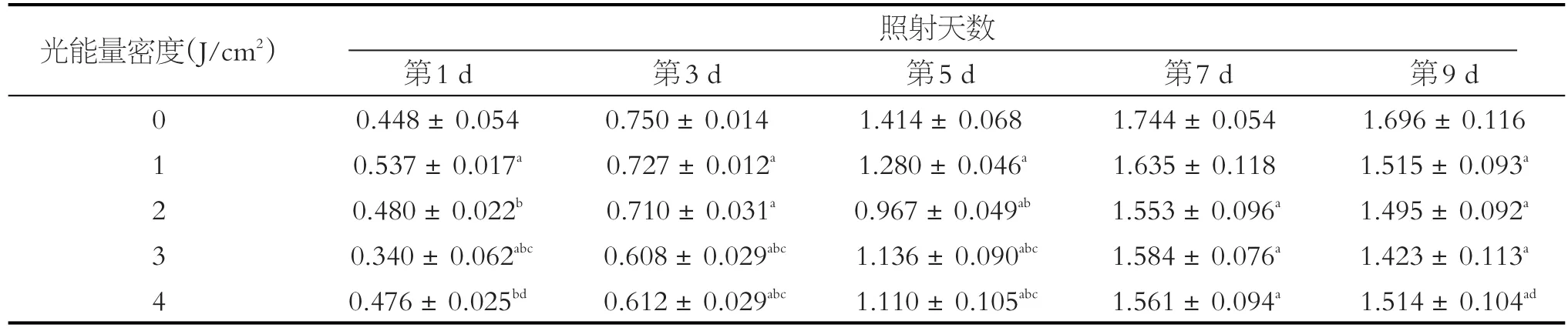
表1 低能量LED蓝光对SCAPs ODM组增殖能力的影响(OD490值)
注:a与非光照组对比,P<0.05;实验亚组两两比较:b与1 J/cm2光照能量比较,P<0.05;c与2 J/cm2光照能量比较,P<0.05;d与3 J/cm2光照能量比较,P < 0.05
光能量密度(J/cm2)照射天数0 1 2 3 4第1 d 0.448±0.054 0.537±0.017a 0.480±0.022b 0.340±0.062abc 0.476±0.025bd第3 d 0.750±0.014 0.727±0.012a 0.710±0.031a 0.608±0.029abc 0.612±0.029abc第5 d 1.414±0.068 1.280±0.046a 0.967±0.049ab 1.136±0.090abc 1.110±0.105abc第7 d 1.744±0.054 1.635±0.118 1.553±0.096a 1.584±0.076a 1.561±0.094a第9 d 1.696±0.116 1.515±0.093a 1.495±0.092a 1.423±0.113a 1.514±0.104ad
表2 低能量LED蓝光对SCAPs DMEM组增殖能力的影响(OD490值,)
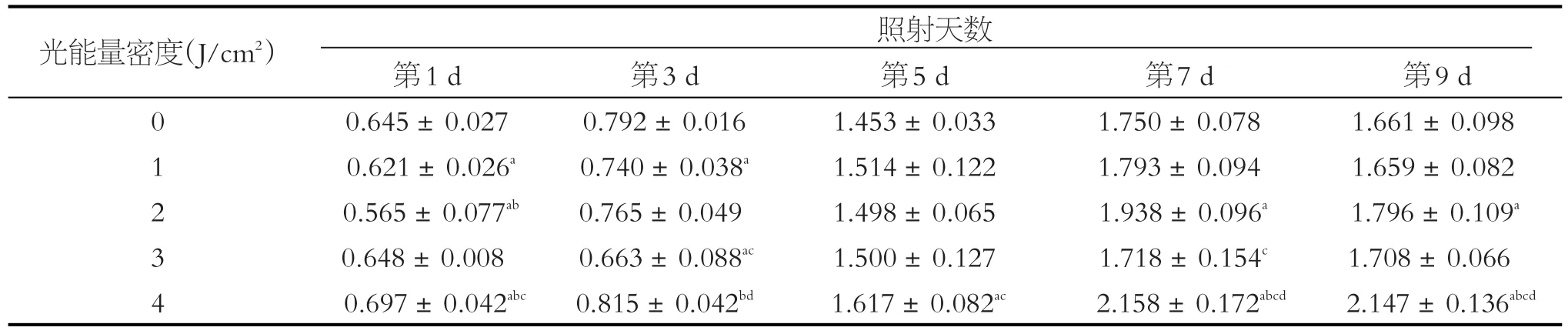
表2 低能量LED蓝光对SCAPs DMEM组增殖能力的影响(OD490值,)
注:a与非光照组对比,P<0.05;实验亚组两两比较:b与1 J/cm2光照能量比较,P<0.05;c与2 J/cm2光照能量比较,P<0.05;d与3 J/cm2光照能量比较,P < 0.05
光能量密度(J/cm2) 照射天数0 1 2 3 4第1 d 0.645±0.027 0.621±0.026a 0.565±0.077ab 0.648±0.008 0.697±0.042abc第3 d 0.792±0.016 0.740±0.038a 0.765±0.049 0.663±0.088ac 0.815±0.042bd第5 d 1.453±0.033 1.514±0.122 1.498±0.065 1.500±0.127 1.617±0.082ac第7 d 1.750±0.078 1.793±0.094 1.938±0.096a 1.718±0.154c 2.158±0.172abcd第9 d 1.661±0.098 1.659±0.082 1.796±0.109a 1.708±0.066 2.147±0.136abcd

图5 ODM组与DMEM组SCAPs的增殖变化
3 讨论
研究表示SCAPs来源于早期成牙本质细胞且对根部牙本质的形成、牙根发育有重要作用[1,8]。SCAPs具有较高增殖、分化、促进根尖周组织愈合能力[9],在骨及牙组织再生方面有重要意义,有望治疗多种原因引起的年轻恒牙病变。光生物调节法(photobiomodulation,PBM)是利用低能量LED蓝光照射生物组织,对其细胞功能进行调制的一种方法。在临床上可通过选用正确的参数和适应症,PBM作为辅助治疗,改善临床疗效[10]。LED蓝光具有广谱的抗菌作用[11],能杀灭革兰阳性和革兰阴性菌。波长450~475 nm的LED蓝光,临床上被首选治疗新生儿黄疸[12]。可见蓝光可促进人角质细胞和内皮细胞分化标记物的增加[6]。Higuchi实验中发现1 mW/cm2波长470 nm蓝光可影响羊水间充质干细胞的增殖和成骨分化[7]。光剂量范围从0.5~10 J/cm2之间被认为可诱导细胞增殖[13]。光能量密度在0.5~4 J/cm2之间,刺激干细胞生长方面更有效[14-17]。所以本实验采用420~470 nm,功率1 mW/cm2,光能量密度0~4 J/cm2的低能量LED蓝光,研究LED蓝光对SCAPs增殖的影响。
本实验获取的原代SCAPs呈长梭形、贴壁生长,能够形成细胞克隆集落,并具有自我更新能力。SCAPs间充质干细胞表面抗原CD105、CD146、CD90阳性表达和造血细胞表面标记物CD45阴性表达,与以往根尖乳头细胞提取中获得的结果相同,表明SCAPs来自骨髓间充质干细胞,具有间充质干细胞特性[18-19]。MTT结果显示整体分组趋势倾向于“S”形曲线,说明获取的SCAPs处于对数期,细胞活性好,具有良好的生长能力[20]。相同光能量密度下,DMEM组的增殖率高于ODM组,其原因可能是ODM组中成骨诱导液促进了SCAPs的分化,抑制了增殖。与Owen TA[21]研究中矿化液抑制细胞增殖,促进成骨表达这一点一致。相同培养基中,光照组与非光照组间有差异。ODM组中非光照组增殖率高于光照组,随着时间推移,光照组增殖率明显低于0 J/cm2,表明在矿化条件下LED蓝光可抑制SCAPs的增殖,时间越长,抑制效果越明显。初步证实LED蓝光与矿化培养基存在协同作用,有利于SCAPs的分化,这与Robertson[6]的报道结果相似。而DMEM组中光照组增殖速率高于非光照组,增值率最高为4 J/cm2,同样随时间增长,差异越明显,说明LED光作为辅助工具,在普通培养基中可以通过光照促进细胞的增殖。以往实验研究中虽然有4 J/cm光照能量的报道[22],但是整体的光能量参数仍然参差不齐。本实验利用有效光能量参数0~4 J/cm2,得出在ODM组和DMEM组中,相比非光照组,光照组1~4 J/cm2的增殖率都有所改变,其中4 J/cm2改变较明显,表明在普通培养基和矿化条件下4 J/cm2低能量LED蓝光对SCAPs生物特性影响较大,可以更好的促进细胞的增殖分化。因此,在一定条件下可通过LED蓝光影响SCAPs增殖特性,有利于SCAPs在组织工程中的发展。虽然有学者指出ATP/cAMP通路可能是调节光照射引导细胞增殖的机制,所以光照可以调节细胞的平衡参数,如氧化还原的敏感因子的表达等导致细胞的增殖发生变化[23]。但是机制尚不完全统一,目前LED蓝光对SCAPs的机制有待进一步研究。
4 结 论
本实验研究了LED蓝光干预下SCAPs的增殖情况,表明低能量LED蓝光可影响SCAPs生物学特性。光治疗可以协助干细胞工程,促使细胞大量增殖和分化,是提升组织工程和重建过程中重要的措施,在实验和临床上有很大潜力和重要意义,LED蓝光对SCAPs增殖、分化机制的研究需进一步探索。
