模拟高原缺氧环境对不同性别大鼠生理生化指标的影响
2018-12-26马慧萍景临林张冬梅贾正平
何 蕾,马慧萍,景临林,张冬梅,贾正平
高原地区由于空气稀薄,易造成初入高原人群身体不适。其中生理变化包括血氧饱和度下降,红细胞增多,血液黏稠度增加,血液流变学改变,进而影响全身组织器官[1-2]。同时由于机体氧供应不足,造成活性氧(ROS)增加,氧化应激反应可使组织损伤进一步加重,尤其对氧敏感的脑和心肌组织易损性增加[3]。高原缺氧环境严重影响高原地区建设、国防军事安全和人民身体健康。目前对高原反应预防治疗的研究越来越多,但是其机制仍不清楚。有研究表明,很多疾病的发生、发展及愈后都与性别密切相关,这种性别差异表现出不同的临床表现及愈后,但关于性别对高原缺氧耐受的影响未见报道[4]。本研究以健康Wistar大鼠为实验对象,采用低压低氧舱模拟海拔8000 m高原环境,通过比较模拟高原缺氧与正常大鼠的血液流变学、组织病理和生化指标,探讨不同缺氧时间后生理生化指标的变化情况,旨在研究低氧对机体的影响,并探讨大鼠性别与高原缺氧耐受性的关系。以期为预防和治疗高原反应提供帮助。
1 材料与方法
1.1实验仪器 MVIS 2030全自动血流变分析仪(重庆天海科技有限公司),FLYDWC50-ⅡC低压低氧动物实验舱(贵州风雷航空军械有限公司),BP210S电子天平(荷兰赛多利斯有限公司),低温离心机(德国赫利氏公司),DK-8A型电热恒温水槽(上海精宏实验设备有限公司),tissuelyser-24组织匀浆机(上海净信有限公司),Spectra Max i3酶标仪(奥地利Molecular Devices公司)。
1.2实验动物 SPF级Wistar大鼠100只,雌雄各半,体质量(200±25)g,由甘肃中医药大学实验动物中心提供,动物合格证号:SCXK2014-0020。在恒温(21~23℃)、恒湿(45%~65%)、明暗各12 h周期的饲养室,全价颗粒饲料喂养,自由进食和饮水。
1.3实验试剂 BCA法蛋白测定试剂盒(批号:20170312),丙二醛(MDA)测定试剂盒(批号:20170413),一氧化氮(NO)测定试剂盒(批号:20170406),一氧化氮合成酶(NOS)测定试剂盒(批号:20170306),过氧化氢酶(CAT)测定试剂盒(批号:20170512),谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒(批号:20170312),超氧化物歧化酶(SOD)测定试剂盒(批号:20170413),Na+-K+-ATP酶活力测定试剂盒(批号:20170512)。
1.4减压缺氧损伤模型实验 将100只Wistar大鼠按随机数字表法分为正常组,缺氧1、3、5和10 d组,每组20只,雌雄各10只,分笼饲养并标记。将各缺氧组放入大型低压氧舱内,以10 m/s速度升至海拔8000 m,分别停留1 d、3 d、5 d和10 d后,取出大鼠,采集动脉血,进行血液流变学指标的测定;采集大鼠脑组织和心肌组织,进行组织病理观察和生化指标测定;正常组在舱外饲养,同法处理,测定血液流变学指标,组织病理观察和生化指标测定。
1.5观察指标 ①血液流变学指标检测:各组大鼠腹腔注射10%水合氯醛1 ml麻醉后,解剖腹腔,采集腹主动脉血4 ml,立即进行血液流变学分析;随后离心取上层血清,进行血清分析;测定指标包括全血黏度、血浆黏度、红细胞聚集指数、卡松黏度、屈服应力、红细胞内黏度。②病理组织检测:取减压缺氧实验组大鼠脑和心肌组织,清洗,10%甲醛固定,石蜡包埋,组织切片,染色和观察,记录实验结果。③大鼠脑组织生化指标检测:取减压缺氧实验大鼠脑组织,预冷生理盐水清洗后精密称量100 mg,按1∶10(m/v)加入4℃的生理盐水,进行组织匀浆1 min,得到10%组织匀浆液。将组织匀浆液放入低温离心机,在4℃下,3000 r/min离心10 min,离心后吸取上清液,按照试剂盒说明书操作,进行MDA、SOD、CAT、GSH-PX、NO、NOS和Na+-K+-ATP酶的测定。
2 结果
2.1血液流变学指标 与正常组比较,缺氧3、5和10 d组雌鼠全血黏度、卡松黏度和屈服应力显著升高(P<0.01),雄鼠全血黏度、血浆黏度和屈服应力也显著升高(P<0.05,P<0.01);其中雄鼠的全血黏度和屈服应力较雌鼠增高显著(P<0.05,P<0.01)。与正常组比较,缺氧3 d组雄鼠红细胞聚集指数显著升高(P<0.05),缺氧10 d组雄鼠卡松黏度显著升高(P<0.05),缺氧3和5 d组雄鼠红细胞内黏度显著降低(P<0.05,P<0.01)。而各缺氧组雌鼠血浆黏度、红细胞聚集指数和红细胞内黏度与正常组比较差异均无统计学意义(P>0.05)。见表1。
2.2大鼠脑和心肌组织病理结果 正常组大鼠脑组织结构正常,可见血管和细胞形态正常;各缺氧模型组大鼠脑组织有明显的细胞核固缩,细胞间隙明显增大,组织空泡增多,且随缺氧时间增加而愈发严重。见图1。正常组大鼠心肌组织结构正常,细胞形态完好;各缺氧模型组大鼠心肌组织细胞排列紊乱,肌纤维增粗,有炎性因子产生,肌细胞肿胀,且随缺氧时间增加而愈发严重。见图2。
2.3脑组织生化指标比较 与正常组比较,各缺氧组雌鼠和雄鼠脑组织中CAT、SOD、GSH-PX、NOS和NO均随缺氧时间延长逐渐降低(P<0.05),且雄鼠的下降更为明显。与正常组比较,各缺氧组雌鼠和雄鼠脑组织中MDA随缺氧时间延长显著升高(P<0.05),而Na+-K+-ATP酶在初期缺氧时显著下降(P<0.05),第10天时恢复至正常水平,且雌鼠下降更为明显。见图3。
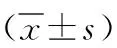
表1 5组大鼠的血液流变学指标比较

图1 5组大鼠脑组织病理变化(HE ×200)
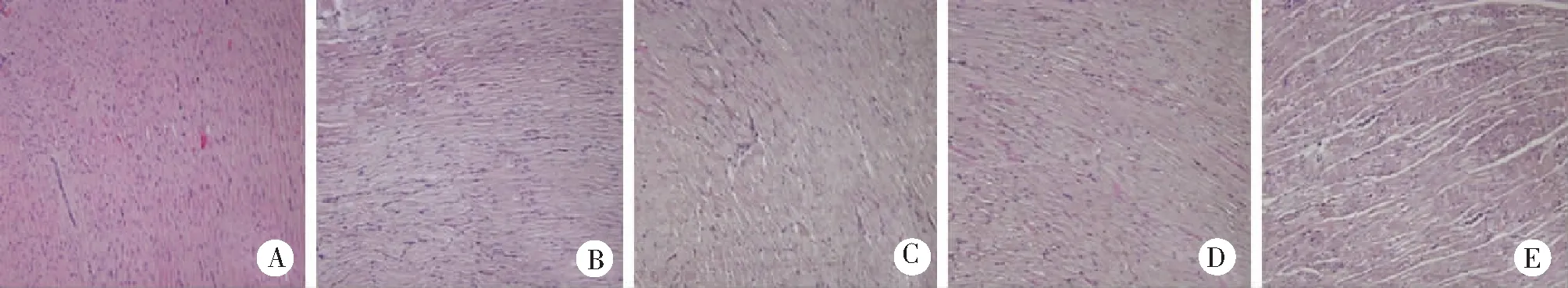
图2 5组大鼠心肌组织病理变化(HE ×200)
3 讨论
高原缺氧能使体内红细胞增多,引起血液循环障碍,其中尤以血液黏度为重要变化指标[5]。血液黏度的低与高代表循环功能的优与劣或血液供应的多与少,血液黏度增加,循环阻力升高,血流速度减慢,必然导致器官和组织的血液灌流量下降,造成缺血缺氧,影响组织的代谢和功能,从而产生高原反应[6-7]。血液流变学分析是评价机体血液流动和细胞变形,血液与血管和心脏之间相互作用的主要方法。因此,通过血液流变学检测,能对高原病的发生、发展、转归以及预后提供可靠的依据。

本组实验发现,大鼠全血黏度均有显著性升高,表明缺氧会增加血液黏度,雌鼠血浆黏度无显著性变化而卡松黏度和屈服应力有显著升高,其原因可能是由红细胞增多及变形引起的[8];而雄鼠血浆黏度、卡松黏度和屈服应力均有显著升高,表明除红细胞增多及变形外血浆蛋白和血脂可能升高[9]。雄鼠血液黏度比雌鼠升高更明显,可能与激素水平有差异相关。因此,对高原缺氧人群及时及早发现在血液流变学异常的可逆阶段,并及时降低血液黏稠度,减少红细胞,可以逆转此过程,阻止疾病进一步发展,对男性而言尤其重要。
脑和心肌组织是对氧最为敏感的两大器官,本实验HE染色结果显示,正常大鼠脑和心肌组织结构正常,无明显病理改变。而各缺氧组大鼠的脑组织有明显的细胞核固缩,细胞间隙明显增大,组织空泡增多;心肌组织疏松水肿,血管扩张,毛细血管增多,炎性细胞浸润。均随缺氧时间增加而愈发严重。表明高原缺氧会造成组织病理学改变,损伤机体器官功能。
在高原缺氧的发生发展过程中,氧化应激和能量代谢的作用至关重要。机体在高原缺氧条件下产生大量ROS,ROS能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化反应,形成脂质过氧化物MDA,具有细胞毒性,能引起细胞代谢及功能障碍,甚至死亡[10-11]。MDA含量可反映体内脂质过氧化反应程度,间接提示细胞损伤程度。而SOD和CAT是体内天然存在的自由基清除物质,对氧化与抗氧化平衡起至关重要的作用。GSH-PX能特异性催化GSH对氢氧化物的还原反应,其活力的升高有利于机体清除ROS和保护机体组织细胞结构和功能的完整性[12-14]。结合实验结果,各缺氧组大鼠脑组织中MDA含量随着缺氧时间的延长显著增加,SOD、CAT、GSH-PX水平随着缺氧时间的延长均明显降低。表明高原缺氧使抗氧化酶活力降低,脂质过氧化反应增加,机体氧化与抗氧化平衡受到破坏,导致细胞膜基本结构改变,进一步影响细胞功能,致使细胞损伤甚至死亡,从而破坏脑组织功能,影响认知。
机体的主要能量供应是ATP,在高原缺氧环境下,体内ATP含量降低,造成能量供应不足,引发疲劳感[15]。NO是血管内皮舒张因子,NOS是NO合成的限速酶。低氧时脑组织产生强烈的脂质过氧化反应,降低NOS活性,同时NO的合成和释放减少,最终导致血管收缩增强,脑动脉压升高[16]。本实验结果显示,在缺氧条件下,Na+-K+-ATP酶活性先降低后恢复,其中雌鼠较雄鼠降低更明显,可能与激素有关;NO含量和NOS活力均有显著性下降,且雄鼠下降更加明显,表明雄鼠可能血管收缩更为显著,出现高原头痛症状的可能性更大。
综上所述,高原缺氧可引起脑和心肌组织损伤,可能是由血液黏稠和氧化应激反应引起的。且雌鼠和雄鼠在指标上具有一定差异,这可能与雌激素具有扩张血管、抗炎、抗氧化的作用有关。其具体损伤机制有待于进一步深入研究。
