探讨干酪乳杆菌对胃癌大鼠的抗肿瘤作用及其免疫学机制研究
2018-12-26王允野
张 丹,王允野
(吉林医药学院附属医院,吉林 132013)
胃癌是常见的恶性肿瘤之一,其发病率长期居于恶性肿瘤第4位,死亡率居消化道恶性肿瘤第1位[1]。胃癌的发生发展由多个系统共同调控,其中免疫学调控与其关系密切[2]。胃癌的免疫学疗法是除手术切除、放化疗外的重要辅助治疗手段之一,通过特异性或非特异性免疫疗法激活机体免疫系统,进而抑制肿瘤细胞增殖。研究发现,干酪乳杆菌作为益生菌,具有增强免疫力、抗肿瘤等多种作用[3]。已有研究证实,干酪乳杆菌可通过调节外周血免疫球蛋白及淋巴细胞生成,激活机体体液免疫和细胞免疫,进而抑制肝癌、乳腺癌的发生发展[4-5]。但目前关于干酪乳杆菌对胃癌的抑制作用报道较少。鉴于此,本研究特设置对照实验,观察干酪乳杆菌对胃癌大鼠肿瘤生长状况及免疫功能的影响,并探讨其免疫学作用机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF级雄性SD大鼠50只,5周龄,体重140~150 g,购于上海复旦大学实验动物科学部[SCXK(沪)2014-0004],大鼠饲养于吉林大学基础医学院动物实验中心[SYXK(吉)2016-0001],动物实验伦理审批号IACUC 20161022003。动物实验过程中遵循实验动物3R原则。
1.1.2 菌株
Lactobacilluscasei干酪乳杆菌,购于中国工业微生物菌种保藏管理中心,编号:CICC20282。
1.2 主要试剂与仪器
N-甲基-N-硝基-亚硝基胍(MNNG,Fluka公司,批号20160310),RPMI1640细胞培养液(赛默飞公司,批号NVE0268),人外周血淋巴细胞分离液(Ficoll,Solarbio公司,批号P8900-200),抗大鼠异硫氰酸荧光素(Fluorescein isothiocyanate,FITC,批号:20140526)-CD3+/藻红蛋白(Phycoerythrin,PE)-CD4+(批号:20150311)、FITC-CD3+/PE-CD8+双标抗体及FITC-CD11b/c+(批号:20140738)(Biolegend公司),鼠抗兔Toll样受体4(TLR4,批号:20150814)、核转录因子κB(NF-κB,批号:20150201)p65(一抗,批号:20151108),羊抗鼠TLR4(批号:20150625)、NF-κB p65(批号:20150837)(二抗)(Abcam公司);FACS Calibur型流式细胞仪(美国BD公司),OmniPAGEMaxi Plus 电泳仪(Cleaver公司),SM2010R徕卡切片机(Leica公司)。
1.3 实验方法
1.3.1 模型构建及分组
50只SD雄性大鼠适应性喂养7 d后,简单随机化法分为5组:对照组、模型组、干酪乳杆菌低、中、高剂量组,每组10只。模型组及3剂量组大鼠给予MNNG浓度为100 μg/mL的饮用水(酒精助溶,使用前配置,饮水瓶避光放置),持续给予28周,建立大鼠胃癌模型,之后改为正常饮用水;对照组给予酒精水溶液,28周后换用正常饮用水。3个剂量组分别灌胃给予4、8、12 mL/kg干酪乳酸菌,模型组和对照组灌胃给予10 mL/kg无菌蒸馏水,每天1次,持续8周。实验过程中若大鼠死亡,则自动补充同期饲养及同步干预的大鼠入组。
1.3.2 病理组织学观察
末次灌胃6 h后,引颈处死大鼠,取胃部放入4%中性甲醛固定(确保胃内外充满甲醛固定液),组织修剪后,酒精梯度脱水然后用石蜡包埋,制作石蜡切片。经脱蜡、水化后,采用常规苏木精-伊红染色法(HE)进行染色,并用中性树胶封片,显微镜下观察。
1.3.3 胸腺指数、脾指数
末次灌胃6 h后,引颈处死大鼠,剥离完整的胸腺和脾脏组织,称重。脾脏指数=脾脏质量/体质量×100%;胸腺指数=胸腺质量/体质量×100%。
1.3.4 外周血和肿瘤组织中自然杀伤性细胞(natural killer cell,NK)细胞及T淋巴细胞亚群水平检测
末次灌胃6 h后,取大鼠腹腔静脉血1 mL,肝素抗凝后放入测试管。取新鲜胃癌组织1.0 g放入RPMI1640细胞培养液中,随即研磨制成单细胞悬液,然后采用淋巴细胞分离液密度离心法制备淋巴细胞悬液,按照1∶3体积比加入10%福尔马林PBS溶液保存,分别加入抗TCRαβ+-FITC/抗CD161a+-PE、抗CD3+-FITC/抗CD4+-PE、抗CD3+-FITC/抗CD8+-PE,对照组设立单染对照,严格根据说明书步骤操作,采用双色流式细胞术检测NK细胞活性(TCRαβ+CD161a+)及T淋巴细胞亚群CD4+、CD8+及CD4+/CD8+。
1.3.5 胃癌组织中TLR-4、NF-κB p65蛋白相对表达量检测
取大鼠新鲜胃癌组织,采用蛋白提取试剂盒步骤检测总蛋白并进行蛋白定量。每孔上样15 μg,十二烷基硫酸钠聚丙烯酰氨凝胶电泳(SDS-PAGE)电泳分离,4℃电转90 min转膜,然后用5%脱脂牛奶封闭2 h,加入按比例稀释的一抗孵育2 h(室温),吸出1抗后加入二抗(1∶10 000),常温孵育1 h,重复洗涤后在暗室中曝光和显影,待胶片晾干后扫描拍照,采用gle pro 4.0图像分析工具进行分析,以TLR-4、NF-κB蛋白灰度值与内参β-actin灰度值比值表示蛋白相对表达量。
1.4 统计学方法

2 结果
2.1 病理组织学观察
对照组前胃和腺胃黏膜下层无炎性细胞浸润,细胞层次明显、排列整齐;模型组前胃和腺胃黏膜下层可见炎性细胞浸润,鳞状上皮细胞角化明显,腺上皮细胞排列紊乱,呈现癌细胞;酪乳杆菌低、中、高剂量组前胃和腺胃黏膜下层炎性细胞减少,癌细胞数量减少,其中中剂量组减少最为明显。结果见图1。
2.2 胸腺指数、脾指数对比
与对照组相比模型组胸腺指数、脾指数显著降低(P<0.01),与模型组相比干酪乳杆菌低、中、高剂量组胸腺指数均显著升高(P<0.05或P<0.01)。与模型组相比干酪乳杆菌低、中、高剂量组脾指数均未见显著性差异(P>0.05)。结果见表1。
2.3 外周血NK细胞及T淋巴细胞亚群对比
与对照组相比模型组外周血中TCRαβ+CD161a+、CD4+及CD4+/CD8+显著减少(P<0.01),与模型组相比干酪乳杆菌低、中、高剂量组外周血中TCRαβ+CD161a+、CD4+及CD4+/CD8+均显著增加(P<0.01)。与对照组相比模型组外周血中CD8+显著增加(P<0.01),与模型组相比干酪乳杆菌低、中、高剂量组外周血中CD8+均显著减少(P<0.01)。结果见图2、表2。
2.4 肿瘤组织中NK细胞及T淋巴细胞亚群水平对比
与对照组相比模型组肿瘤组织中TCRαβ+CD161a+、CD8+显著减少(P<0.01),与模型组比较干酪乳杆菌低、中、高剂量组肿瘤组织中TCRαβ+CD161a+均显著增加(P<0.05)。与模型组比较干酪乳杆菌低、中剂量组肿瘤组织中CD8+均显著增加(P<0.05或P<0.01)。与对照组相比模型组肿瘤组织中CD4+、CD4+/CD8+显著增加(P<0.05),与模型组比较干酪乳杆菌低、中、高剂量组肿瘤组织中CD4+、CD4+/CD8+均显著减少(P<0.05)。结果见表3。
2.5 肿瘤组织中TLR-4、NF-κB p65蛋白相对表达量对比
与对照组相比模型组肿瘤组织中TLR-4、NF-κB p65蛋白相对表达量显著升高(P<0.01),与模型组比较干酪乳杆菌低、中、高剂量组肿瘤组织中TLR-4、NF-κB p65蛋白相对表达量均显著降低(P<0.01)。结果见图3、表4。

注:A~E为前胃,a~e为腺胃;A、a为对照组,B、b为模型组,C、c为低剂量组,D、d为中剂量组,E、e为高剂量组。图1 前胃和腺胃粘膜病理切片(HE染色,×200)Note. A-E: Pregastric stomach. a-e: Gland stomach. A,a: Control group. B,b: Model group. C,c: Low dose group. D,d: Middle dose group. E,e: High dose group.Figure 1 Pathological changes of the mouse pregastric and glandular gastric mucosa (HE Staining)
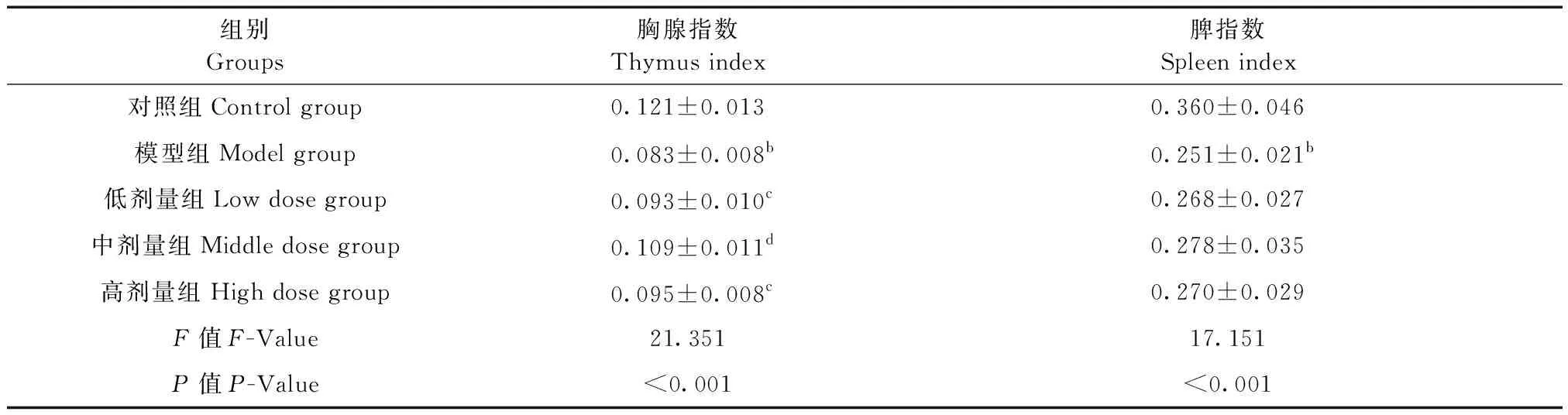
组别Groups胸腺指数Thymus index脾指数Spleen index对照组Control group0.121±0.0130.360±0.046模型组Model group0.083±0.008b0.251±0.021b低剂量组Low dose group0.093±0.010c0.268±0.027中剂量组Middle dose group0.109±0.011d0.278±0.035高剂量组High dose group0.095±0.008c0.270±0.029F值F-Value21.35117.151P值P-Value<0.001<0.001
注:与对照组比,aP<0.05,bP<0.01;与模型组比,cP<0.05,dP<0.01,自由度(4,45)。
Note. Compared with the control group,aP<0.05,bP<0.01. Compared with the model group,cP<0.05,dP<0.01, df (4,45).

表2 外周血NK细胞及T淋巴细胞亚群对比Table 2 Comparison of peripheral blood NK cells and T lymphocyte subsets in the mice
注:与对照组比,aP<0.05,bP<0.01;与模型组比,cP<0.05,dP<0.01,自由度(4,45)。
Note. Compared with the control group,aP<0.05,bP<0.01. Compared with the model group,cP<0.05,dP<0.01, df (4,45).

表3 肿瘤组织中NK细胞及T淋巴细胞亚群水平对比Table 3 Comparison of NK cells and T lymphocyte subsets in tumor tissues of the mice
注:与对照组比,aP<0.05,bP<0.01;与模型组比,cP<0.05,dP<0.01,自由度(4,45)。
Note. Compared with the control group,aP<0.05,bP<0.01. Compared with the model group,cP<0.05,dP<0.01, df (4,45).

注:A:对照组,B模型组,C低剂量组,D中剂量组,E高剂量组。图2 外周血中T淋巴细胞流式图Note. A: Control group. B:Model group. C: Low dose group. D:Middle dose group. E: High dose group.Figure 2 Flow cytometric analysis of T lymphocytes in peripheral blood of the mice

图3 蛋白免疫印迹图Figure 3 Western blot of the protein experssions
3 讨论
胃癌的病因及发生机制十分复杂,目前仍未完全阐明,多种因素均可诱发胃癌[7]。近年来研究发现[8],机体的胃癌的发生与胃癌细胞的免疫逃逸机制有关,在正常生理状态下,免疫细胞可对癌变细胞进行及时清除,当病理状态下,机体免疫力下降,癌变细胞未引起免疫应答,则易引发肿瘤。有学者认为,在抗肿瘤免疫应答过程中,细胞免疫较体液免疫发挥更重要作用,当机体T淋巴细胞亚群数量减少、活化功能障碍时,可导致免疫抑制,对胃癌患者的治疗预后产生严重影响[9]。

表4 肿瘤组织中TLR-4、NF-κB p65蛋白相对表达量对比Table 4 Comparison of relative protein expression of TLR-4 and NF-κB p65 in the tumor tissues
注:与对照组比,aP<0.05,bP<0.01;与模型组比,cP<0.05,dP<0.01,自由度(4,45)。
Note. Compared with the control group,aP<0.05,bP<0.01. Compared with the model group,cP<0.05,dP<0.01, df (4,45).
胸腺为机体的重要淋巴器官,是T细胞分化、发育、成熟的场所,其还可以分泌胸腺激素[9]。整个淋巴器官的发育和机体免疫力都必需有T淋巴细胞,胸腺素可使由骨髓产生的干细胞转变成T细胞,因而有增强细胞免疫功能的作用。胸腺素能连续诱导T细胞分化发育的各个阶段,还能增强成熟T细胞对抗原或其它刺激的反应,恶性肿瘤也有一定疗效。脾也是重要的淋巴器官,当血液中出现病菌、抗原、异物、原虫时,脾脏中的巨噬细胞、淋巴细胞就会将其吃掉。本研究中干酪乳杆菌低、中、高剂量组胸腺指数与模型组相比显均显著升高,而干酪乳杆菌低、中、高剂量组脾指数均未见显著性差异。说明干酪乳杆菌对胃癌的作用可能与胸腺诱导分化的T淋巴细胞免疫相关。
成熟T细胞表面具有特异性识别抗原并与之结合的分子结构TCR受体。外周淋巴器官中大多数成熟T细胞的TCR分子,由α链和β链经二硫键连接的异二聚体分子TCR-2细胞完成。现在已经命名了CD1—CD166共180个分化抗原群,其中CD4和CD8是区分成熟T细胞亚群的主要表面标志[10]。成熟的T细胞经血流分布至外周免疫器官的胸腺依赖区定居,发挥细胞免疫功能,是身体中抵肿瘤形成的“斗士”。CD4细胞又称为免疫系统的辅助手,CD4+T细胞受到刺激增殖分化为TH0,受不同种白细胞介素促进后分化为TH1和TH2型,TH1型主要参与细胞免疫,TH2型主要参与体液免疫[11-12]。CD8是T淋巴细胞的一个亚群,被称为T细胞毒细胞。CD8起源于骨髓,在胸腺内成熟,成熟后在随着淋巴循环到达全身各处。细胞毒性T细胞和CD8表面蛋白被称为CD8+T细胞。本研究表明干酪乳杆菌可使胃癌大鼠模型外周血中TCRαβ+CD161a+、CD4+及CD4+/CD8+均显著增加,外周血中CD8+均显著减少。干酪乳杆菌可使胃癌大鼠模型肿瘤组织中TCRαβ+CD161a+、CD8+显著增加,肿瘤组织中CD4+、CD4+/CD8+均显著减少。
TLR4由三个区域构成,分别为胞外区、跨膜段和胞内区,其主要分布于C1D4呈阳性的单核细胞和巨噬细胞上[13]。TLRs介导的先天性免疫细胞反应,可以介导炎症修复中所满足肿瘤发生的多种特性,越来越多的证据证明肿瘤相关的炎症反应通过帮助始肿瘤细胞获取特异抗免疫能力,进而增加肿瘤的发生和发展。胃癌前病变大部分伴有幽门旋杆菌感染主要的病理变化。TLR4基因的多态性导致机体固有的免疫遗传变异,与胃癌前病变形成相关TLR4表达于胃癌及癌前病变的细胞中,激活如IL8这样的胃癌发生健进因子,增加了胃癌发生的风险。NF-κB作为早期转录因子,其激活不需要新翻译出的蛋白进行调控。因此,NF-κB可以在第一时间对有害细胞的刺激做出反应[14-15]。大多数的细菌可以结合细胞膜表面的TLRs受体,从而激发NF-κB信号通路改变基因的表达。研究已经表明LPS可以通过TLR4激活下游NF-κB信号通路[16]。本研究表明干酪乳杆菌可使胃癌大鼠模型肿瘤组织中TLR-4、NF-κB p65蛋白相对表达量均显著降低,根据结果可以推测干酪乳杆菌可能能够下调TLR-4、NF-κB p65蛋白表达,并对TLR-NF-κB信号通路的传导发挥抑制作用激活机体的免疫功能,进而增强对恶性肿瘤细胞的免疫杀伤活性,避免恶性肿瘤细胞逃避免疫监视。有国外研究报道[17],在干酪乳杆菌被机体吸收过程中,细胞壁破裂形成病原相关分子模式,激活机体免疫应激反应,与本研究结果相一致。
综上所述,干酪乳杆菌可调节胃癌大鼠肿瘤组织和外周血中T淋巴细胞、NK细胞活性,进而抑制肿瘤生长、增强机体免疫调节,其作用机制可能是通过下调TLR-4、NF-κB p65蛋白表达,抑制TLR-NF-κB信号通路发挥作用,其中8 mL/kg的干酪乳杆菌作用效果最佳。本研究重点探讨了干酪乳杆菌的辅助抗胃癌肿瘤作用及其免疫学调控机制,能够为胃癌患者的临床治疗方案的探讨提供线索,意义重大,但是其在临床实践中应用是否具有可行性尚需深入研究。
