MC38-luc稳转细胞株的构建及在小鼠结肠癌肝转移模型中的应用
2018-12-25林怡婷林雨虹朱艳阳张秋玉
林怡婷, 林雨虹, 阮 梅, 朱艳阳, 张秋玉,2
结直肠癌是常见的恶性肿瘤,其发病率逐年增加。2015年美国《临床医师癌症杂志》公布的研究报告显示,2000-2011年,我国结肠癌的发病率和死亡率已跃居恶性肿瘤第5位[1]。肝脏是结肠癌最常见的转移部位,肝转移是结肠癌患者最主要的死因,肝转移患者的平均生存期仅为4~7月[2-3]。有关结肠癌肝转移的作用机制尚不明确。既往用于研究结肠癌肝转移的动物模型多采用免疫缺陷的小鼠进行荷瘤。这些模型存在T或B细胞功能缺陷,无法用于分析转移灶组织免疫微环境的改变及探讨免疫治疗措施的疗效[4]。本研究首先构建并筛选具有稳定表达萤火虫荧光素酶(firefly luciferase, FLuc)的小鼠结肠癌细胞(MC38-luc);其次,通过脾内注射途径建立小鼠结肠癌肝转移模型,应用小动物活体成像技术实时观察小鼠结肠癌细胞发生肝转移过程。该研究结果将为后续深入探讨结肠癌肝转移的免疫学机制及免疫治疗策略奠定一定的实验基础。
1 材料与方法
1.1材料
1.1.1动物 6~8周龄雌性C57BL/6小鼠,体质量20~22 g[上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2012-0002],饲养于福建医科大学实验动物中心,动物伦理审查号为2017-031。
1.1.2细胞系及试剂 MC38小鼠结肠癌细胞为本实验室长期保存细胞系;pGL4.50-luc2/CMV/Hygro质粒及荧光素酶报告基因检测试剂盒(美国Promega公司);Lipofectamine 2000转染试剂(美国Invitrogen公司);无内毒素质粒中量抽提试剂盒(北京天根生化技术研究所);D-luciferin(美国Perkin Elmer公司);RPMI 1640培养液及添加剂、LB培养基、潮霉素、氨苄青霉素和水合氯醛(美国Sigma公司);H-E染色液(南京建成科技有限公司)。
1.1.3仪器 紫外分析仪(UV-1000,美国Thermo公司);多功能酶标仪(SpectraMax i3,美国Molecular Devices公司);小动物活体成像仪(IVIS Lumina XRMS Series III,美国Perkin Elmer公司);小动物麻醉机(XGI-8,美国Caliper公司);石蜡切片机(RM2235,德国Leica公司);ECLIPSE 90i正置生物显微镜(BX53,日本Olympus公司);成像分析软件(Qcapture Pro7.0,美国Qimaging公司)
1.2方法
1.2.1小鼠结肠癌细胞系体外培养 复苏液氮保存的MC38细胞及新构建的MC38-luc细胞株,加入含10%胎牛血清的RPMI 1640培养基,置于37 ℃、体积分数为0.05的CO2培养箱中培养,每隔1天换液传代,传代至3~6次,即可用于转染或体内实验。
1.2.2MC38-luc稳定细胞株的构建 取对数生长期MC38细胞接种于24孔板中,密度为每孔3×105个,次日细胞密度达到90%。按照Lipofectamine 2000的说明书,用50 μL Opti-MEM稀释1 μL的转染试剂及0.6 μg的pGL4.50质粒,室温静置5 min后轻轻混匀;混合液室温放置20 min,加入含0.4 mLOpti-MEM的细胞中,转染4 h后换成完全培养基,于37 ℃、体积分数为0.05的CO2中常规培养。前期用不同浓度梯度的潮霉素(50~500 μg/mL)作用于MC38细胞,确定MC38细胞的最佳筛选浓度为150 μg/mL。细胞转染48 h后,将细胞转移到10 cm培养皿中,加入潮霉素至终浓度为150 μg/mL,根据细胞生长情况,每1~3 d更换1次含150 μg/mL潮霉素的培养基。筛选2周后,通过胰酶滤纸片克隆消化法挑取克隆,转移至24孔板扩大培养并进行荧光素酶活性的测定。选取表达量高的MC38细胞克隆,通过有限稀释法筛选稳定表达荧光素酶的亚克隆细胞株,扩大培养后行体内模型构建。
1.2.3单克隆细胞株的FLuc活性测定 按照荧光素酶报告基因检测试剂盒说明,从每个待测定的单克隆细胞株中取5×105个细胞,用PBS洗涤并离心,弃上清,细胞沉淀各加入100 μL细胞裂解液(PLB Lysate),避光裂解20~30 min后,13 000 r/min下离心5 min,收集上清。取10 μL上清液至96孔板中,加入50 μL LARⅡ,避光混匀,多功能酶标仪检测FLuc活性,判断阳性细胞克隆及表达荧光素酶的能力。选取不同克隆的阳性细胞5×105个进行腹腔注射,以未转染的细胞作为正常对照,每组3只小鼠,在接种后每隔4~6 d经腹腔注射荧光素酶底物后,通过活体成像系统观察细胞表达荧光素酶的变化。
1.2.4脾内注射途径构建结肠癌肝转移模型 取对数生长期的MC38-luc细胞,消化后用PBS调成细胞密度为1×107mL-1。参照文献[5]的方法,将C57BL/6小鼠麻醉(腹腔注射5%水合氯醛150 μL),固定小鼠呈右侧卧位;左侧腋中线与腋后线间,取5 mm切口开腹,用消毒棉签拉出脾脏至切口外;用4号针头吸取细胞悬液,从脾上极进针,保持针头在脾包膜下平推深度约1.5 cm,边退边缓慢注入肿瘤细胞50 μL(5×105个细胞),可见注射部位的脾脏被膜变白及肿胀;轻轻拔出针头,用脱脂棉球按压针眼处,同时轻轻按揉脾脏至少5 min,促使肿瘤细胞进入脾静脉;查看针眼处无出血,将脾脏放回原位,全层缝合腹壁。术后继续在SPF条件下饲养,次日观察小鼠状态,每隔4~6 d行活体成像检测。
1.2.5肝脾组织H-E染色 用含有肝素的0.9% NaCl灌注心脏,待肝组织变为白色后,剪下含肿瘤组织的肝小叶,浸泡于10%甲醛溶液中,固定24 h;常规脱水,制作石蜡切片。通过H-E染色观察脾内原发灶及肝内转移灶肿瘤结节的分布情况。
1.2.6小动物活体成像检测 造模小鼠腹腔注射荧光素酶底物150 mg/kg,5~10 min后再用异氟烷麻醉,麻醉后小鼠置于Lumina Ⅲ操作台,固定小鼠呈仰卧位进行活体检测。

2 结 果
2.1稳定表达荧光素酶小鼠结肠癌细胞株的筛选 抗生素处理2周后,共挑取48个克隆,第一批测定了19个细胞克隆的荧光素酶活性,结果如图1A所示:有14个克隆存在不同水平荧光素酶表达,其中13号克隆的荧光素酶活性最高,为(13 406±734.5)。为了进一步确保阳性克隆细胞中荧光素酶呈稳定表达,对13号克隆细胞进行有限稀释亚克隆化处理。2块96孔板中共有36个克隆生长,第一批测定了13个细胞克隆的荧光素酶活性,结果如图1B所示:s19克隆细胞荧光素酶表达水平较低,为(303±19.8),s14及s27呈较高表达水平(19 623±1 286,22 733±1 857),其余克隆呈中等水平表达。
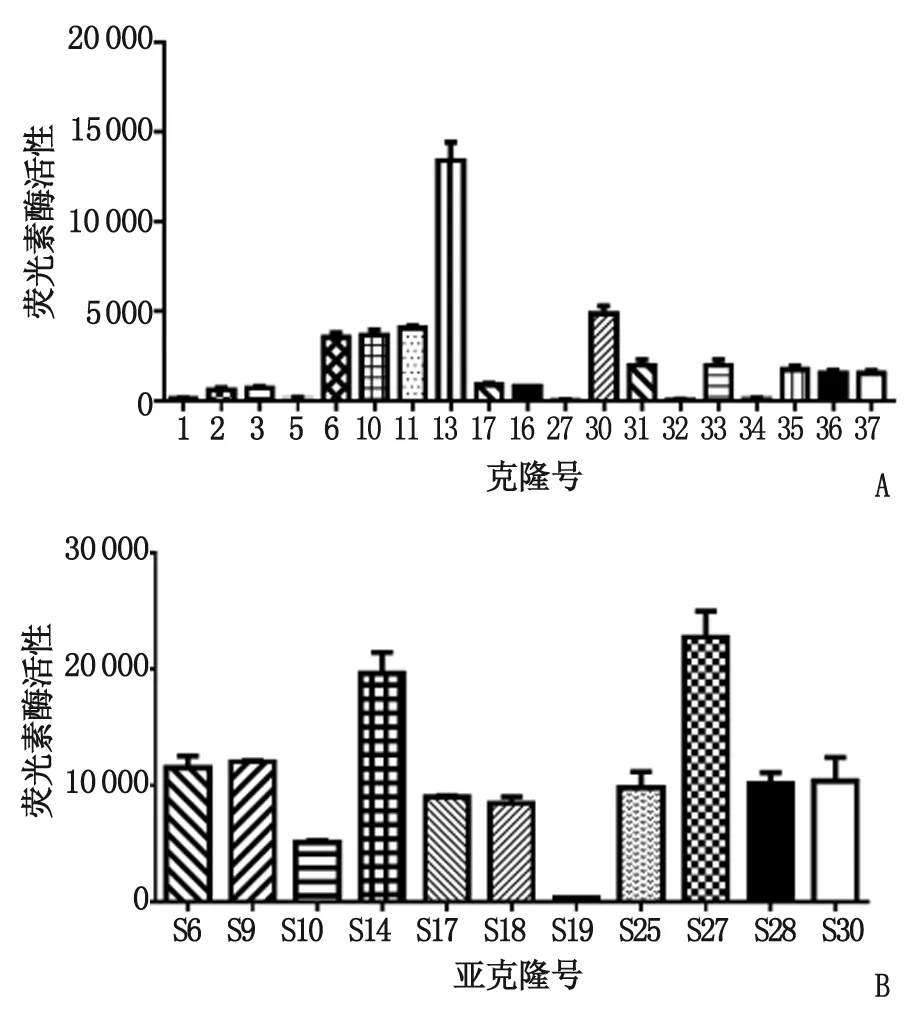
A:经抗生素筛选后的不同细胞克隆荧光素酶活性测定结果;B:13号细胞亚克隆处理后的不同细胞克隆荧光素酶活性测定结果.图1 转染pGL4.50质粒后MC38细胞克隆荧光素酶活性的测定及筛选Fig 1 Luciferase activity detection and positive clones selection of MC38 cell transfected with pGL4.50 plasmid
2.2小动物活体成像系统分析阳性克隆细胞在体内生长增殖能力 选择较高水平及中等水平表达荧光素酶的2个克隆s25及s27分别进行腹腔注射,接种后每隔4~6 d用Lumina Ⅲ进行小鼠肿瘤荧光素酶活性动态检测。由图2可见:随着时间推移,2个荧光素酶表达水平不同的MC38-luc细胞克隆在体内成像信号均不断提高,提示细胞在体内生长增殖能力正常。此外,s27克隆的信号递增速度较s25更显著。
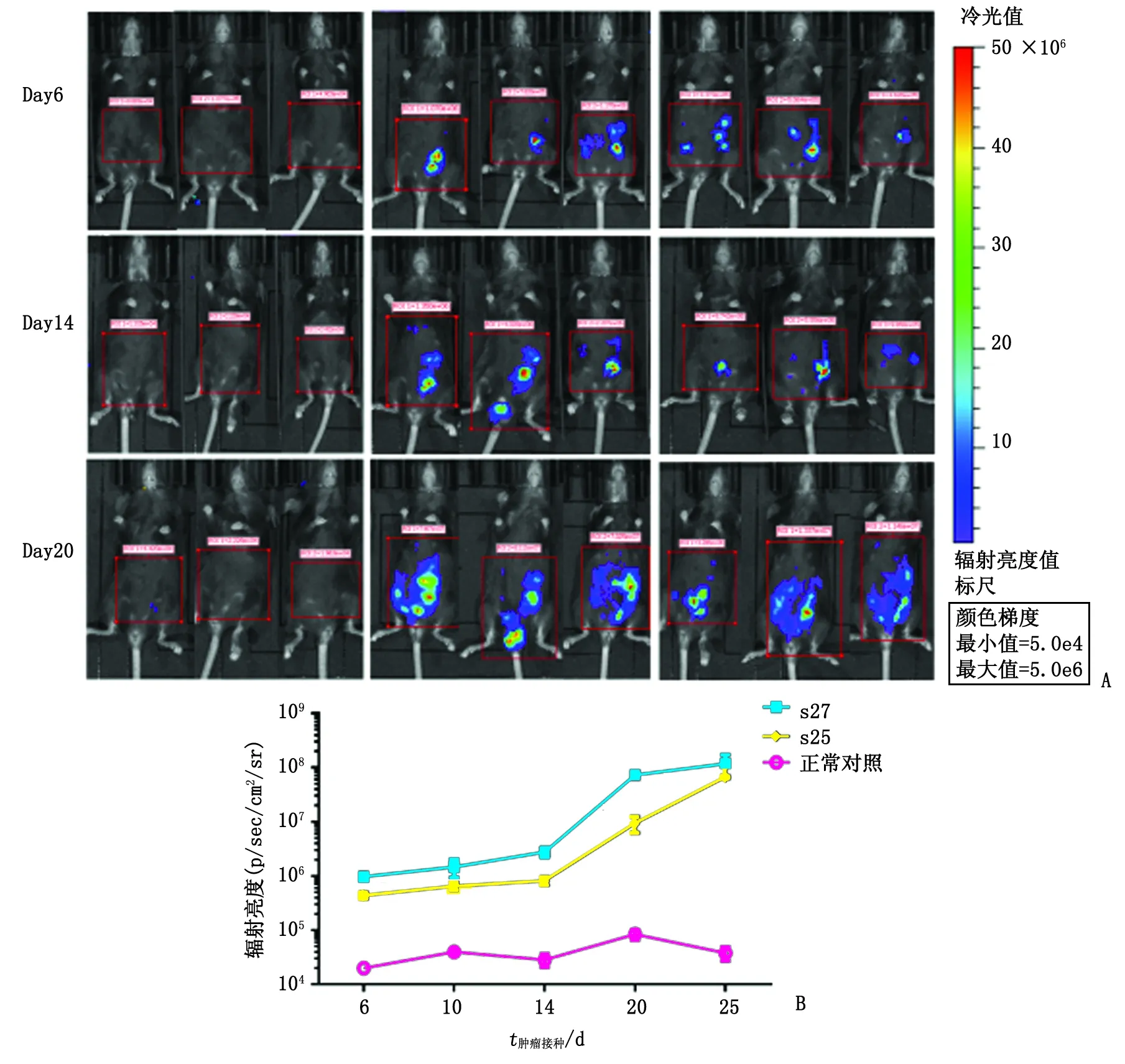
A:3组小鼠不同时间点的成像结果;B:成像信号.图2 腹腔接种不同克隆MC38-luc细胞后荧光素酶活性的测定Fig 2 Luciferase activity of MC38-luc cell evaluated in mice after intraperitoneal injection of s27 and s25 cell clones
2.3小动物活体成像系统监测小鼠结肠癌肝转移过程 选择s27细胞克隆,经脾内注射途径构建小鼠结肠癌肝转移模型,结果显示:所有造模的小鼠均存活,术后小鼠活动及摄食无影响,体质量无明显变化;在建模后第7天,体内活体成像检测结果显示,造模小鼠脾脏接种肿瘤细胞的部位及肝脏区域均显现荧光素酶活性,荧光素主要分布于肝脏的门静脉区域;在建模后第14天,脾及肝脏区域的荧光素酶活性明显增强,荧光素几乎分布于整个肝脏;在建模后第26天,肝脏的荧光素酶活性进一步增强并扩展到下腹部(图3)。
2.4结肠癌肝转移灶及脾原发灶的大体观察 分别于脾内接种MC38-luc细胞后的第7,14及26天处死小鼠,大体观察可见:所有造模小鼠脾内可见大小不一的肿瘤结节,脾内成瘤率为100%,26 d之后,整个脾脏几乎布满肿瘤结节,残存的正常脾组织较少;肝内的肿瘤结节首先出现在门静脉区,肝转移率83.3%(10/12),26 d之后,不同肝叶均可见大小不一的肿瘤结节,肝内肿瘤结节的大小及存在部位与相应时间节点体内活体成像技术测定的结果基本一致(图4)。
2.5结肠癌肝转移灶及脾原发灶的H-E染色分析 在建模后第14天取脾内及肝内肿瘤结节行H-E染色,结果显示:脾原位肿瘤结节生长迅速,正常的脾组织结构被破坏;肝内出现多个大小不一的肿瘤转移灶结节,主要围绕肝血窦分布,其肿瘤细胞紧密排列,细胞形态多样,核大而深染并可见核分裂(图5)。
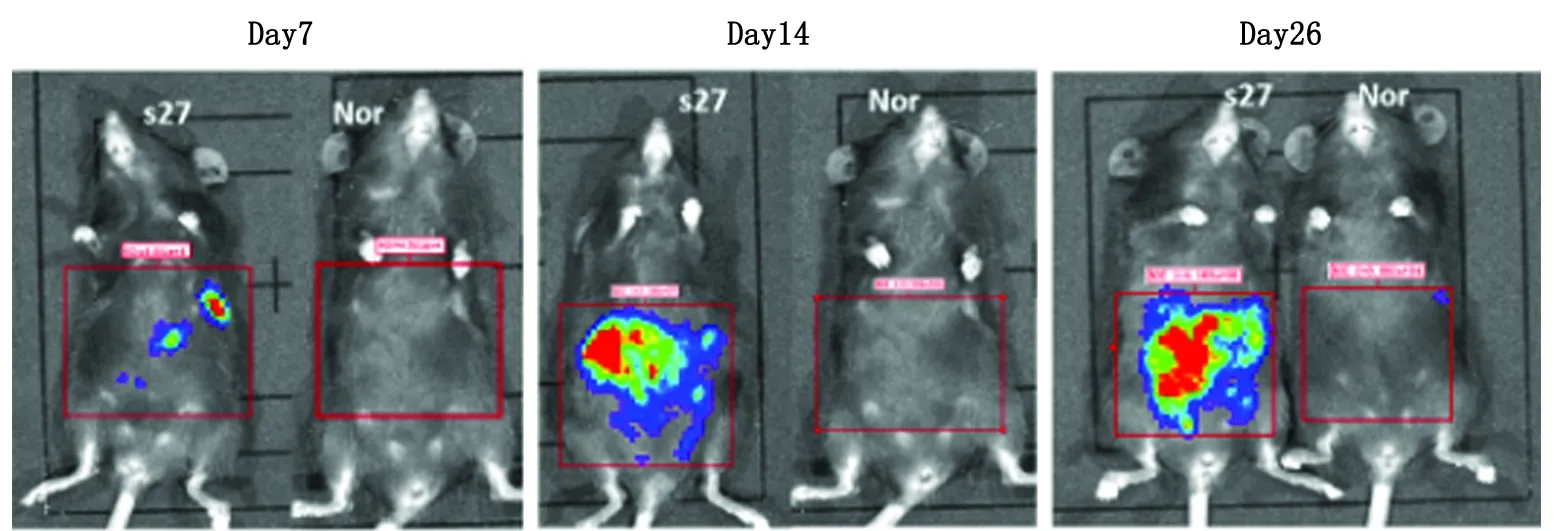
Nor:正常对照.图3 荧光素酶活性的活体成像技术监测小鼠结肠癌肝转移过程Fig 3 Luciferase imaging for hepatic metastasis foci of MC38-luc colon cancer

图4 MC38-luc细胞造模小鼠肝转移灶及脾组织的大体观察Fig 4 General observation of liver and spleen tissue from MC38-luc colon cancer hepatic metastases mice

图5 MC38-luc细胞造模小鼠脾脏及肝转移灶的H-E染色结果Fig 5 H-E staining of liver and spleen tissue from MC38-luc colon cancer hepatic metastases mice
3 讨 论
长期以来,结直肠癌被认为是免疫治疗效果欠佳的恶性肿瘤。2015年,Llosa等发现,基因错配修复(mismatch repair, MMR)突变导致的微卫星高度不稳定型(MSI-H)结直肠癌癌组织侵袭边缘有高水平PD-L1表达及更多CD4+T,CD8+T的浸润[6]。Diaz等也发现,抗PD-1抗体在MMR突变(dMMR)结肠癌患者中的客观反应率及疾病控制率均显著高于MMR正常(pMMR)的患者[7]。文献报道,抗PD-1抗体在治疗dMMR/MSI-H转移性结直肠癌患者中显示出了令人鼓舞的疗效,BRAF基因突变患者的客观缓解率达25%,显著高于常规化疗及靶向治疗患者[8]。这些结果引发研究者开始关注免疫治疗策略在转移性结直肠癌治疗中的应用。晚期结直肠癌患者常伴发肝转移,其机制复杂,涉及肝脏特殊的组织结构特点及肝内微环境基质细胞、免疫细胞和癌细胞的相互作用等多种因素[9]。影响结肠癌肝转移机制研究的最主要因素是缺乏有效的可操作性强的动物模型。既往结肠癌肝转移模型多采用免疫功能缺陷的小鼠进行构建,仅能用于观察化疗或靶向药物对肿瘤细胞生长或转移的抑制作用,无法评价免疫治疗相关药物的疗效。由于缺乏免疫功能正常小鼠结肠癌肝转移模型,很大程度上限制了结肠癌转移灶免疫微环境及不同免疫治疗方案作用机制的研究。本研究在免疫功能正常小鼠体内初步构建了结肠癌肝转移模型。
常用的小鼠结肠癌细胞株有MC38,MCA18,CT-26及CL25等,其中C57BL/6小鼠遗传背景的结肠癌细胞系有MC38及MCA18及SL4等,BALB/c遗传背景的结肠癌细胞系有CT-26等。其中MC38与CT-26属于高转移性小鼠结肠癌细胞。前期实验表明:(1)CT-26细胞对脂质体介导的质粒转染效率极低,而MC38呈现较高的转染率;(2)抗PD-1对MC38细胞小鼠荷瘤模型的治疗疗效显著高于CT-26细胞皮下荷瘤模型(结果未显示)。鉴于此,本研究选用MC38小鼠结肠癌细胞,将含有荧光素酶基因的质粒(pGL4.50-luc2)转入MC38细胞系。luc基因表达产物为FLuc,D-luciferin是荧光素酶的作用底物,通过酶促反应产生的荧光具有无毒、成像时间短及背景低等优点,可作为一种靶细胞的示踪剂[10]。Luciferase/luciferin系统是极其敏感的报告基因方法,通过Xenogen IVIS成像系统可以在活体动物体内实时观察标记细胞的生长及转移情况。小动物活体成像系统通过对发光信号的检测而追踪肿瘤的发生发展过程,包括观察癌细胞在接种局部的停留、监测转移灶最早出现的部位、比较原发灶和转移灶细胞生长速度等不同情况,从而对肿瘤的进展、转移机制及治疗效率的研究提供动力学数据[11-12]。
本研究通过抗生素筛选并结合亚克隆方法,获取稳定表达FLuc基因的MC38细胞系:先利用潮霉素筛选出高表达荧光素酶的单克隆细胞株(13号阳性细胞株);再通过亚克隆筛选方法获得多个稳定表达FLuc的细胞克隆。结果可见,在第一轮抗生素筛选后获取的13号细胞克隆中,并非所有细胞稳定表达荧光素酶基因。由于转染后抗生素筛选过程中,质粒载体是随机整合在细胞染色体上,有些细胞虽然整合了外源质粒,但整合位置不稳定,通过DNA修复可导致整合的荧光素酶基因失活,但保留抗性基因。该结果表明,抗生素与亚克隆序贯筛选方案能极大提高筛选阳性克隆的概率,且确保筛选所得的阳性克隆稳定表达外源导入的目的基因。本研究最后选取中等及高水平表达的2个亚克隆细胞株s25号及s27进行腹腔注射荷瘤。小动物活体成像系统显示,在体内生长增殖能力正常且s27克隆的荧光信号递增速度较s25更显著。因此,选择s27细胞克隆用于构建结肠癌肝转移小鼠模型。
目前,在免疫功能正常小鼠体内构建结肠癌肝转移模型常用的方法有脾内注射法、门静脉注射法、肝内直接注射法、肠黏膜下原位注射法及盲肠原位造疝法等[13-16]。本研究采用脾内注射法构建小鼠结肠癌肝转移模型,造模后小鼠存活率达100%,肝转移率达83.3%。前期预实验时发现,注射肿瘤细胞时,保持针头在脾包膜下并适当按揉可有效提高肝转移率。小动物活体成像可在建模后7 d左右测到肝转移灶的荧光信号,在建模后14 d肝脏转移灶荧光素明显增强。活体成像荧光信号的出现和递增与肉眼下观察到肿瘤进展过程基本同步。H-E染色确证肝转移灶为多发结节且围绕肝血窦分布。由此可见,脾包膜下接种MC38-luc细胞是一种简单、有效、重复性好的结肠癌肝转移模型的构建方法。
本研究筛选了稳定高表达荧光素酶基因的MC38-luc小鼠结肠癌细胞株,通过脾内注射途径在免疫功能正常小鼠体内构建了结肠癌肝转移模型,通过活体成像技术观察到荧光素酶在小鼠肝内的递增过程。这些研究结果为后续深入研究小鼠结肠癌转移的免疫学机制及免疫治疗策略奠定了重要的细胞及动物模型基础。
