皮肤鳞状细胞癌细胞中BAG-1表达变化对细胞增殖、凋亡的影响及机制
2018-12-21张佳音钟咪饶美荣曾芬
张佳音,钟咪,饶美荣,曾芬
(无锡市第三人民医院,江苏无锡214041)
皮肤鳞状细胞癌(CSCC)是第二种最常见的非黑色素瘤皮肤癌,为老年人中常见的恶性肿瘤。近年由于人口老龄化和紫外线照射增加,其发病率不断上升[1]。CSCC患者手术预后较好,但是其早期较易被忽视,而晚期CSCC患者肿瘤浸润较深,常伴有淋巴结转移,增加了手术难度,预后较差[2,3]。目前,CSCC发生发展的确切分子机制仍然未知,且尚未有针对CSCC治疗的标准靶向治疗药物及靶点[4]。因此,研究CSCC发生发展的分子机制,进一步寻找CSCC新型生物标志物和治疗靶点,对于提高晚期CSCC患者生存率和改善生存质量具有重要意义。BAG-1是近年Cutress等[5]发现的与Bcl-2蛋白结合的一种新抗凋亡基因,其可以通过与多种细胞靶蛋白相互作用发挥抗凋亡作用,而且通过调控多种信号通路参与细胞的转录、增殖、迁移[6,7]。研究发现,Bcl-2结合抗凋亡基因1(BAG-1)在正常组织中不表达或低表达,而在食管癌、胃癌等多种肿瘤中高表达,并且其高表达与肿瘤细胞的发生发展密切相关[8,9]。皮肤黑色素瘤中BAG-1高表达,可促进细胞增殖和抑制细胞凋亡[10],但是BAG-1在CSCC中的表达情况及其对细胞增殖和凋亡的影响未见报道。2016年10月~2017年12月,本研究以CSCC细胞株A431以及人正常永生化上皮细胞Hecate为研究对象,旨在研究BAG-1在CSCC细胞系增殖和凋亡中发挥的作用及机制,为发现CSCC基因治疗靶点提供实验依据。
1 材料与方法
1.1 材料 细胞:人CSCC细胞系A431和人正常永生化上皮细胞Hecate均购自美国ATCC细胞库。细胞培养在37 ℃、5% CO2全湿度培养箱中,A431培养基为10%胎牛血清(FBS)的RPMI1640,Hecate培养基为10% FBS的DMEM-高糖。DMEM-高糖培养基、RPMI1640培养基、FBS购自美国Gibco公司,MTS细胞增殖检测、细胞周期检测试剂盒、细胞凋亡检测试剂盒、蛋白裂解试剂购自南京凯基生物技术有限公司,逆转录试剂盒、SYBR实时荧光定量聚合酶链反应(qRT-PCR)试剂盒等均购自日本TaKaRa公司。BAG-1、内参GAPDH引物由上海捷瑞生物工程有限公司设计合成,TRIzol购自美国Invitrogen公司,兔抗人BAG-1抗体(ab32109)、兔抗人E3泛素连接酶鼠双微基因2(Mdm-2)抗体(ab170880)、鼠抗人p53抗体(ab26)、鼠抗人Bax抗体(ab32503)、鼠抗人p21抗体(ab109520)、鼠抗人GAPDH抗体(ab8245)及BCA试剂盒购自美国Thermo公司。BAG-1敲减病毒由上海吉凯基因公司包装合成。
1.2 分组及处理 人CSCC细胞系A431细胞呈对数生长期时将细胞铺至六孔板,贴壁24 h后,按说明书将Ploybree与无有效序列的慢病毒空载体(对照组)及BAG-1抑制慢病毒载体(抑制组)感染至细胞中,放至培养箱中培养,12~16 h更换新鲜培养基。
1.3 细胞中BAG-1 mRNA表达的检测 采用qRT-PCR法。采用TRIzol法裂解细胞提取总RNA。将RNA逆转录成cDNA,并进行荧光定量PCR。引物序列:BAG-1: F:5′TGAGAAGCACGACCTTCATGT3′, R: 5′GGAACCCCTATGACCTCTTCA3′;GAPDH:F: 5′ GGAGCGAGATCCCTCCAAAAT3′, R: 5′GGCTGTTGTCATACTTCTCATGG3′。以GAPDH为内参基因。每个样品设置3个反应复孔,按两步法进行反应,94 ℃变性,65 ℃左右退火与延伸,分析各样品的循环阈值(Ct),用2-ΔΔCt法分析各组实验数据。重复实验3次。
1.4 细胞增殖活力的检测 采用MTS法。感染病毒72 h后的各组细胞以每孔1 500个细胞、150 μL培养基接种于96孔板中,每组设6个平行复孔,放至培养箱中培养,分别在铺板后第0、1、2、3、4天,各孔加入MTS工作液30 μL,培养箱中孵育2 h后,扫描酶标仪490 nm波长处测吸光度(OD值)。
1.5 细胞克隆形成能力的检测 采用细胞克隆增殖试验。收集感染病毒72 h后的各组细胞以每孔200个细胞、2 mL培养基接种于6孔板中,每组设3个平行复孔,放至培养箱中培养,培养2周左右,肉眼观察到克隆团时,弃掉培养基,PBS洗3次,甲醇固定15 min,晾干后加入苏木素1 mL染色30 min,双蒸水冲洗后晾干,扫描拍照,计数肉眼可见克隆团。
1.6 细胞周期的检测 采用流式细胞术。收集感染病毒72 h后的各组细胞,每管6×105个细胞,PBS洗3次后,70%乙醇固定24 h,PBS洗2次后,加入PI染色工作液500 μL(PI储存液12.5 μL,RNase储存液5 μL,缓冲液482.5 μL),混匀后37 ℃温箱中避光孵育30 min。PBS洗1次后,流式细胞仪检测分析各周期细胞数。重复实验3次。
1.7 细胞凋亡率的测算 采用流式细胞术。用无EDTA的胰酶收集感染病毒72 h后的各组细胞,每管1×106个细胞,PBS洗3次后,加入染色工作液500 μL(Binding Buffer 490 μL, PI 5 μL,FITC 5 μL),混匀后避光室温孵育15 min。PBS洗1次后,流式细胞仪检测分析凋亡细胞百分数。重复实验3次。
1.8 细胞BAG-1、Mdm-2、p53、Bax和p21蛋白的检测 采用Western blotting法。感染病毒72 h后的各组细胞,每孔加入蛋白裂解液500 μL(蛋白酶抑制剂5 μL和磷酸酶抑制剂5 μL),超声裂解30 min,4 ℃、12 000 r/min离心30 min,将上清转移至新的EP管中,BCA试剂盒测蛋白浓度,煮沸变性后,每孔50 μg蛋白进行SDS-PAGE电泳,经湿转将蛋白转移至PVDF膜,8%脱脂牛奶封闭2 h,加入Mdm-2、p53、Bax和p21 一抗4 ℃孵育过夜,TBST洗3次后,二抗孵育室温孵育1.5 h,ELC化学发光法曝光条带,扫描拍照。蛋白条带灰度值采用Quantity One V4软件进行分析。结果重复3次。
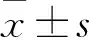
2 结果
2.1 细胞中BAG-1的表达比较 A431细胞、Hecate细胞中BAG-1 mRNA相对表达量分别为13.10±0.24、1.00±0.10,BAG-1蛋白相对表达量分别为8.54±1.13、1.00±0.10。A431细胞BAG-1 mRNA及蛋白相对表达量均高于Hecate细胞(P均<0.05)。抑制组A431细胞中BAG-1的相对表达量(mRNA 0.24±0.04,蛋白0.36±0.04)低于对照组(mRNA 1.00±0.10,蛋白1.00±0.10)(P均<0.05)。
2.2 各组细胞增殖活力的比较 与对照组相比,抑制组细胞增殖活力降低(P均<0.05)。见表1。
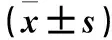
表1 两组不同时间细胞增殖活力比较
2.3 各组细胞克隆形成能力的比较 抑制组细胞细胞克隆团数目[(62.02±12.58)个]高于对照组[(263.11±15.28)个](t=12.410,P=0.028)。
2.4 各组不同细胞周期分布及细胞凋亡率比较 两组细胞周期分布比较差异有统计学意义(F=15.24,P=0.013)。与对照组比较,抑制组G1期细胞百分比高,S期及G2期细胞百分比低(P均<0.05),细胞凋亡率升高(P<0.05)。见表2。

表2 各组不同细胞周期细胞分布及细胞凋亡率比较
2.5 各组Mdm-2、p53、Bax和p21蛋白表达水平比较 与对照组相比,抑制组p53、p21和Bax蛋白表达增加,Mdm-2蛋白表达减少(P均<0.05)。见表3。
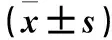
表3 各组Mdm-2、p53、Bax、p21蛋白相对表达量比较
3 讨论
CSCC好发于头面部等被紫外线照射的部位,不仅影响美观,还严重威胁其生命健康[11]。CSCC具有高侵袭性和远处转移的特性,使得标准化疗和放疗对晚期患者的疗效有限,因此一些学者开始研究CSCC的基因组背景,寻找新的治疗CSCC的可行靶标[12]。BAG-1基因位于染色体9p12,其编码的BAG-1蛋白属于抗凋亡蛋白家族成员,为一种多功能蛋白,通过蛋白与蛋白相互作用的方式与核受体激素、丝氨酸/苏氨酸激酶等多种靶分子结合,影响靶分子的功能[13,14]。研究证实,BAG-1在正常组织中多不表达,其表达多在肿瘤中。刘钢[15]研究发现,BAG-1不仅在甲状腺癌组织中的表达高于癌旁组织,并且其高表达与肿瘤分化差、淋巴结转移及高临床分期有关。在结直肠癌中,BAG-1高表达可作为判断肿瘤预后的一个独立危险因素;其在伯基特淋巴瘤细胞中高表达,促进细胞增殖,而在CSCC中的研究未见报道,因此我们以CSCC细胞株A431为工具细胞,以期研究BAG-1在CSCC细胞系中的表达情况,以及是否具有生物学功能。
qRT-PCR、Western blotting法检测结果发现,BAG-1在CSCC细胞系A431中相对表达量高于人正常永生化上皮细胞Hecate,提示BAG-1在CSCC中高表达,可能为CSCC的候选癌基因。进一步我们采用基因敲减效率较高的敲减病毒感染细胞技术,抑制A431细胞中BAG-1基因的表达后,MTS检测细胞活力下降、平板克隆检测细胞克隆形成能力减弱,提示细胞增殖受到抑制。BAG-1为具有促进细胞增殖的驱动基因,细胞周期紊乱和失控会导致细胞异常增殖,进而导致肿瘤发生,CSCC也不例外,由此我们采用流式细胞仪检测BAG-1对CSCC细胞周期的影响,发现抑制BAG-1后,G1期细胞增多,与Enthammer等[10]研究结果类似,即干扰BAG-1的表达,可通过将黑色瘤细胞阻滞在S期而抑制细胞的增殖。BAG-1是凋亡相关基因。Wang等[16]研究发现,BAG-1在顺铂诱导的肺腺癌细胞凋亡中发挥重要作用,本研究中我们同样检测了BAG-1对CSCC细胞凋亡的影响,结果显示抑制BAG-1的表达后细胞凋亡增多,表明BAG-1对CSCC细胞周期增殖和凋亡均有作用。
明确了BAG-1在CSCC细胞中发挥的具体生物学效应,我们进一步研究其作用的机制。p53基因是较早发现的最重要抑癌基因之一,与细胞周期的调控、细胞凋亡、细胞分化等生物学功能密切相关。在正常生命活动中细胞内的p53蛋白含量较少,当细胞受到外界刺激存在DNA损伤时,应激信号会触发细胞的p53蛋白含量增多,引发下游信号一系列变化,与细胞周期调控通路有关的p53/p21会使细胞阻滞在S期,进行DNA损伤的修复,以维持细胞正常周期进行,如DNA损伤修复失败,则启动与凋亡有关调控通路;p53/Bax促进异常细胞的凋亡,而原癌基因激活或有害因素持续刺激时,细胞内p53蛋白含量调节失控,不能发挥其正常生理作用而导致细胞周期紊乱、细胞凋亡异常。本研究结果显示抑制BAG-1表达后,细胞中p53、p21、Bax蛋白表达增多,表明BAG-1通过p53信号通路调节CSCC细胞增殖与凋亡。研究报道,p53主要被Mdm-2调节,Mdm-2可通过泛素化降解p53蛋白量和直接抑制p53的转录活性。同时Mdm-2与p53结合形成一个精密的负反馈调节环,即其与p53形成p53-Mdm-2复合物,抑制p53介导的抑癌作用,而p53则能促进Mdm-2蛋白合成,参与细胞周期调控、细胞生长及凋亡等过程。本研究中抑制BAG-1的表达,Mdm-2表达减少,p53蛋白表达增多,表明BAG-1调控Mdm-2是p53介导的CSCC细胞增殖和凋亡的关键基因。
综上所述,BAG-1在CSCC细胞中高表达,通过调控Mdm-2/p53信号通路促进细胞增殖和抑制细胞凋亡,本研究为CSCC发生分子机制研究提出新的实验室依据,为CSCC的防治提供了新的干预靶点。
