不同施肥方式对酸性茶园土壤真菌群落的影响
2018-12-20季凌飞马立锋陈兆杰赵远艳阮建云郭世伟
季凌飞,倪 康,马立锋,陈兆杰,赵远艳,阮建云,郭世伟,*
1 南京农业大学资源与环境科学学院, 南京 210095 2 中国农业科学院茶叶研究所, 杭州 310008 3 云南省普洱茶树良种场, 普洱 665000
土壤微生物是土壤生态功能的重要提供者,在土壤有机质周转、土壤养分转化、土壤团聚体形成、重金属及有机污染物降解、温室气体排放等物质循环和能量转化过程中发挥着重要作用[1- 3]。同时土壤微生物群落结构与数量也会随着植被种类,土壤肥力,土壤pH,降水等环境因子的改变而发生相应的变化[4- 5]。因此,调控土壤中微生物数量与群落结构对增加土壤中养分有效性,改善土壤肥力,提高土壤生产力具有重要意义。
茶树是我国重要的经济作物之一,具有喜酸富铝的特性。自然土壤植茶后,在茶树自身物质循环以及茶园管理等因素作用下,土壤理化性质会发生一系列变化。例如土壤pH值下降,土壤中Al、F等元素含量增加,而Ca、Mg等盐基离子和微量元素变得相对缺乏[6]。与其他农作物相比,茶树是多年生木本植物,且需要周期性修剪以改造树冠[7]。由于茶树枝叶富含铝和茶多酚,此类物质随着修剪枝叶还田,并不断在表层土壤富集,分解,显著改变了茶园土壤的结构和性质,可能会使茶园土壤微生物群落结构有别于其他农业或森林土壤[8- 9]。
目前,茶园土壤细菌群落与功能多样性已有相关报道[7,10]。但针对茶园土壤真菌群落多样性的研究却鲜有报道,仅有袁赛艳等人通过室内培养实验调查了茶树修剪物对茶园土壤真菌群落多样性的研究[11]。而关于不同施肥方式对茶园土壤真菌群落结构的影响却没有报道。真菌是土壤微生物群落的重要组成部分,在土壤有机质转化过程中起着重要作用[12- 14],研究表明土壤真菌群落结构和真菌的多样性与土壤碳固定过程密切相关[15]。土壤养分状况的改变,地上部植物生物量变化以及植物的生理活动也会影响土壤的真菌群落结构[16]。施肥是维持茶叶产量与品质的重要措施,同时也是影响土壤肥力与养分状况的重要因素,研究不同施肥方式对茶园土壤真菌群落结构和多样性的作用,探讨施肥对茶园土壤真菌群落的影响,可以为施肥调控茶园土壤真菌群落提供一定的理论依据。
1 材料方法
1.1 试验地概况
试验地位于云南省普洱市普洱茶树良种场(101°05′E,22°44′N),海拔1650 m,坡度约25°。属于亚热带季风气候,年均气温15—20.3℃,无霜期在315 d以上,降雨量1100—2780 mm。茶树品种为“云抗10号”,植茶年限17年。试验未开始时,表层土壤(0—20 cm)pH为4.24,有机质含量为34.80 g/kg,全氮含量2.70 g/kg,有效磷含量49.88 mg/kg,速效钾含量97.70 mg/kg。
1.2 试验设计
试验始于2011年,包含3个处理:对照(CK),不施氮肥;纯施化肥氮(N300),氮用量为300 kg/hm2纯氮;70%化肥配施30%有机肥(OM30),氮用量为300 kg/hm2纯氮。每个处理设4个重复。每个小区宽6 m,长10 m。氮肥按照1次基肥,3次追肥施用,其中30%氮肥用量施用于11月(基肥),其余氮肥分别作为追肥,分别施用于2月、5月、8月,每次追施量为全年氮肥用量20%。
本试验中氮肥为尿素,有机肥为菜籽饼。所有处理的磷、钾、镁养分投入量一致,其中磷肥用量为(P2O5) 70 kg/hm2,钾肥用量为(K2O) 150 kg/hm2,镁肥用(MgO) 40 kg/hm2。所用磷、钾和镁肥均为化肥,其中磷肥为过磷酸钙,钾肥为硫酸钾,镁肥为硫酸镁。施肥均采用人工开沟条施肥,施肥沟位于茶行中间,深度约15 cm。
1.3 样品采集与分析
土壤样品采集于2016年9月,在每个小区内距施肥沟10 cm处。去除土表的凋落物后,分别垂直钻取0—10 cm和10—20 cm的土壤。每个小区各取15个点,将土壤样品去除石块、根系,植物残体等杂质后混匀,分成两份。一份置于-80℃冰箱保存,用于提取土壤DNA,将另一份土壤风干,用于土壤的养分测定。
土壤pH值测定:称10 g风干土样于50 mL离心管中,加入去CO2蒸馏水25 mL,混合、震荡,静置30 min,用pH计(ORION3STAR,Thermo,美国)测定。
土壤全氮(TN)和全碳(TC)测定:称取1 g过100目的风干土,采用碳氮自动分析仪(ElementarVarioMaxCN,Elementar,德国)测定。
速效磷(AP)、速效钾(AK)测定:称取2.5 g过20目的风干土,采用Mehlich3浸提法,土水比1∶10浸提,将滤液稀释5倍后用ICP-AES(Thermo,TJA,美国)测定。
土壤全磷测定:采用浓硫酸-高氯酸消煮法,称取过100目筛的风干土壤1 g,加入8 mL浓硫酸,再加入10滴高氯酸消煮[17],消煮结束后将消煮液定容至50 mL,取定容后的消煮液用ICP-AES测定全磷含量;
土壤全钾测定:采用氢氟酸-高氯酸消煮法,称取过100目筛的风干土壤1 g,加入8 mL氢氟酸,再加入10滴高氯酸消煮,将消煮液定容至50 mL,取定容后的消煮液用ICP-AES测定土壤全钾含量[18]。
土壤DNA按照PowerSoilkit(MOBIOLaboratories,Carlsbad,CA,USA)试剂盒的方法提取,随后对样本进行ITS2检测区域的扩增,引物序列如下:PrimerF=Illuminaadaptersequence1+GCATCGATGAAGAACGCAGC;PrimerR=Illuminaadaptersequence2+TCCTCCGCTTATTGATATGC。扩增完毕后建立样本原始文库,采用Miseq平台,2×250 bp的双端测序策略对文库进行测序。
1.4 数据分析
测序数据下机后,序列使用QIIME 1.7.0-devpipeline (http://www.qiime.org)进行质控和去嵌合体。OTU(Operational Taxonomic Units) 是在系统发生学或群体遗传学研究中, 为了便于进行分析,人为给某一个分类单元(品系,属,种分组等)设置的同一标志。将经过质控后的序列按序列间 97%的相似性归并到一个OTU单元格中,以备后续 OTU 分类注释。指控之后共获得4373014(143931±47440各处理中的平均序列数)条序列,将获得的序列按样本中最小序列数70212抽平。之后OTU的代表序列与SILVA数据进行比对,获得每条OTU代表序列在界、门、纲、目、科、属、种分类水平上的分组。
处理与土层间的差异采用方差分析(two-way ANOVA),并用LSD方法进行多重比较,显著性水平设定为α<0.05。
Alpha多样性指数主要有Observed指数、Chao1指数和Shannon指数,其中Observed指数表示观测到的OTU数,Chao1指数表示物种的丰富度指数[19],Shannon指数是用来估算样品中微生物的多样性指数之一[20]。Shannon值越大,说明群落多样性越高。Coverage表示测序深度指数。
不同处理之间的Alpha指数差异采用单因素方差分析(one-way ANOVA),并用LSD方法进行多重比较,显著性水平设定为α<0.05。
土壤真菌群落结构与土壤理化性质之间的关系采用冗余分析(RDA)方法确定,并采用Monte Carlo置换检验计算因子的重要性,其中置换次数设为999次,显著性水平为P<0.01[21]。
上述统计分析均由R统计平台实现(R版本3.1.2)。
2 结果与分析
2.1 土壤理化性质
与试验开始前原始土样相比,0—10 cm土层中各个处理的速效钾含量提高了3.34—3.53倍,10—20 cm土层中各处理相较原始土样速效钾含量提高了2.56—2.76倍,不同处理各个土层中土壤有机碳的含量相较原始土样也有所下降(表1)。在0—10 cm土层中,纯化肥(N300)处理和有机肥配施(OM30)处理较对照(CK)处理速效磷和速效钾的平均含量有所提高,其中速效磷提高了12.36—17.32 mg/kg,速效钾提高了7.92—15.75 mg/kg,但无显著差异(P>0.05)。其他理化因子的变化较小,方差分析也表明,在0—10 cm和10—20 cm土层中,处理间的差异均不显著(P>0.05)。但两土层之间比较发现,除全钾和碳氮比外,0—10 cm土层中的养分含量、pH均显著高于10—20 cm土层(P<0.05),其中0—10 cm土层中速效磷的含量是10—20 cm土层的5.64—8.27倍。
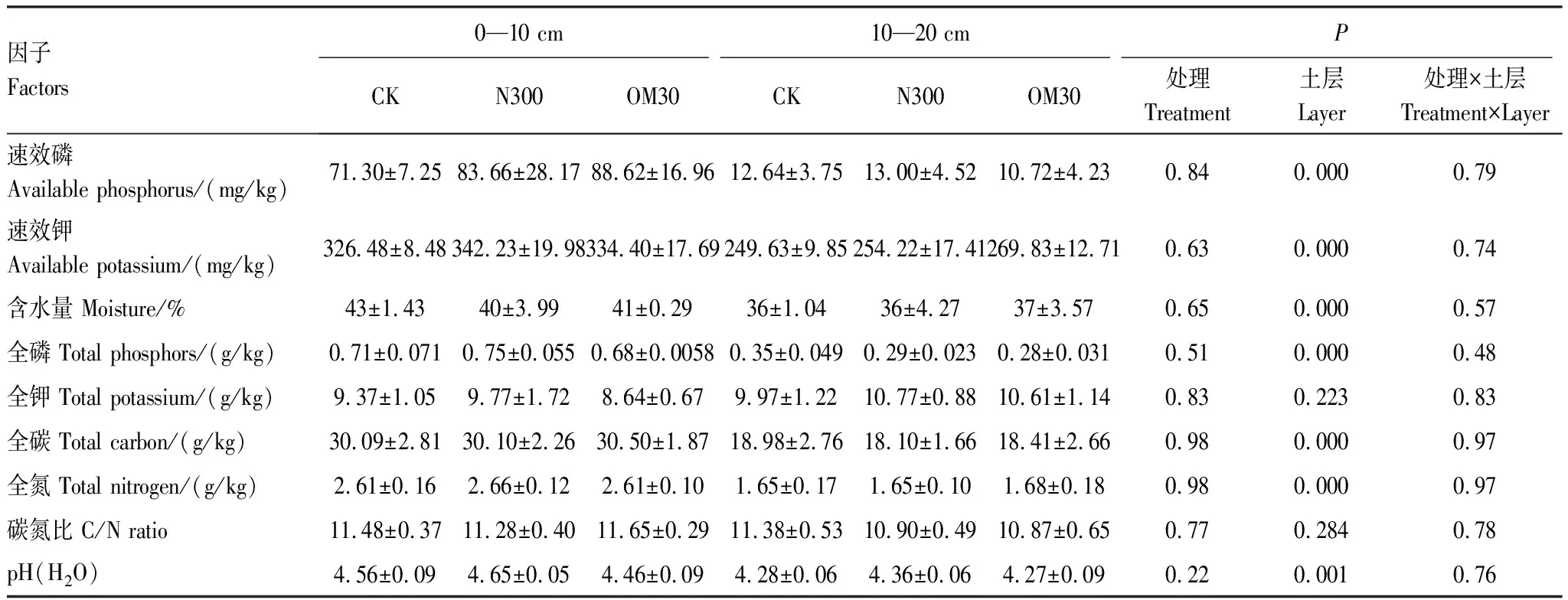
表1 不同处理及土层之间土壤理化性质
CK:对照,不施氮肥,no N fertilizer;N300:氮肥用量为300 kg/hm2N,chemical N fertilization with 300 kg/hm2N;OM30:70%化肥配施30%有机肥,氮肥用量为300 kg/hm2N,combined 30% organic N fertilizer and 70% inorganic N fertilizer;表中理化数值为平均值±标准误,P值<0.05表示差异显著
2.2 土壤真菌群落Alpha多样性
土壤的Alpha多样性可以用来表征群落内部的物种多样性。由表2可知,Coverage值在所有的处理中均大于0.995,表明在该测序深度下,大多数的真菌群落已经被覆盖。在0—10 cm土层中Observed,Chao1和Shannon指数的范围分别在1082—1423,1136—1676和4.02—4.64内,在10—20 cm土层中则在472—1145,518—1272和3.45—4.01范围之内,相同处理中0—10 cm土层的多样性指数值均显著高于10—20 cm土层(P<0.05)。
在同层土壤中,多样性指数的结果均呈CK > N300 > OM30。在0—10 cm土层中,N300与CK处理相比,Observed和Chao1指数均值分别降低了157和219,但二者之间没有显著差异(P>0.05);而OM30与CK处理相比,Observed和Chao1指数均值则降低了269和395,且差异显著(P<0.05)。在10—20 cm土层中,N300与OM30的Observed指数比CK分别降低了195和342,Chao1指数分别降低了208和377, N300和OM较CK处理Observed指数显著降低,Chao1指数虽然降低,但N300与CK处理无显著差,OM30与CK处理相比差异显著(P<0.05)。
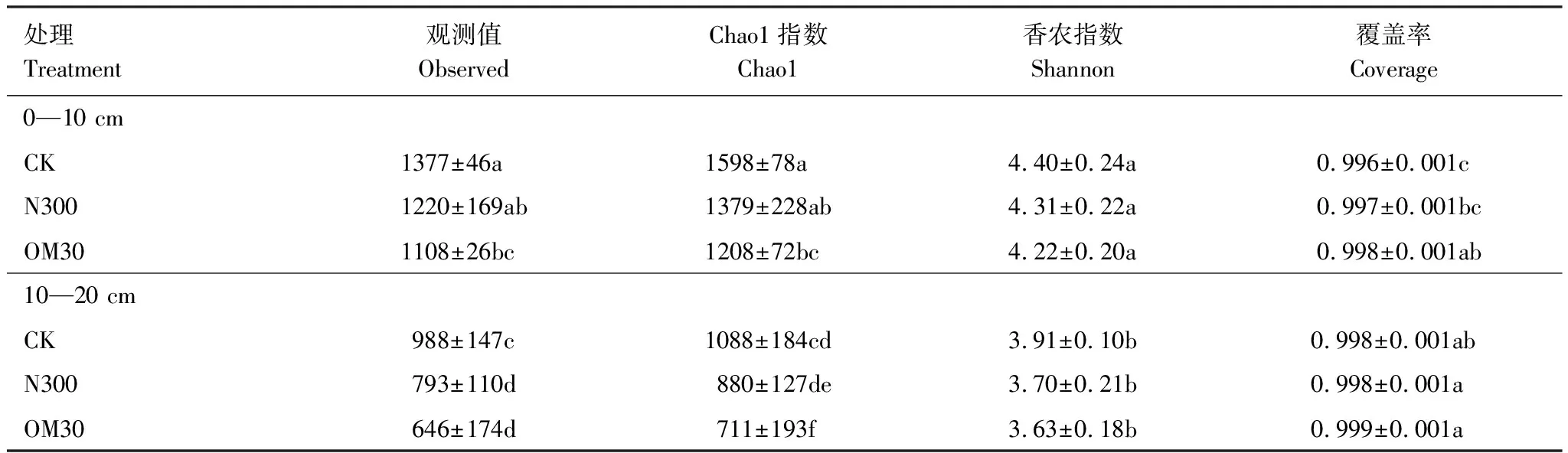
表2 土壤真菌Alpha多样性指数
不同字母表示统计上有显著差异,P<0.05
2.3 土壤真菌群落结构
茶园土壤真菌群落中的优势门类为子囊菌门(Ascomycota)、接合菌门(Zygomycota)和担子菌门(Basidiomycota),三者相对丰度总和达90%以上(图1)。不同土层间土壤样品中的真菌群落组成差异显著,其中子囊菌门在3个处理中均表现为0—10 cm土层相对丰度显著高于10—20 cm土层(P<0.05),而接合菌门在10—20 cm土层的相对丰度显著大于0—10 cm土层(P<0.05)。担子菌门仅在OM30处理中,表现出0—10 cm土层丰度显著高于10—20 cm土层。亚壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota)等其他真菌在土层间无显著差异(P>0.05)。
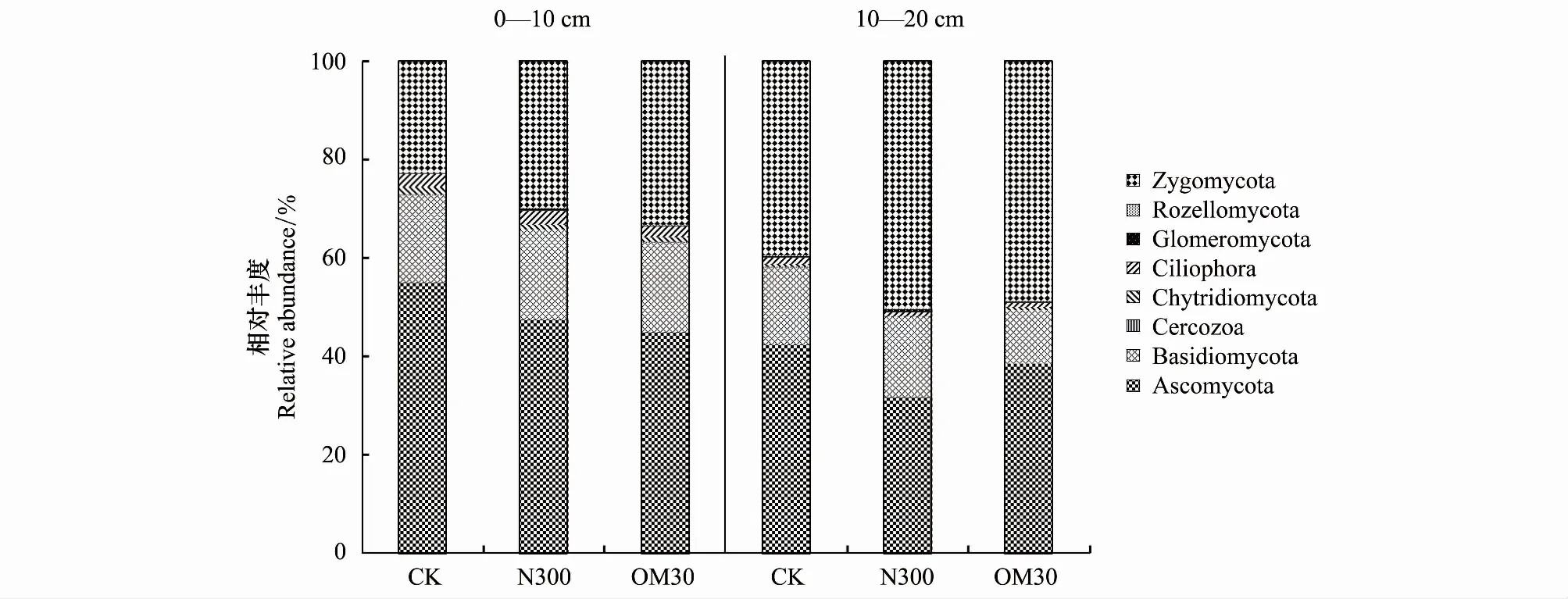
图1 真菌门水平相对丰度图Fig.1 Relative abundance at phylum levelCK:表示对照,不施氮肥,No N fertilizer;N300:表示氮肥用量为300 kg/hm2 N,Chemical N fertilization with 300 kg/hm2 N;OM30:表示70%化肥配施30%有机肥,氮肥用量为300 kg/hm2 N,combined 30% organic N fertilizer and 70% inorganic N fertilizer
子囊菌门微生物主要是由Sordariomycetes纲、Leotiomycetes纲、Dothideomycetes纲和Eurotiomycetes纲4个纲构成。其中Sordariomycetes纲相对丰度最高(17.62%—23.21%),是优势纲且在不同处理间差异显著(P<0.05)(表3)。0—10 cm土层中,Sordariomycetes纲真菌的相对丰度在N300(19.67%)和OM30处理(17.62%)中较CK处理分别降低了3.54%和5.59%;在10—20 cm土层中,CK处理中Sordariomycetes纲相对丰度最高(18.92%),而在N300和OM30处理中,Sordariomycetes纲相对丰度下降到11.93%和10.61%。
担子菌门微生物由Agaricomycetes纲、Microbotryomycetes纲和Tremellomycetes纲构成,其中Tremellomycetes纲为优势纲,其相对丰度是Agaricomycetes纲的3.21—5.55倍,是Microbotryomycetes纲的8.47—21.45倍。
接合菌门的微生物主要由Mortierellomycotina纲和Mucoromycotina纲构成,其中Mortierellomycotina纲是优势种群,其相对丰度是Mucoromycotina纲的10.73—16.96倍,(表3)。在同一土层中,施肥处理显著增加了Mortierellomycotina纲的相对丰度,在0—10 cm土层中,N300和OM30处理较CK处理分别增加了6.20%和10.20%;在10—20 cm土层中N300和OM30处理较CK处理分别增加了10.20%和9.87%。
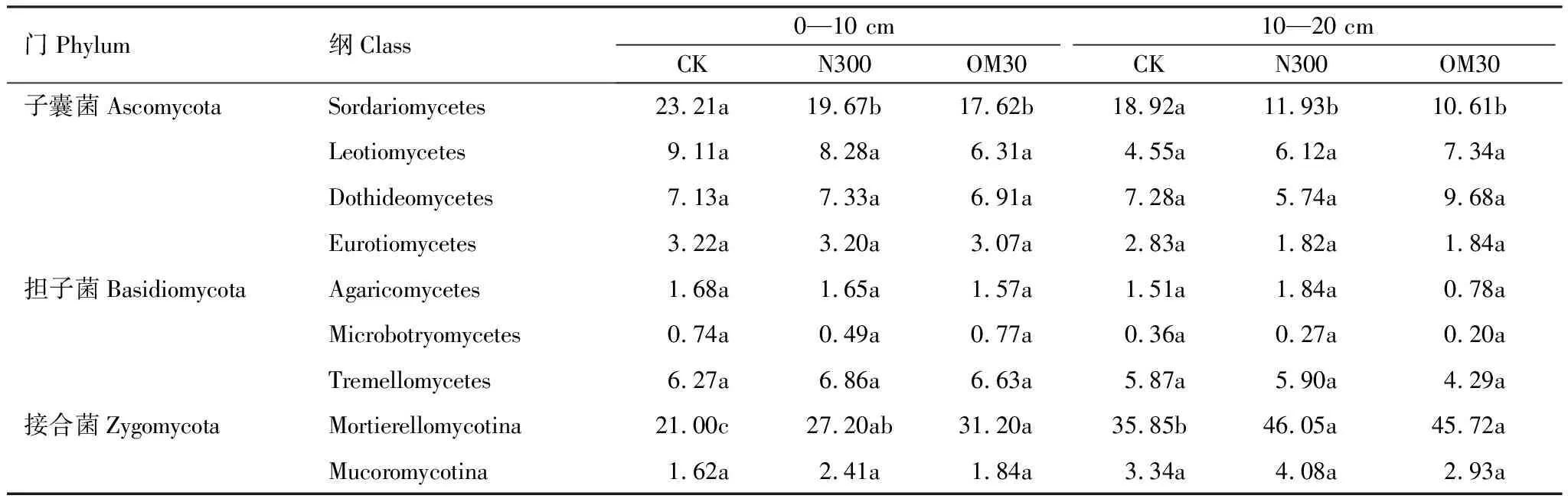
表3 各处理真菌纲水平相对丰度/%
不同英文字母表示处理之间有显著差异,P<0.05
2.4 土壤养分对真菌群落的影响
RDA分析结果显示,在两个深度土层中,各处理的真菌群落结构之间差异并不明显。在0—10 cm土层中,真菌群落差异在两个排序轴上的解释率分别是18.85%和14.77%(图2)。在10—20 cm土层中,RDA1和RDA2两个排序轴对样本间真菌群落差异的解释率分别是17.79%和12.41%(图2)。置换检验的结果显示,在不同土层中,土壤总有机碳(TC),总氮(TN),碳氮比(C∶N)以及总钾含量(TK),均为主导真菌群落变化的主要因子(表4)。此外,在10—20 cm土层中,土壤速效钾含量(AK)对真菌群落的变化具有重要影响(R2=0.69,P=0.008)。
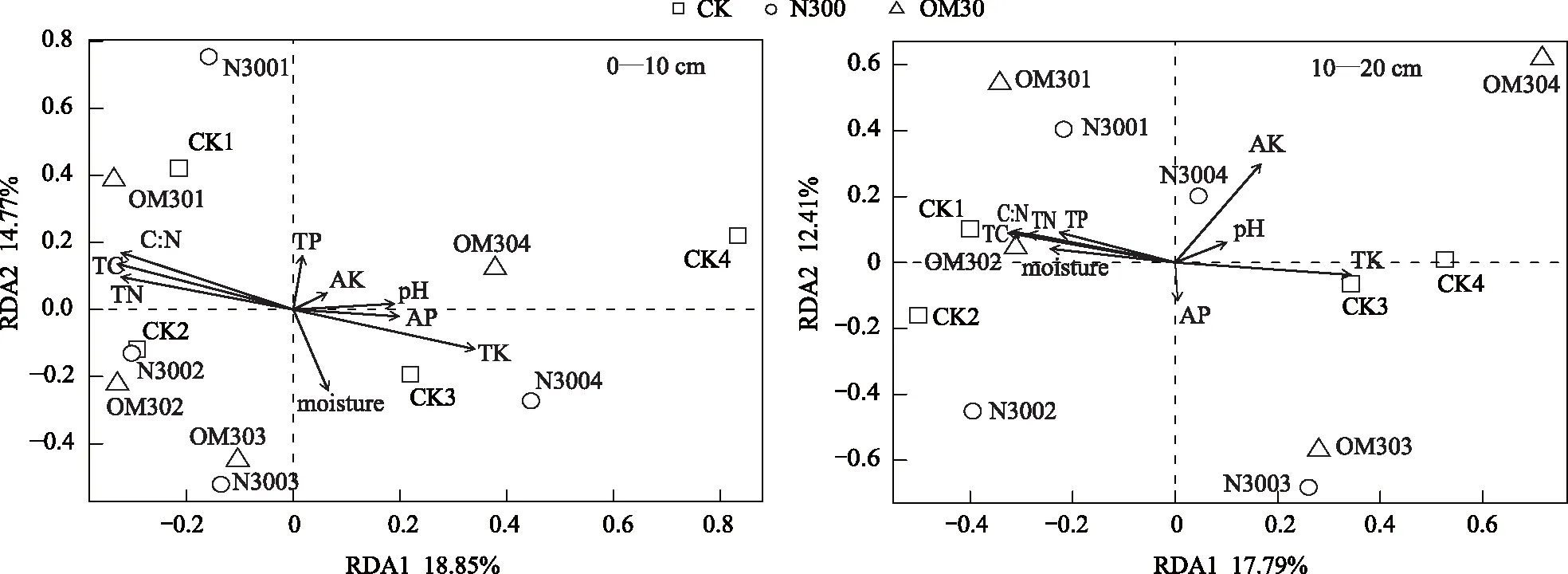
图2 冗余分析Fig.2 Redundancy Analysis (RDA)AP:速效磷,Available phosphorus;AK:速效钾,Available potassium;Moisture:含水量;TC:总碳,Total carbon;TN:总氮,Total nitrogen;C∶N:碳氮比,Ratio between total carbon and total nitrogen;TP:全磷,Total phosphorus;TK:全钾,Total potassium

因子Factors0—10 cm10—20 cmR2PR2P因子Factors0—10 cm10—20 cmR2PR2PAP0.240.2900.080.688TN0.700.002∗∗0.550.037∗AK0.040.8450.690.008∗∗C∶N0.810.002∗∗0.670.008∗∗moisture0.380.1040.370.114TP0.160.4580.360.125pH0.220.3310.080.677TK0.800.001∗∗∗0.720.006∗∗TC0.790.001∗∗∗0.700.007∗∗
AP:速效磷,Available phosphorus;AK:速效钾,Available potassium;Moisture:含水量; TC:总碳,Total carbon;TN:总氮,Total nitrogen;C∶N:碳氮比,Ratio between total carbon and total nitrogen;TP:全磷,Total phosphorus;TK:全钾,Total potassium;P值通过999次置换计算得出,显著性标记为*P<0.05;**P<0.01;***P<0.001
3 讨论
3.1 有机无机配施对土壤理化性质的影响
在福建茶区的定位施肥试验研究发现有机无机肥配施能显著增加土壤中养分元素含量,稳定土壤pH,减缓茶园土壤酸化,改良茶园土壤质量[22]。而在本研究中,与CK处理相比,纯化肥处理(N300)增加了全氮含量,有机无机配施处理(OM30)增加了土壤有机碳,但并未达到显著水平(P>0.05)。这可能与试验地块的地形有关,由于试验地区雨热同期,雨季降水量较大,土壤含水量长期处于饱和水平。根据王云等人的研究,在坡地上,短时间的强降雨极易产生地表径流,在土壤水分饱和时,即使降雨量少也易产生径流,造成养分流失[23]。而云南茶区施肥期均处于雨季,尽管采取了开沟施肥措施,但是大的降雨量可能造成坡地茶园中肥料养分的径流损失,降低了不同施肥处理对土壤理化性质的影响。
3.2 施肥对茶园土壤真菌Alpha多样性的影响
试验茶园上下层土壤间的真菌物种多样性差异显著,0—10 cm土层土壤的物种总数显著高于10—20 cm土层,这可能与上层土壤较高的pH和有机碳含量有关。研究发现,土壤pH降低会引起真菌物种总数降低[24]。而有机质含量高的土壤,能为真菌的生长提供良好的环境,有利于真菌物种总数的增加[25]。这与本研究中表层土壤pH、土壤有机碳含量显著高于下层土壤的结果相一致。
施肥对土壤真菌多样性的影响并不一致,但是多数研究结果显示施用无机氮肥或者有机肥配施会降低土壤真菌群落的多样性[25,26- 27]。施肥导致的真菌多样性降低可能是由于施肥刺激了某些特定微生物的大量生长,但是抑制其他微生物生长,从而导致多样性下降[28]。然而也有研究发现长期施无机氮肥或者有机肥配施会增加土壤真菌多样性[14]。不同的多样性指数也会得出不同的结论。蔡艳等人研究小麦种植土壤真菌群落时发现,单施化肥或者有机肥配施降低了真菌群落的Shannon指数,但增加了Chao1指数[26]。本研究中与CK处理相比,N300处理的真菌群落的物种总数和多样性均有所下降,但差异并不显著,而OM30处理土壤真菌Chao1多样性指数比CK显著降低(表2)。张海芳等人对草原土壤的研究显示,无机氮肥主要是通过影响植物来改变真菌群落结构,而对真菌群落的直接影响较小[29]。但是本研究中有机肥配施并未增加土壤真菌的Chao1指数,这与Chu等人在玉米小麦轮作的砂姜黑土土壤上的研究结果并不一致[14]。但是与丁建莉等在东北黑土长期定位施肥试验的结果较为一致[30]。对不同生态系统的比较研究发现,茶园土壤中可观测到的OTU数远低于其他农田生态系统少[29],与森林生态系统土壤的真菌群落结构较为相近[27]。可以推测,施肥对土壤真菌群落多样性的影响差异可能与植被类型与土壤性质有关[31]。
3.3 施肥对茶园土壤真菌群落组成的影响
由图1发现,受测土样的真菌群落结构主要由子囊菌门、担子菌门、接合菌门、亚壶菌门以及球囊菌门构成,这与陈丹梅等人在植烟土壤和南方典型水稻土壤的研究结果相一致[25,32]。长期施肥可能会促使土壤中的真菌群落多样性降低,群落结构主要朝子囊菌,担子菌和接合菌3个方向演替。本研究中子囊菌门的群落构成与Sun等在不同施肥模式的旱地土壤中的结果相一致,但接合菌门的纲水平组成则有所不同[14]。Sun等的实验中接合菌门的优势种群是Microbotryomycetes纲,而本研究中主要以Mortierellomycotina纲和Mucoromycotina纲为主。根据袁赛艳等人采用DGGE技术对茶园土壤真菌群落多样性的研究,Mortierellomycotina纲和Mucoromycotina纲是茶园土壤真菌的优势物种[11],表明不同植被覆盖可能会导致土壤真菌群落组成的差异。
在0—10 cm和10—20 cm土层中,总有机碳、总氮、总钾含量以及碳氮比是主导茶园土壤真菌群落结构产生变化的主要因子,而速效钾在10—20 cm土层中也发挥一定的作用,表明不同土层之间的真菌微生物群落结构可能受到土壤理化性质的影响。Zhang 等人在研究高寒地区的土壤真菌群落组成与土壤理化性质的关系时发现,pH是真菌群落组成的最主要因素[33]。但本研究中pH在同一土层的各处理间并无显著差异,RDA分析和置换检验结果也显示在同一土层中,pH并不是茶园土壤真菌群落结构差异的主控因子,推测茶园土壤本身的酸性较强,配施有机肥对于土壤pH的提升效果不明显,因此本研究中pH不是造成同层土壤不同处理间真菌群落结构差异的主要原因,推测pH的主控效应可能存在于不同植被覆盖体系间,而在同一作物土壤中,有机碳,氮以及速效磷才是影响茶园土壤真菌群落组成的主要因素[33]。有研究表明土壤碳氮,速效养分等土壤性质之间存在显著差异,可能强烈的影响微生物群落结构[34- 35],这与本文中的RDA分析结果相一致。Chu等关于不同土层之间微生物群落结构的变化研究也表明,土层之间微生物群落结构的差异来自于土层之间理化性质的差异,特别是土壤养分状况的差异[36]。
4 结论
5年不同施肥处理并未显著改变茶园土壤理化性质,但是不同施肥模式对土壤真菌丰度、多样性以及菌群组成具有显著影响。长期施用化学氮肥或有机无机肥配施能够明显降低茶园土壤中真菌群落的Alpha多样性。土壤pH对试验茶园土壤中真菌群落结构影响不显著,土壤有机碳、全氮、全钾、速效钾是影响茶园土壤真菌群落结构演变的重要因素。
