燃料电池中催化剂的电化学性能研究进展
2018-12-19余培锴李月婵
余培锴, 李月婵
(厦门理工学院 材料科学与工程学院, 福建 厦门 361024)
1 燃料电池简介
伴随着全世界各国的经济(Economy)的高速发展,能源(Energy)危机和环境(Environment)问题日益突出,3E关系是人类世界发展与生存所导致的必然结果,如图1所示。
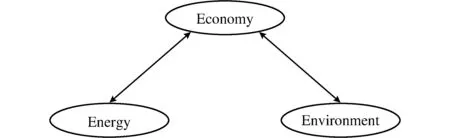
图1 经济、能源与环境之间的相互关系示意图Fig.1 The schematic drawing of mutual relationship among economy and energy and environment
目前,人类能够获得的能源主要依靠于化石能源、核能,还依靠一些比如太阳能、风能、地热能和潮汐能等能源。其中化石能源、核能为非再生能源,为非清洁能源。太阳能、风能可以再生,为可再生能源。过度依赖石油、煤、天然气等化石能源,其储量日益枯竭,并且对环境的污染越来越严重。现在全球都在积极采取措施来解决能源危机、环境污染和气候异常等问题。近年来,我国卓有成效的经济和社会建设的同时,资源和环境对发展的瓶颈制约日益明显,如何加快经济增长方式转变迫在眉睫,正因如此,我国已经将节能减排工作提高到国策的高度。为了解决能源危机和环境问题,探寻清洁的、高效的、廉价的新能源刻不容缓。因此,开发新型的能量转换和能量存储装置是发展考虑的方向。

图2 氢氧燃料电池工作原理示意图Fig.2 The working principle diagram of hydrogen-oxygen fuel cell
燃料电池(Full Cells)是一种不需要经过卡诺循环的电化学发电装置,能量转换率高[1]。由于在能量转换过程中,几乎不产生污染环境的含氮和硫氧化物,燃料电池还被认为是一种环境友好的能量转换装置。由于具有这些特异性,燃料电池技术被认为是21世纪新型环保高效的发电技术之一。随着研究不断地突破,燃料电池已经在发电站、微型电源等方面开始应用。
燃料电池的结构主要是由4个主要部分组成,分别为阳极、阴极、电解质和外部电路。以质子交换膜燃料电池为例,阳极(负极)为氢电极,阴极(正极)为氧电极,阳极和阴极之间通常由质子交换膜分隔开,阴阳离子可在膜上进行电子转移与运输。阳阴两电极上都需要一定量的电催化剂,用来推进电极上所发生的电化学反应,两电极之间是电解质。燃料电池的工作原理图如图2所示。
2 燃料电池的种类
燃料电池具有能量转化率高、环境友好、比能量高、可靠性高、灵活性大,并且能长时间连续供电等优点,有着巨大的应用前景。目前燃料电池的种类很多,其分类方法也有很多种。按不同方法大致分类如表1所示。
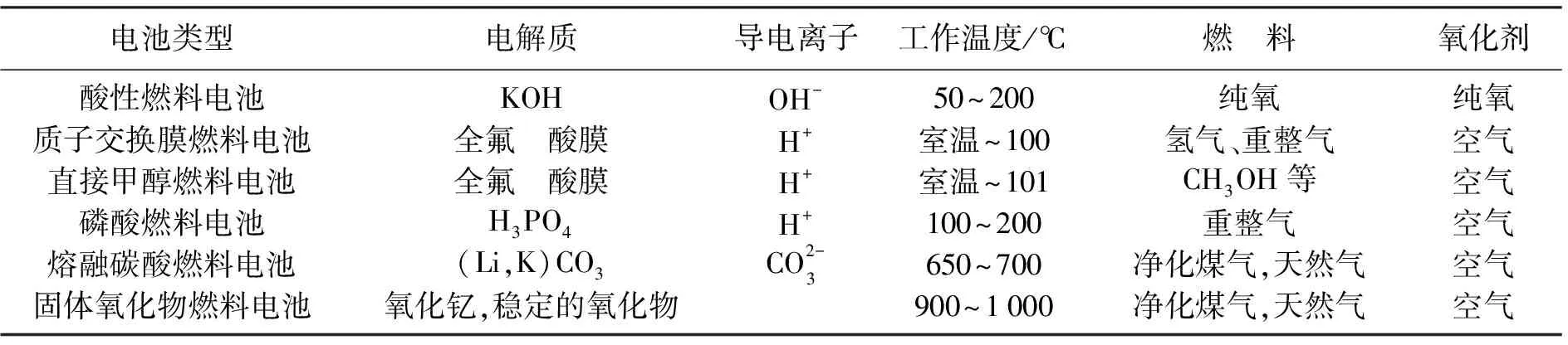
表1 燃料电池的分类表Tab.1 The classification of fuel cells
3 燃料电池发展中存在的问题
如前所述,燃料电池具有诸多优点和种类。如果能将燃料电池大规模地发展起来,一定会推动社会巨大进步。然而,就目前燃料电池的技术发展来看,电催化的成本和寿命是制约燃料电池商业化的主要障碍。这些难题都妨碍着燃料电池大规模的商业化应用:
1) 传统的电催化剂的成本较高。燃料电池中主要使用催化剂是Pt基催化剂,但是世界上的铂金属的存储量有限,价格昂贵,且化学稳定性较弱。所以会越用越少。那么,在如何降低电催化剂的成本将成为研究燃料电池催化剂的热点之一。
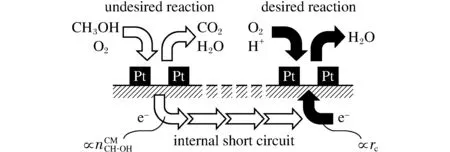
图3 阴极氧还原反应和甲醇氧化的交换电流示意图Fig.3 The schematic diagram of charge transfer current between oxygen reduction and methanol oxidation
2) 电催化剂的抗毒性和活性较差。阴极进行氧还原反应的难度远胜于阳极进行氢氧化,而且在甲醇和氧气都存在的情况下,铂电极在阴极容易发生“跨界反应”(如图3所示),从而导致铂电极对氧失去氧还原能力。
如何提高催化剂的催化活性,研究并开发非贵金属催化剂来代替贵金属催化剂成为燃料电池发展的长期研究课题之一。由于燃料电池的种类繁多,研究内容也非常多,国内课题组重点研究直接甲醇燃料电池(DMFCs)阳极催化剂,氢气燃料电池中清洁能源氢气(H2)的制备以及燃料电池的阴极电催化材料方面展开研究。
4 燃料电池的催化剂
4.1 阳极催化剂
贵金属催化剂:贵金属基电催化剂主要包括单金属电催化剂、贵金属二元合金以及合金氧化物电催化剂和多元合金电催化剂。目前为止,国内外对甲醇氧化(Methanol oxidation reaction,MOR)研究的电催化剂还是以贵金属电催化剂为主。单金属电催化剂主要是Pt,Pd和Au[4-7]。其他的贵金属也开始尝试应用于DMFCs的研究中[3]。众所周知,贵金属催化氧化甲醇与贵金属颗粒形状,尺寸大小和表面结构有关[5-7]。针对这些方面,众多的研究者做了关于这个方面的研究。比如,2010年厦门大学的Tian等[8]应用方波电位电化学合成了二十四指数晶面单质Pt、Pd等单金属贵金属,对小分子醇有着非常优异的电化学性能;于2012年,Li等[9]在indium tin oxide(ITO)合成了纳米棱镜状的薄膜金,它们显示出了较好的活性;Wang等[10]合成了棒状具有纳米孔状的Pd,在CH3OH-KOH溶液中进行优异的电化学活性,电流高达223.52 mA·mg-1。
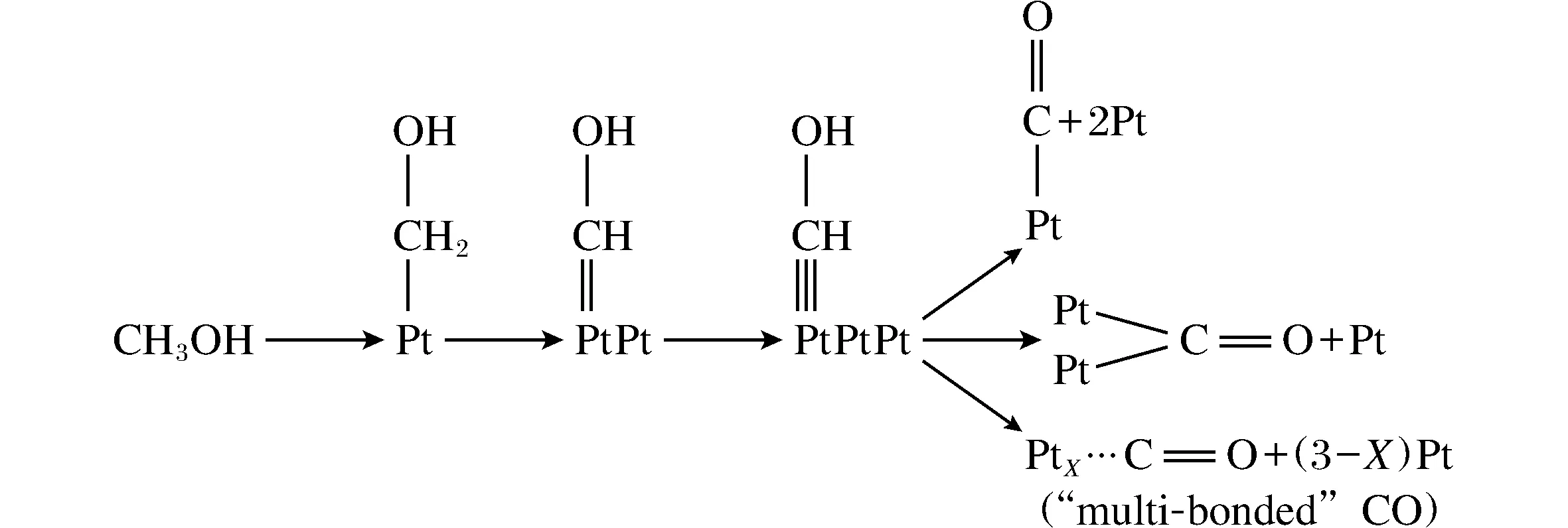
图4 连续游离的甲醇分子静电吸附在Pt电极表面的示意图Fig.4 The diagram of the continuously dissociative methanol molecule on the surface of platinum electrode
虽然通过改变单金属电催化剂的表面形貌、电子轨道和费米能级可以显著提高电催化活性。而如果将另一种金属引入到单质贵金属形成二元合金或者为合金氧化物,一方面可以降低贵金属的使用量,提高贵金属的有效利用率,另一方面由于二元合金或者是合金氧化物之间的双组分协同机理,可以提高电催化的活性。典型的例子,单金属铂在阳极氧化甲醇时,中间态产物一氧化碳(CO)极易吸附在铂金属的表面,降低铂的有效比表面积,阻碍甲醇的氧化,从而发生CO在电极表面的自我中毒[10],图4表示的是甲醇在Pt电极上反应的示意图。为了降低甲醇氧化中间体对铂基催化剂的腐蚀与毒化作用,研究者们通常加入一些其亲氧组分的金属元素,比如PtRu、PtSn。这主要是归根于亲氧组分的加入不仅可以促进水的吸附解离,还能通过电子作用修饰铂金属的电子构型,减弱中间产物 CO在金属活性位上的吸附强度。目前普遍接受的甲醇电氧化机理是“双功能机理”(Bifunctional Mechanism)[11],即在催化剂的表面需要有2种活性中心位:其一是铂金属为活性位,用于甲醇分子的吸附和C-H键的活化以及脱质子过程;另一中心是铂金属或者其他元素组分,用于水的吸附及活化解离,最终吸附产生的含碳毒化中间产物(CO)与含氧物种(H2O2)发生反应,完成阳极的半反应过程,而且其他亲氧组分的加入不仅可以促进水的吸附解离,同时还能通过“电子效应”改变铂金属的核外电子排布,从而影响甲醇分子的吸附和脱质子过程,减弱中间产物在金属活性位上的吸附强度。
基于以上单金属以及二元合金的研究,科研者致力于研究将如何进一步降低催化剂的成本以及更好的电催化活性。虽然Ru的加入会缓解Pt电极中毒,但是Pt-Ru催化剂的价格不低,同样很难大规模发展起来。一些科研者开始研究三元合金以及多元合金[12-15]。但是PtRuNi,PtRuMo多组分电催化剂的进展并不是特别理想,由于其对甲醇氧化反应的活性较低而受阻,通过一系列的表征研究主要是归结由于其催化剂的比表面积小,这一缺点限制了多组分催化剂的大量应用。近些年来,一些科研工作者开始采用有机物或者多金属氧化物做载体来提高电催化剂的表面积,使电催化活性和抗毒性都非常高的同时,有着非常优异的寿命。如Li等[16]通过加入多金属氧化盐(POMs)制备了Pt/CNTs催化剂,一方面,POMs可以减少金属的团聚,从而可以提高Pt/CNTs的电催化活性,比传统的Pt/C和未加入POMs制备的Pt/CNTs的电催化活性要好很多。另一方面是这样制备的催化剂Pt为纳米颗粒,电催化活性也很高,更重要的一点是Pt存在于POM层与层之间,Pt发生中毒的现场也会减弱很多。Ding等[17]制备的将PtRu负载于中空碳球(HCNs)对MOR反应表现出了优异的电催化活性与稳定性。另外一些课题组[18-21]也进行了这方面的研究。
目前,虽然由于贵金属铂有较好的电催化活性,广大科研工作者也对其进行了广泛的研究。然而,波金属受到存储量的限制,无法被大规模使用在商业化的燃料电池中。从而,研究非铂基电催化剂对于燃料电池大规模商业化使用是至关重要的。
在众多的非贵金属中,一方面由于镍金属在碱性溶液中不会被溶解,另一方面由于镍金属容易在表面形成氧化物,能够增加其比表面积,从而在镍电极上的反应变得更加容易发生。从20世纪70年代开始,科研工作者就对碱性溶液中的镍基电极对醇的电催化氧化进行了广泛的研究,关于镍电极在碱性溶液中对于小分子醇类反应的机理,目前被人们普遍接受的是Fleischmann机理[22],反应步骤如图5所示。
图5在镍电极上乙醇的氧化过程示意图
Fig.5 The schematic diagram of ethanol oxidation on the surface of nickle electrode
Abdel Rahim等[23]利用电沉积法制备了Ni/C电极,在碱性溶液中对甲醇进行了电化学性能研究,研究表明高分散的Ni的活性比块状Ni的活性高很多;Xu等[24]制备的中空镍球在镍负载量很低的情况下也能对甲醇和乙醇表现出非常优异的电化学活性,Tehrani等[25]制备了颗粒大小为~10 nm的镍晶体,并对甘油进行了电化学性能研究,表现出非常好的催化活性,且作为传感器也非常稳定。Taraszewska等[26]发现Ni(OH)2/GC对甲醇有非常好的电化学活性。Ni合金及其合金氧化物也被广泛应用于电化学氧化研究。如Wang等[27]通过循环伏安和计时电流法研究了Ni-Al修饰电极对甲醇的电氧化。NiCo2O4由于其高的电化学活性,低的价格成本以及在碱性溶液中的抗腐蚀性,日益吸引人们的注意,并应用于不同的新能源体系,目前已有少量的关于NiCo2O4应用于甲醇氧化研究的报道。
综上所述,如何制备具有孔结构的电催化材料非常重要。根据国际纯粹与应用化学联合会(IUPAC)定义[28],介孔材料或者多孔材料根据其孔径大小可分为微孔材料(<2 nm),介孔材料(2~50 nm)和大孔材料(>50 nm)。微孔材料中典型的是沸石分子筛。硅铝沸石分子筛具有均一且开放的孔道结构,高的比表面积,稳定性好。硅铝分子筛沸石广泛应用于离子交换,吸附分离,石油化工和精细化工中。由于 Ni 在碱性溶液中不会被溶解掉[29-30],通过离子交换,把硅铝分子筛中的Na+换为Ni2+,就可以获得新型修饰金属型分子筛电极,并应用与MOR 研究[31-34]。但是,如何提高分子筛的交换 Ni2+的能力,从而获得更多的参与反应的活性Ni2+是我们研究的一个方向。
NiCo2O4尖晶石由于其高的电化学活性,低的价格成本以及在碱性溶液中的抗腐蚀性,日益引起了人们的注意,并应用于不同的新能源体系。例如,它们可以应用于锂离子电池、超级电容器、氧析出反应(OER)和氧还原反应(ORR),但是仅有少量的报道它们的甲醇的氧化反应(MOR)。在该反应中,大的表面积有利于电催化性能的提高,但是常规的方法需要采用硬模板或软模板,这又提高了样品的合成成本。采用无模板技术合成多级孔的urchin-like 状的NiCo2O4,并将此电极材料应用于碱性溶液中的甲醇电氧化研究是我们研究的另一方向。
4.2 燃料电池阴极催化剂
燃料电池的阴极反应是氧的还原反应(Oxygen Reduction Reaction,ORR),与氢的氧化相比,氧的还原过程更加困难,还原机理也比较复杂。关于ORR在碱性溶液中的还原过程,氧分子还原为负四价的氧负离子基本上可以分为:“二电子反应途径”和“四电子反应途径”。
1) 二电子反应途径:

(5)
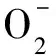
(6)
或进行以下的歧化反应:
(7)
2) 四电子反应途径:

(8)

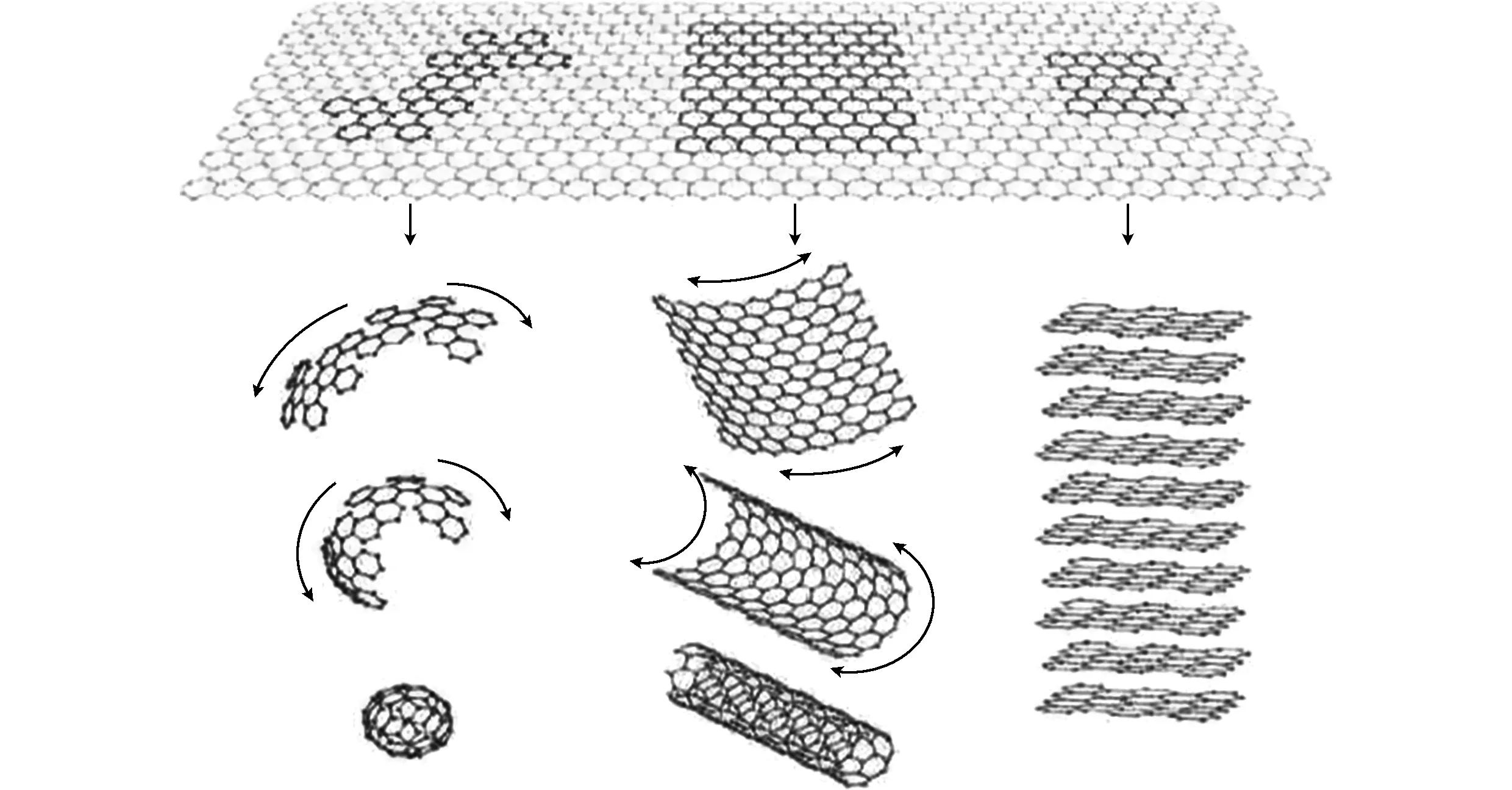
图6 所有石墨状形式的模板。石墨烯是一个二维结构的碳 材料,可以加工形成各种维度的碳材料。它可以包裹成 为零维的足球烯,卷成一维的纳米管,堆积成三维石墨Fig.6 Graphene is a type of building material for all kind of graphitic carbon materials. Graphene is a two-dimensions carbon material, which can be processed into various carbon materials, such as fullerene, carbon nanotubes and three-dimensions graphite
在直接甲醇燃料电池反应过程中,阳极为甲醇的氧化,阴极为氧气的还原,Pt电极容易形成“跨界反应”,造成Pt电极失活。因此,研究低成本、活性高和稳定性的阴极电催化材料对阴极反应来说至关重要。碱性溶液中可催化还原氧气的非贵金属催化剂非常多,主要包括过渡金属大环化合物、过渡金属碳化(WC)和杂原子掺杂的碳材料。由于杂原子掺杂碳材料的在酸碱性溶液中优异的化学稳定性、高的导电率以及超强的质子传质能力,碳材料在燃料电池ORR反应中研究越来越多[35-38]。而碳材料中的石墨烯是一种二位层状的物质,具有高的电导率、大的比表面积等一些优异的特点,将杂原子N(S,B和P)等原子掺杂到石墨烯等碳材料将会是今后研究的热点之一。
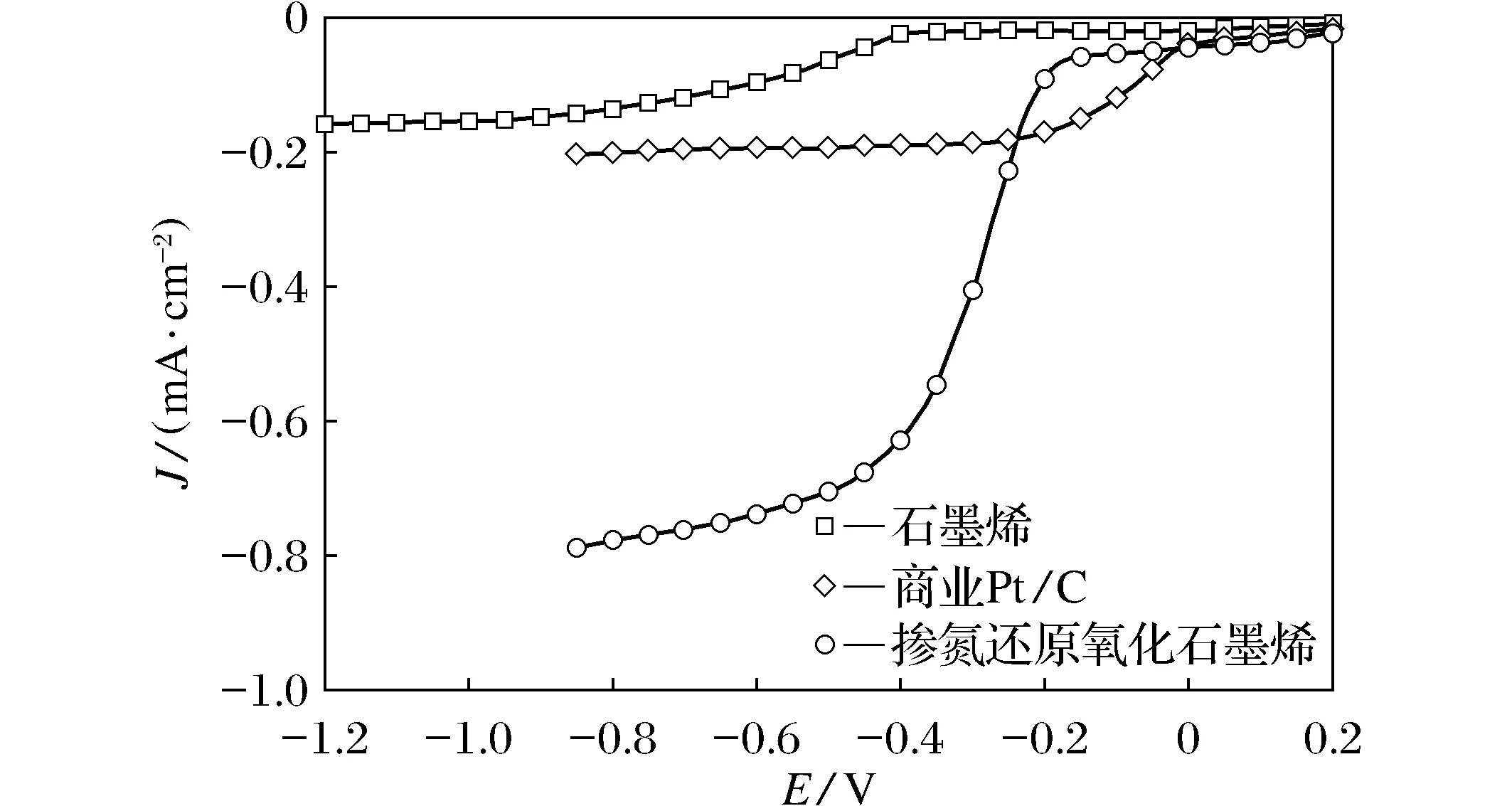
图7 石墨电极、Pt/C 电极、渗氮石墨电极在氧气饱和 1摩尔的KOH溶液中的ORR反应RDE测定曲线[39]Fig.7 RDE curves of graphite, Pt/C and Nitrogen-doped graphite were used as the working electrode toward oxygen reduction reaction in O2-saturated 0.1 M KOH solution, respectively[39]
图6表示的是以石墨烯为基本单元,组成各种不同结构的碳材料。自1985年,零维碳材料富勒烯的发现,引发了学者们的研究热潮。1991年,日本的研究者Iijima发现一维的碳纳米管,将碳材料的研究推向进一步的高潮。2004年,英国的Geim和Novoselov等人成功剥离出二维结构的石墨烯,并获得2010年诺贝尔物理奖,使得碳质材料成为新一轮的研究热点,对他材料的研究越来越多,越来越深入。
2005年,科研工作者发现在KNO3溶液中发现N掺杂的碳纳米纤维具有一定的氧还原催化活性。之后,在不同的温度下,通过NH3的气氛下数个小时来处理经过硝酸酸化的CNTs。研究表明在800 ℃下得到的N-CNT在碱性溶液中表现出最好的ORR电催化活性及稳定性。Liu等人准备 N 掺杂有序介孔碳材料,在950 ℃下得到的材料对ORR的最优的电催化性能,超过了商业化的Pt/C,且电子转移数~3.89,可以认为氧反应为四电子反应。自2010 年,Dai[39]等人通过CVD法制备的N掺杂石墨烯对ORR反应呈现着优异的电化学活性,使得广大科研工作者将Metal-free材料应用于ORR中的广泛研究,见图 7。
氮掺杂碳材料制备方法大致可分为2类:1)直接掺杂法;2)氧化还原法。直接掺杂法是指在直接往碳材料中渗入氮元素进行复合反应,利用含碳和氮的前驱体高温热解,或者化学气相沉积(CVD)生长得到氮掺杂碳材料[39-41]。氧化还原法在指在含氮的气氛中对含碳元素的前躯体材料进行后处理而制备氮掺杂碳材料。NH3是最常用的含氮气体,还有用氮含量更高的双嘧啶、乙腈等气体;或者是将碳的氧化物在高温高压下用NH3含氮气体进行还原。通常来说,直接掺杂法所需反应温度较低,N 掺杂的键合形式主要是吡啶氮或者吡咯氮;而通过氧化还原法所需反应温度较高,此时生成的N掺杂的键合形式主要是石墨氮。然而,要控制N掺杂的量以及N掺杂的位置是十分困难的。

图8 在渗氮的碳材料上氮原子的结合方式Fig.8 The bonding way of Nitrogen atom in Nitrogen-doped carbon material
图8为氮掺杂到碳材料中,氮掺杂形式主要有石墨氮(graphic-N)、吡啶氮(pyrdinic-N)和吡咯氮(pyrrolic-N)这三种键合结构出现。但是究竟哪种形式的氮会影响ORR的催化活性呢?Sidik等[43]认为graphic-N是ORR的催化活性位点,因为N和C相邻,从C原子贡献电子至N原子很容易,同时电子从N原子反馈到Cp2轨道上也非常容易,这种贡献-反贡献的过程非常有利于O2吸附在C原子上,同时使O原子与C原子之间形成稳定的化学键,有利于ORR过程的进行。
Huang等[44]却持有不同观点,他们认为pyridinic-N中的孤对电子才是有利于O2的吸附,从而才能加速 ORR的进行。研究氮掺杂碳材料的活性中心时,应当考虑:1)氮键合结构不同时,催化剂的导电性是不是相近?2)催化剂中sp2杂化时C含量、石墨化程度是否一致的?一般来说,要形成graphitic-N需要在较高温度下进行,而高温条件下非常有利于碳材料的石墨化,从而影响材料的导电性,以及碳材料中sp2杂化的C结构。
Yang等[45]采用高温退火氧化石墨烯与二苄基二硫成功制备了硫掺杂石墨烯材料,应用于燃料电池阴极电催化剂在ORR性能测试中,表现出优异的电催化活性,性能优于商业的Pt/C催化剂,且ORR反应主要是以四电子为主。Yao等[46]采用相似的方法制备了碘掺杂了的石墨烯,在碱性溶液中对ORR性能测试表现出非常优异的电化学活性。综上所述,杂原子掺杂的碳材料可以对ORR反应表现出优异的电化学性能。如果能大量制备杂原子掺杂的碳材料,那么杂原子掺杂碳材料非常有望于商业化燃料电池的阴极材料。
5 总 论
目前,铂合金或者铂合金催化剂广泛应用于燃料电池中的各种电催化反应:醇类燃料电池的阳极氧化:氢气燃料电池中正极以及制备氢气的析氢反应(HER)以及燃料电池的阴极氧还原(ORR)等等。但是,世界上铂金属储量有限,价格昂贵,并且铂基催化剂在醇类燃料电池中对甲醇的氧化反应(MOR)中的中间产物CO容易中毒。对于燃料电池的阴极还原反应(ORR),因氧分子的2电子反应过程所产生的中间产物(H2O2)会对催化剂活性位点发生腐蚀作用。在燃料电池的氧化还原化学中,阳极为甲醇时容易产生“跨界反应”,催化剂失活等特点,大规模地发展铂金属催化剂的燃料电池非常困难。因此,探索制备新的非铂电催化剂至关重要。如何提高催化剂的催化活动,开发新的非贵金属催化剂已经成为燃料电池发展的长期研究课题之一。
