小鼠肺癌正位模型的建立
2018-12-19周恺骅高基民
周恺骅,高基民
(温州医科大学 检验医学院 生命科学学院,浙江 温州 325035)
据世界卫生组织癌症研究中心(IARC)报告,肺癌是全球发病率和死亡率最高的恶性肿瘤。美国癌症协会(American Cancer Society)统计,2017年全美新增的609 640例癌症死亡病例中,肺癌分别以26%和25%占据男、女癌症死亡病例的首位[1-2]。为了深入地研究肺癌,动物模型是所有研究的基础。现有的肺癌模型主要分为2种,一种是通过诱导上皮转化来实现,利用化学致癌物或基因工程改变致癌基因或抑癌基因的表达[3],另一种是利用肺癌细胞株或患者肿瘤细胞进行异位或正位递送。前者易于肺癌遗传学上的研究及靶向药物的研发,但是成瘤时间较长、建模系统相对复杂及成本较高等问题限制了其应用。目前应用较多的是利用癌细胞株进行皮下异位移植,但也有学者比较了小鼠正位肺癌模型和皮下模型,认为正位模型虽然操作复杂,但其转移率和肿瘤生物学特征更符合临床实际情况[4]。已有研究利用Lewis细胞株建立小鼠正位肺癌模型[5-7],这些研究较多地选择了开放性的方式,对小鼠胸部皮肤切开后进行肺部正位注射来构建肺癌模型。这种方式对操作者的要求较高,耗时较多,难以满足量大的动物实验研究。本文基于前者的研究,探索了一种非开放性的建模方式,利用稳定表达荧光素酶的小鼠Lewis肺癌细胞系进行肺癌正位模型的建立。
1 材料与方法
1.1 材料
1.1.1 细胞株
Lewis肺癌(lewis lung carcinoma,LLC)细胞株属鼠源性的非小细胞肺癌细胞株,购自中国科学院。
1.1.2 试剂
高糖DMEM培养基、胎牛血清、嘌呤霉素(Gibco,美国),青霉素-链霉素溶液(碧云天,中国),Matrigel基质胶(BD,美国)。
1.1.3 实验动物
C57BL/6小鼠购自上海斯莱克动物中心,雄性,5~6周龄,饲养于温州医科大学SPF级实验室,独立送风柜中饲养,自由饮水和进食。
1.2 方法
1.2.1 构建表达荧光素酶的LLC稳转细胞株
构建plvx-EF1α-luc2-gfp-puro载体质粒包装慢病毒,转导LLC细胞,使其在表达荧光素酶的同时又具有嘌呤霉素抗性及绿色荧光蛋白(GFP)双筛选标记。1)慢病毒转导。取生长状态良好的LLC细胞,进行细胞计数。取2×105个细胞培养24 h,更换为不含抗生素的培养基,加入载体质粒plvx-EF1α-luc2-gfp-puro包装的慢病毒,继续培养24 h。2)嘌呤霉素筛选。对感染后的细胞进行换液,培养24 h后更换为含有2 μg·mL-1嘌呤霉素的培养基,同时以未经过感染的LLC细胞作为对照,继续培养72 h。3)流式细胞术分选GFP阳性的LLC细胞。对经过嘌呤霉素筛选的细胞进行流式分选,筛选出单个GFP阳性细胞,继续培养于20% FBS的培养基,第5天在荧光显微镜下标记出生长状态较好的单克隆群,进行扩大培养,对细胞株鉴定后冻存保种。
1.2.2 小鼠正位肺癌模型的构建
将含有表达荧光素酶的LCC细胞(5×104个)细胞悬液与Matrigel基质胶等体积混匀,抽吸入事先预冷好的胰岛素注射器。使用异氟烷将小鼠麻醉,待小鼠呼吸平稳,呼吸频率降低后,捏紧小鼠胸部皮肤使其暴露整个胸部轮廓,对其皮肤进行消毒,在小鼠左侧肋弓下缘1~1.5 cm与左锁骨中线交叉处注射,进针深度3~5 mm,角度以垂直为佳,注射细胞悬液25 μL,注射完后停顿5~10 s。
1.2.3 小鼠活体成像操作
小鼠于肿瘤细胞注入后第6、16、26、36和46天进行活体成像。首先给予小鼠腹腔注射虫萤光素酶底物,浓度为15 mg·mL-1,剂量为150 mg·kg-1,底物作用3 min后,予以异氟烷吸入麻醉,然后再放入主机箱内,共曝光10 min,每隔30 s进行图像拍摄。
2 结果与分析
2.1 稳定表达荧光素酶的LLC细胞株的建立
通过基因工程改造的细胞株往往不及野生型稳定,而异种移植入小鼠体内后荧光素酶基因容易丢失,荧光值的大小无法准确地代表活体小鼠内肿瘤的大小。为得到表达更稳定的细胞株,本研究自主构建载体质粒plvx-EF1α-luc2-gfp-puro包装慢病毒,成功转导LLC细胞后,可使其在表达荧光素酶的同时又具备嘌呤霉素抗性和GFP这2个双筛选标记。LLC细胞在病毒感染24 h后用嘌呤霉素进行首轮筛选,此时GFP阳性的细胞约为90%;再用流式细胞术进行第2轮筛选,分选出单个GFP阳性细胞。在分选后第5天和第10天观察细胞生长状态,其中有10个单克隆群细胞活力较好(图1)。对分选出的单克隆群进行扩大培养后,用流式细胞术对活细胞中GFP的阳性率进行检测,阳性率均可达到95%以上(图2)。

图1 LCC细胞的生长形态
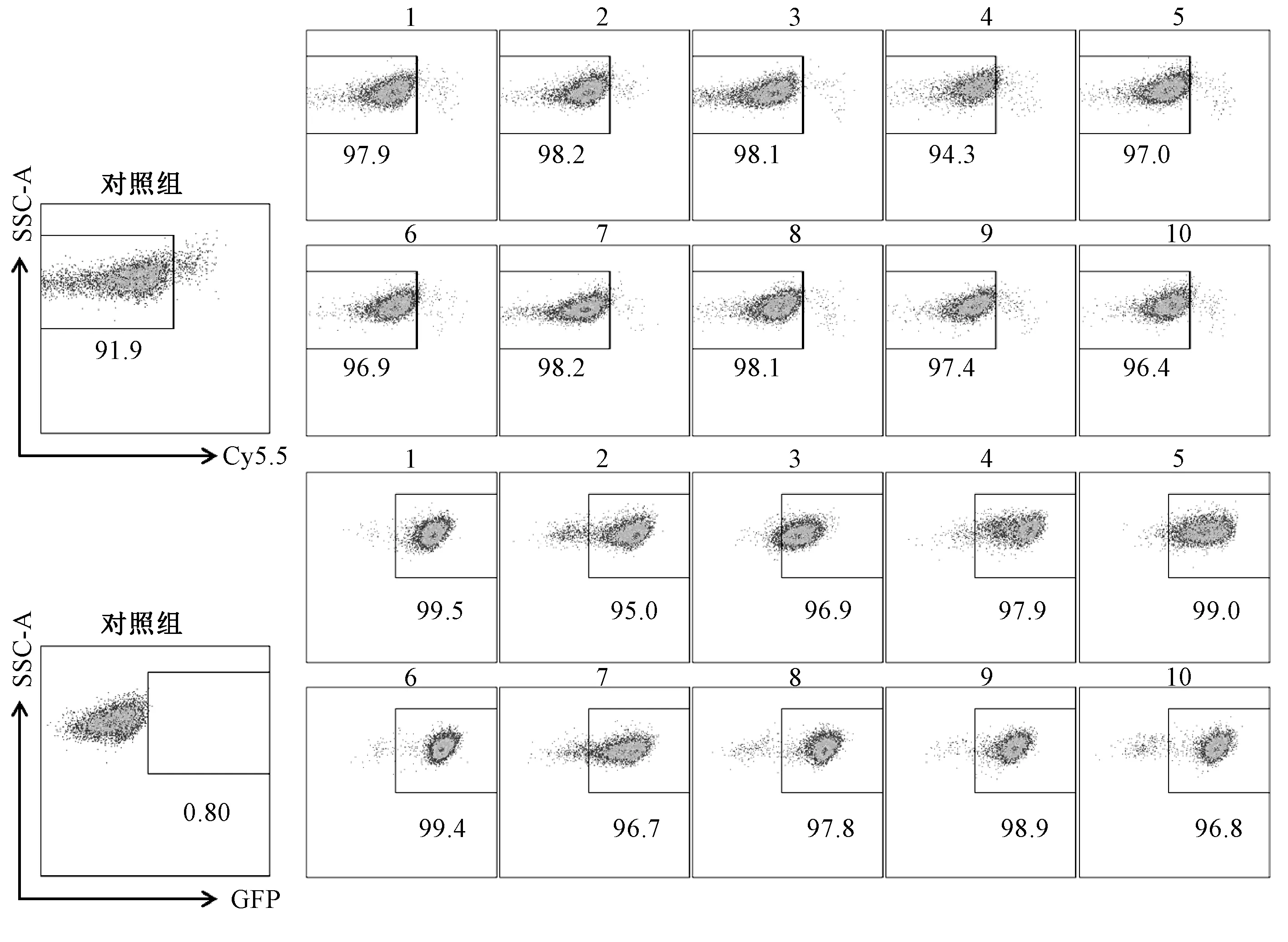
图2 LLC活细胞中GFP的阳性率(%)
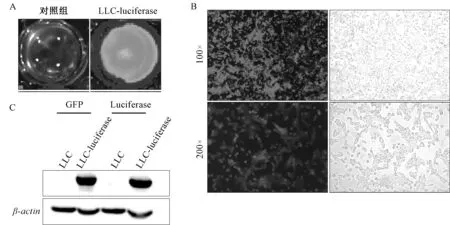
A,细胞活体成像;B,荧光显微镜观察;C,Western blot检测LLC稳转细胞中GFP和luciferase蛋白水平的表达情况图3 表达荧光素酶的LLC稳转细胞株的鉴定
取活力较好的1株进行动物建模,利用细胞活体成像、荧光显微镜以及Western blot对细胞进行鉴定(图3)。结果表明,稳定表达荧光素酶的LLC细胞株构建成功。
2.2 小鼠正位肺癌模型的建立
利用LLC稳转细胞株,以C57BL/6小鼠构建正位肺癌模型。整个实验的观察周期为60 d,期间每隔1天记录小鼠体重,观察小鼠精神状态、行动力。取部分小鼠每10 d进行1次活体成像,记录肿瘤变化情况。在肿瘤注入后的第4周,小鼠陆续出现体重大幅下降、毛色变差、行动力减弱等恶病质变,小鼠呼吸频率加快、弓背状呼吸等肿瘤浸润肺部的体征十分明显,个别小鼠甚至出现肿瘤侵袭脊髓后偏瘫的现象(图4)。小鼠解剖后,可见肺部肿瘤的形成,部分肺叶有出血性病变,小鼠脾脏出现出血性坏死。
取病变肺叶进行HE染色后发现,正常的肺泡结构已经消失,可见大量增殖的异型性肿瘤细胞,肿瘤细胞大小形状不一、排列不规则、细胞分化差、核大深染、核质比增大、分裂相多见(图5)。
活体成像结果如图6所示。随着肿瘤变大,光子量不断增加,在最后一次成像中由于光子量过强而导致无法成像。小鼠的体重变化和生存率如图7所示,与活体成像结果相符合。
3 讨论
小鼠肺癌模型包括了自发性肿瘤模型和移植性肿瘤模型。自发性肿瘤模型可通过化学致癌物或基因工程来实现,这类模型由于成瘤时间较长、建模系统相对复杂,以及成本较高等问题限制了其应用[8]。移植性肿瘤模型因成瘤率稳定、所需成瘤时间较短等特点,在实际科研中更为常用。移植性小鼠肺癌模型主要分为正位移植模型及异位移植模型,正位移植又包括了支气管内注射和肺内注射2种方法。Sato等[9]使用气管内注射构建正位移植模型,但该方法操作复杂、成瘤及瘤体大小、数目均不稳定。因此,肿瘤的正位移植动物模型是目前较为理想可靠的肿瘤模型。

A,肿瘤侵袭小鼠肺组织和脊髓受肿瘤浸润后的表现;B,小鼠肺部和脾脏大体病变图4 C57BL/6小鼠正位肺癌模型构建

图5 小鼠肺组织的病理学观察
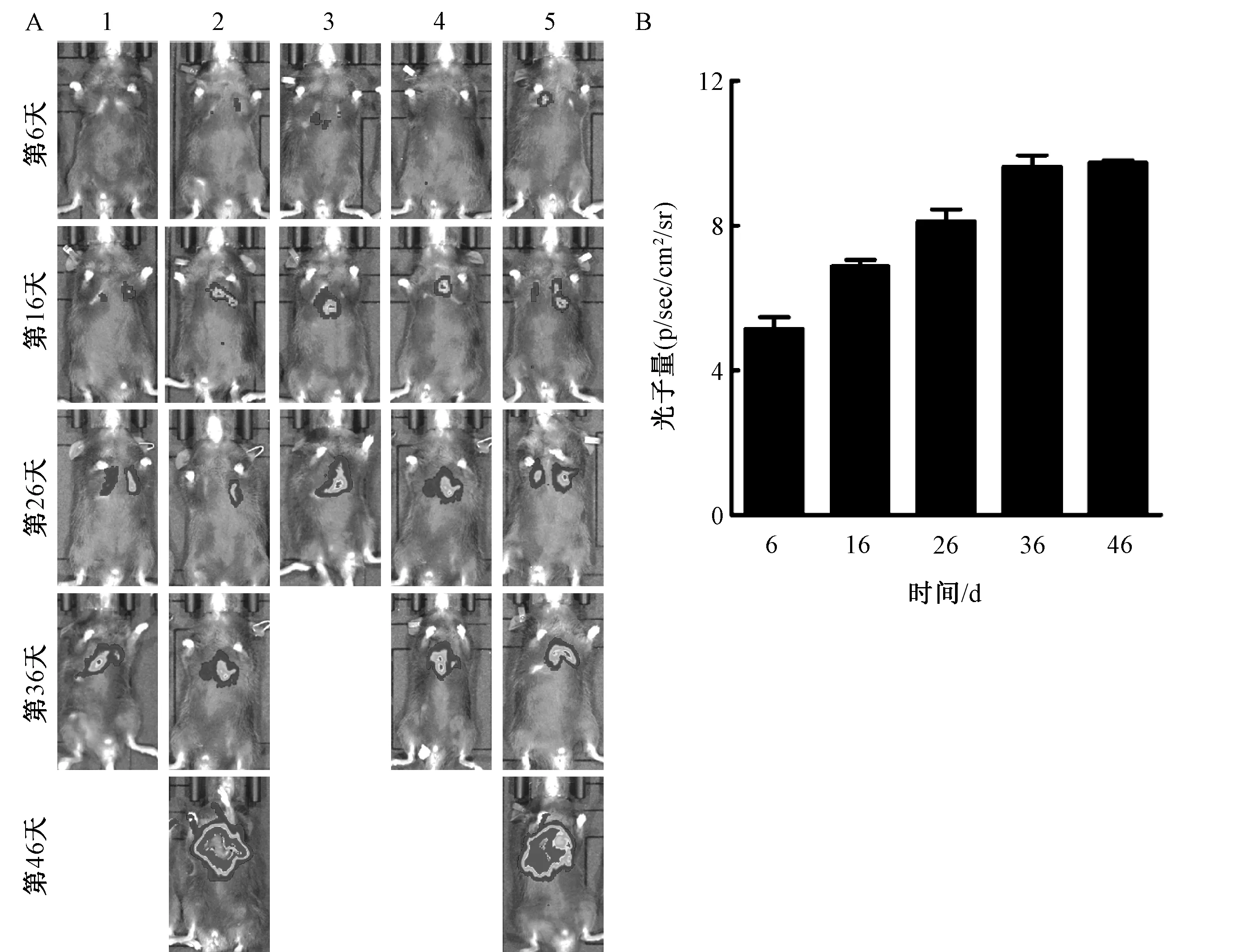
图6 小鼠活体的成像情况
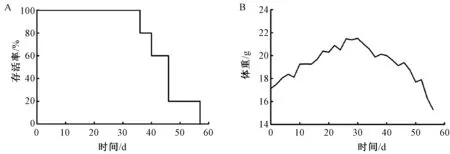
图7 小鼠存活率和平均体重
Lewis细胞株被广泛应用于肺癌正位模型的建立,最初由Bertram等在C57BL/6小鼠身上获取,其成瘤性强,在小鼠体内转移性较弱[10]。由于该细胞株具有较强的成瘤性,有学者对其建模所需的细胞量进行了探讨。Liu等[11]用接种细胞总数104、105和106进行造模,成瘤率分别为83.3%、100%和100%。低剂量组由于接种时细胞有渗漏,导致细胞数未达104而有部分小鼠造模不成功,高剂量组在第3天即可长出肿瘤,第9天全部小鼠成瘤。高剂量组所面临的问题是大量细胞可以诱导快速和广泛的炎症反应,并且这些细胞可以压倒并逃避针对原发性肿瘤的正常免疫应答,所以大剂量的细胞可能并不适合后期的实验需求。Weiss等[7]在构造早期肺癌模型中仅以1 000个细胞就达到了100%的成瘤率。综合以上研究,本研究以5×104作为注射量,注射后小鼠在第6天可以检测到肿瘤,第16天成像时成瘤率可达100%,第5周开始出现恶病质,中位生存期为46 d。
本研究中所用到的活体生物荧光成像技术是近年来发展起来的一项分子、基因表达的分析检测系统,主要由敏感的CCD设备及其分析软件和作为报告子的荧光素酶以及荧光素组成。该技术是在小型哺乳动物体内利用报告基因-荧光素酶基因表达所产生的荧光素酶蛋白与其小分子底物荧光素在氧、Mg2+离子存在的条件下消耗 ATP 发生氧化反应,将部分化学能转变为可见光能释放,然后在体外利用敏感的 CCD 设备形成图像。该方法具有很好的灵敏度,可以准确的检测到肿瘤的大小,同时也要求LLC细胞系可以稳定的表达荧光素酶。在筛选细胞时,本研究设计了GFP和嘌呤霉素抗性2个筛选标记,经过2轮筛选从而获得表达更稳定的细胞系。也有学者利用GFP进行成像,建立稳定表达GFP的LLC细胞,对C57BL/6进行肺部注射,用荧光护目镜和激光二极管泵浦(LDP)470 nm的蓝光手电筒观察成瘤情况[12-13]。应用IVIS成像系统,在小鼠皮下最少可以检测到经生物发光标记的3个T细胞[14]。与利用激发光与反射光的荧光成像相比,酶和底物的特异性要远远超过荧光物质发光的特异性,可以形成极高的信噪比,所以生物发光的灵敏度要高出荧光的灵敏度大约一万倍,并且有更高的特异性。
在以往的研究中,利用LLC细胞系建立小鼠正位肺癌模型往往以开放性手术的方式对小鼠进行胸部皮肤切开,该方法可以准确地找到肺叶所在位置,防止细胞外漏于胸腔。在前期实验中,本研究尝试用该方法进行造模。该方法要求操作者手法娴熟,但也有部分小鼠因为皮肤切开后体温降低,导致后期麻醉苏醒时间过长而死亡,并且由于操作过程复杂、时间过长,无法满足后期大规模动物实验的要求。本研究探索了非开创性的造模方式,成功建立了小鼠正位肺癌模型,节约了造模时间,对大规模的肺癌动物研究具有重要意义。
