中国近海铜藻ITS与coxI序列相似性分析*
2018-12-19詹冬梅吴海一
吕 芳 郭 文 丁 刚 刘 玮 詹冬梅 吴海一
中国近海铜藻与I序列相似性分析*
吕 芳1,2郭 文1丁 刚1,2刘 玮1,2詹冬梅1,2吴海一1,2①
(1. 山东省海洋生物研究院 青岛 266104;2. 青岛市大型海藻工程技术研究中心 青岛 266104)
本研究分别对2016和2017年中国近海10个铜藻()漂浮地理种群以及 3个定生种群的51个采集样本进行了和I序列分析及相似性比对。结果显示,51个样本的I序列完全一致,序列存在2个变异位点,按基因型的异同可分为4个类型,其中大连龙王塘、烟台大钦岛和南隍城岛的漂浮铜藻基因型相同,青岛金沙滩漂浮型、烟台大钦岛和大连獐子岛的定生铜藻基因型相同,威海俚岛和温州洞头的漂浮铜藻基因型相同,青岛雕塑园、王哥庄、大珠山、威海乳山的漂浮型和枸杞岛定生铜藻基因型相同,而同一种群内部即便是不同年份的个体间基因型并没有差异。基于序列构建的系统树显示,来自中国的所有铜藻样本聚为一支,与来自韩国的铜藻样本有一定的遗传距离。以上结果说明,我国近海漂浮和定生铜藻的不同地理株间和I的遗传变异水平较低,漂浮铜藻可能具有不同的来源,为进一步探明中国近海海域铜藻的分子遗传背景提供依据。
铜藻;漂浮;定生;;I;序列相似性
铜藻(Turner) C. Agardh属于褐藻门、墨角藻目、马尾藻属,大多生长在低潮带深沼中或大干潮线下4 m处的岩石上,是中国沿海海藻场的重要组成部分(曾呈奎等, 2000)。铜藻是一种重要的经济海藻,对海水中的富营养化物质具有较强的生物吸附能力,具有重要的生态价值;铜藻富含岩藻黄素、褐藻胶、褐藻多酚等生物活性物质,使其在医药保健、生物制品以及化学工业等领域也极具开发潜力(Liu, 2012; 詹冬梅等, 2016)。2007年以来,黄海海域连年暴发大规模的浒苔绿潮,其中还夹着一些漂浮铜藻(蔡永超等, 2014; 陈军等, 2016),尤其是2017年绿潮灾害中漂浮铜藻的生物量显著高于往年同期,局部海域漂浮的铜藻可达浒苔数量的20%,形成“马尾藻金潮”(http://news.xinhuanet.com/2017-06/ 17/c_1121162366.htm)。漂浮铜藻的过量繁殖,会在水面织成一张网,导致底层养殖的鱼虾缺氧,使水体环境恶化,影响养殖环境。此外,漂浮的铜藻还会缠绕堆积在紫菜和海带的养殖筏架上,对筏架养殖造成一定影响(http://www.js.xinhuanet.com/2017-01/11/c_ 1120284277.htm)。漂浮铜藻的出现进一步加大了山东半岛绿潮防治的难度,也成为一种新的灾害现象。目前,国内外研究主要集中在对绿潮浒苔的溯源和防控等方面(汪文俊等, 2008; 刘峰等, 2012; 王广策等, 2016),漂浮铜藻的来源及暴发原因到目前尚没有明确的认识,尚需多方寻求论证。
DNA分子标记技术已被广泛用于物种鉴定以及属内种间和不同地理株间的分子系统演化关系等研究(Lane, 2007; Kucera, 2008; Mcdevit, 2009)。尽管铜藻不同地理种群的系统发生研究已有一些相关报道(Hu, 2011; 蔡一凡等, 2013),但由于不同的DNA序列进化速率不同,往往会导致研究结果存在差异,因此,进一步选择合适的分子标记以及地理范围分布更广的不同居群进行分析,可为铜藻的系统发育、遗传多样性分析等提供新的佐证。

图1 2017年威海俚岛湾养殖区紫菜养殖筏架上的铜藻(A)和青岛金沙滩海岸上堆积的铜藻(B)
Fig 1onrafts of Lidao aquaculture area (A) and accumulated on the coast of Golden Beach of Qingdao (B) in 2017
本研究分别从我国东海、黄海、渤海等不同海域采集铜藻样品,通过对其核糖体内转录间隔区(Internal transcribed spacer)和线粒体I(细胞色素c氧化酶亚基I)序列进行扩增、测序和分析,旨在研究我国近海海域铜藻的分子遗传背景以及不同海域漂浮铜藻和野生铜藻的相互关系,为铜藻的生物地理学研究提供新的证据,进而为漂浮铜藻的溯源、分布范围和漂移路线的监测等工作提供理论依据。
1 材料与方法
1.1 样品采集
铜藻是一种潮下带的大型褐藻,定生于海底岩礁上,近年来,由于海洋生态环境的改变,铜藻资源不断衰退,因此,定生的铜藻种群已很难采集到。本研究所用定生和漂浮铜藻样品采集自中国东海、黄海和渤海海区(表1),其中,定生铜藻种群采集自舟山、烟台和大连3个地区,10个漂浮铜藻种群采集自温州、青岛、威海、烟台和大连等地区。样品采集后用低温箱迅速运回实验室,藻体用海水反复冲洗,去除泥沙及杂质,然后用消毒海水清洗干净,保存于‒20℃。
1.2 基因组DNA制备
实验采用TIANGEN新型植物基因组DNA提取试剂盒(DP320)提取铜藻样品的基因组DNA,具体步骤参照说明书。提取的DNA经1%琼脂糖电泳检测,紫外分光光度计定量后,置于‒20℃保存备用。
表1 铜藻样品采集信息
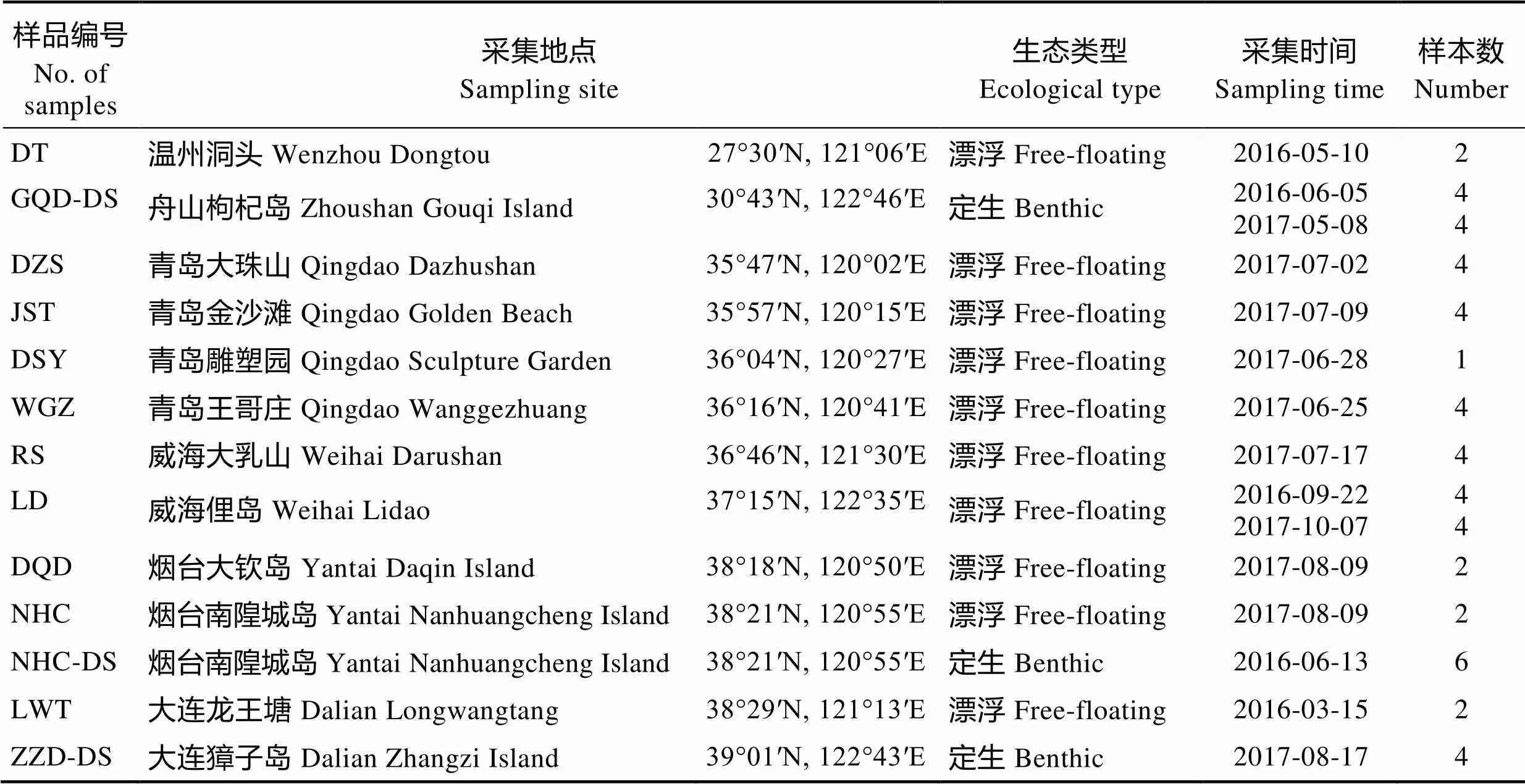
Tab.1 Information of S. horneri samples
1.3 ITS和coxI序列的扩增
为了获得尽可能长的序列,分别扩增2段片段,然后进行拼接。其中,5.8S rDNA-序列的扩增参考White等(1990),引物序列为5 5′-GGAAGTAAAAGTCGTAACAAG-3′;4 5′-TCCTCCGCTTATTGATATGC-3′。扩增程序为94℃预变性5 min;94℃变性30 s,48℃退火30 s,72℃延伸1 min,总35个循环;72℃延伸10 min。完整2序列的扩增参考Yoshida等(2000),引物序列为BFF 5′-CGATGAAGAACGCAGCGAAATG-CGAT- 3′;25BR2R 5′-TCCTCCGCTTAGTATATGCTTAA- 3′。扩增程序为93℃预变性1 min;94℃变性30 s,55℃退火30 s,72℃延伸45 s,总35个循环;72℃延伸10 min。
I序列的扩增参考Lane等(2007),引物序列为GazF2:5′-CCAACCAYAAAGATAT-WGGTAC-3′;GazR2:5′-GGATGACCAAARAACCAAAA-3′。扩增程序为94℃预变性4 min;94℃变性30 s,50℃退火30 s,72℃延伸1 min,38个循环;72℃延伸10 min。
PCR反应体系均为25 μl,包含PCR Master mix (BBI,加拿大) 12.5 μl,上、下游引物(20 μmol/L)各1.0 μl,模板DNA 20 ng。
扩增产物经1%琼脂糖凝胶电泳检测,将扩增成功的PCR产物送生工生物工程(上海)有限公司进行正反向测序。
1.4 数据分析
用DNAStar-Editseq软件和Chromas软件对测序结果进行分析、校正,然后将拼接成功的序列输入到GenBank中进行BLASTn同源性分析,再用Clustal X1.83软件对序列进行比对分析。用MEGA 6.06软件Kimura 2-parameter模型计算不同铜藻样品间的遗传分化距离,构建系统树,Bootstrap方法进行1000次重抽样估计系统树中节点的置信值,以羊栖菜()作为外类群。
2 结果与分析
2.1 ITS区序列分析
本研究中所有样品的序列长度均为1506 bp,包括部分1、完整的5.8S rDNA和完整的2序列,其中,1序列长度为765 bp,5.8S rDNA长度为159 bp,2序列长度为582 bp,同一种群个体间测序结果一致。对铜藻样本单个个体的的PCR产物进行双向测序结果显示,LD和DT样本的第1016位点正向测序结果是C,反向测序结果是T,LWT、DQD和NHC样本的第1014位点正向测序结果是T,反向测序结果是C,这2个变异位点均位于2区,后续分析中以兼并碱基Y表示。经ClustalX比对分析,结果显示,51个样本的序列仅上述2个变异位点存在差异,按基因型的异同可分为4个类型,其中,LWT、DQD和NHC的漂浮铜藻基因型为“TGTGYATTTTT”;JST漂浮型和DQD、ZZD的定生铜藻基因型为“TGTGTATTTTT”,LD和DT的漂浮铜藻基因型为“TGTGCAYTTTT”,其余几组样本基因型完全一致,为“TGTGCATTTTT”(表2)。GQD-DS和LD铜藻地理种群采集的是2016和 2017年的样品,相同年份和不同年份内部个体的基因型均没有差异。
表2 铜藻区变异位点

Tab.2 Variable nucleotide sites of ITS sequences of S. horneri
*表示正反向测序结果不一致
* indicates inconsistent results of forward and reverse sequencing
与NCBI数据库中的相应序列进行比较,发现与3株铜藻的相应序列仅有几个碱基差异,相似性在98%以上,其中,藻株(序列号为AY149998.1)于1994年采自韩国江陵市海区,藻株(序列号为JF710312.1)于2008年采自中国沿海,藻株(序列号为AY149999.1)于 1994年采自韩国仁川市海区。
将文献中报道的浙江沿海铜藻样本的2种基因型DT 01和HKA 01(蔡一凡等, 2013)、2013年绿潮暴发期间采自中国青岛近海漂浮铜藻样本QD2013 (陈军等, 2016)以及NCBI数据库采自韩国的铜藻样本AY149998.1和AY149999.1遗传分化距离变异范围为0~0.0175,不同地理株间区的遗传变异水平较低。其中,AY149999.1与QD2013的遗传分化距离最大,为0.0175;HKA 01、DT 01与本研究的 51个样本之间的遗传分化距离均为0。
构建的系统进化树显示,来自中国的所有铜藻样本聚为一支,然后再与韩国江陵市海区的AY149998.1样本聚合,而来自韩国仁川市海区AY149999.1样本则自为一支(图2)。

图2 基于铜藻ITS序列构建的系统进化树 (羊栖菜作为外类群)
2.2 coxI序列分析
本研究中所有样品的I序列长度为655 bp,经ClustalX比对分析结果显示,所有样品的I序列完全相同。与NCBI数据库中的相应序列进行比较,发现与来自温州南麂岛小虎屿(27°27′N, 121°04′E)定生铜藻样品的相应序列(KJ938300)完全相同,与另外2个采集地不详的铜藻(GenBank序列号为KC782896、JF718400)覆盖区序列的相似性在99%以上。
3 讨论
利用分子标记进行铜藻不同地理种群的系统发生研究已有一些相关报道。Hu等(2011)基于线粒体3和叶绿体L基因序列对西北太平洋地区铜藻的生物地理分布及分布影响因子的研究中,提出在中国黄渤海、东海、南海地区的洋流及沿岸流的影响下,分布在3个海洋区系内的铜藻形成狭窄的遗传结构,不具备明显的异质性。蔡一凡等(2013)对我国浙江沿海铜藻群体采集的样品进行5.8S rDNA-序列分析,表明仅有1个变异位点,说明群体间没有明显的遗传分化,遗传多样性较低。本研究发现,2016和2017年的中国近海10个铜藻漂浮地理种群以及3个采集地定生种的51个样本的I序列完全一致,序列存在2个变异位点,按基因型的异同可分为4个类型,而同一地理种群相同年份和不同年份的内部个体间均没有差异。基于序列构建的系统树显示,来自中国的所有铜藻聚为一支,与来自韩国的铜藻有一定的遗传距离,说明我国近海铜藻不同地理株间和I的遗传变异水平较低,但基因型存在一定差异,因此,漂浮铜藻可能具有不同的来源。而Su等(2018)利用多态性微卫星(SSR)标记对黄海、东海13个代表性漂浮种群和3个代表性定生种群遗传结构和亲缘关系进行分析,结果显示,相同年份漂浮铜藻的亲缘关系相近,而不同年份差异显著;同一漂浮种群内部也存在遗传分化,推测不同年份漂浮铜藻起源于不同的地点,同一漂浮种群的个体也可能源自不同地点。由于上述文献中铜藻种群的采集地点存在差异,所用的DNA分子标记也不同,因此,研究结论的不同还需要进一步分析和解析。
铜藻在温度为7.0℃~20.5℃时,均可以很好地生长,在10℃以下低温期能达到最高生长率,且对光照的适应范围很广(孙建璋等, 2009),因此,铜藻对环境具有较强的适应能力,可在中国沿海大范围的漂浮生长。2007~2017年卫星遥感的浒苔监测信息和海面风场资料分析表明,在风场和流场作用下,铜藻和绿潮浒苔由外长江口以北的黄海中南部漂到黄海北部(Hu, 2009; 金松等, 2016)。Komatsu等(2007、2008)通过GPS定位绑有漂浮藻类的浮标观测发现,春季到初夏期间,中国东海区域位于黑潮锋和大陆架之间的区域常有大片漂浮铜藻出现,进一步观察发现一处浮标可到达日本九州东侧海域,另一处可到达韩国济州岛南端,这也是目前关于漂浮铜藻溯源的最直接的证据。尽管铜藻在中国沿海均有分布,但铜藻主要是浙江沿海优势种,其中,南麂列岛和枸杞岛是我国铜藻数量自然分布最集中的水域(孙建璋等, 2008a; 毕远新等, 2014)。由于夏季东黄海盛行东南季风,在东南季风影响下,黄海表层海流基本上是由南向北流动,在黄海沿岸外侧海域,是由东南向西北方向流动(梁兼霞等, 2005),而表层流的流向决定海洋中漂浮海藻漂流方向。另外,本研究发现,威海俚岛和温州洞头的漂浮铜藻样本具有相同的序列,青岛雕塑园、王哥庄、大珠山、威海乳山的漂浮铜藻和枸杞岛的定生铜藻样本具有相同的序列,因此,推测山东沿海漂浮铜藻的源头之一可能在南黄海,在风浪和海流的作用下飘到黄海北部,部分在青岛和威海等地的海岸堆积,部分缠绕在养殖筏架上常年漂浮生长。
孙建璋等(2008b)研究表明,铜藻自然种群的繁衍以有性生殖为主,残枝营养繁殖藻株约占种群藻株总数的5%,但随着海洋污染加剧和海洋环境的变化,天然铜藻海藻场的面积不断缩小(孙建璋等, 2008a)。Su等(2018)研究发现,2013年近岸海域人工混凝土礁区采集的漂浮铜藻与2016年该区域发现的定生铜藻的亲缘关系较近,认为向北漂浮的铜藻能够完成生殖过程并在漂移的路径上形成定生的种群。2015~2017年,连续3年跟踪监测威海俚岛海区的漂浮铜藻,发现其形成成熟的有性生殖器官——生殖托的藻株数量不超过种群藻株总数的5%,漂浮铜藻主要通过断枝(Fragmentation)进行营养繁殖,因此,这可能是增加该藻资源量的一条有效途径,在一定程度上可为铜藻产业的发展提供种藻供应。但是,目前我们尚未在该海区发现定生的铜藻,因此,认为漂浮铜藻是否能形成定生种群尚待进一步的实验论证。由于大型漂浮藻类受风浪和海流等多种因素的影响,其时空分布和生物量可能会经常发生变化,因此,需要密切关注它们对生态环境的影响。
致谢:本研究承蒙中国科学院海洋研究所孙忠民老师提供烟台南隍城岛和大连獐子岛铜藻样品,谨此致谢!
Bi YX, Zhang SY, Wang WD,. Vertical distribution pattern ofand its relationship with environmental factors around Gouqi Island. Acta Ecologica Sinica, 2014, 34(17): 4931–4937 [毕远新, 章守宇, 王伟定, 等. 枸杞岛铜藻垂直分布格局及成因分析. 生态学报, 2014, 34(17): 4931–4937]
Cai YC, Sun B, Ma JH,. Molecular identification of floatingin the southern Yellow Sea. Marine Fisheries, 2014, 36(2): 102–106 [蔡永超, 孙彬, 马家海, 等. 我国南黄海海域漂浮铜藻的分子生物学鉴定. 海洋渔业, 2014, 36(2): 102–106]
Cai YF, Zhang P, Wang TG,. Genetic analysis based on 5.8S rDNA-sequence of(Turner) C. Agardh in the coastal areas of Zhejiang Province, China. Journal of Tropical and Subtropical Botany, 2013, 21(2): 147–154 [蔡一凡, 张鹏, 王铁杆, 等. 基于5.8S rDNA-序列的我国浙江沿海铜藻群体遗传多样性分析. 热带亚热带植物学报, 2013, 21(2): 147–154]
Chen J, Wang YC, Yu QR,. Molecular phylogenetic analysis of floatingassociated with green tides in coastal area of Qingdao. Journal of Biology, 2016, 33(1): 39–42 [陈军, 王寅初, 余秋瑢, 等. 绿潮暴发期间我国青岛漂浮铜藻的分子鉴定. 生物学杂志, 2016, 33(1): 39–42]
Hu CM. A novel ocean color index to detect floating algae in the global oceans. Remote Sensing of Environment, 2009, 113(10): 2118–2129
Hu ZM, Uwai S, Yu SH,. Phylogeographic heterogeneity of the brown macroalga(Fucaceae) in the northwestern pacific in relation to late Pleistocene glaciation and tectonic configurations. Molecular Ecology, 2011, 20(18): 3984–3909
Jin S, Han Z, Liu Y. A remote sensing method for discriminatingand. Remote Sensing Information, 2016, 31(2): 44–48 [金松, 韩震, 刘瑜. 一种区分浒苔和马尾藻的遥感方法. 遥感信息, 2016, 31(2): 44–48]
Komatsu T, Matsunaga D, Mikami A,. Abundance of drifting seaweeds in eastern East China Sea. Journal of Applied Phycology, 2008, 20(5): 801–809
Komatsu T, Tatsukawa K, Filippi JB,. Distribution of drifting seaweeds in eastern East China Sea.Journal of Marine Systems, 2007, 67(3–4): 245–252
Kucera H, Saunders GW. Assigning morphological variants of(Fucales, Phaeophyceae) in Canadian waters to recognized species using DNA barcoding. Botany-Botanique, 2008, 86(9): 1065–1079
Lane CE, Lindstrom SC, Saunders GW. A molecular assessment of northeast Pacificspecies (Laminariales, Phaeophyceae) with reference to the utility of DNA barcoding. Molecular Phylogenetics and Evolution, 2007, 44(2): 634–648
Liang JX, Pang CG, Bai XZ. Different methods for computation of wind-induced currents in southern Yellow Sea in summer. Marine Science, 2005, 29(9): 60–64, 75 [梁兼霞, 庞重光, 白学志. 夏季南黄海风漂流的不同计算方法的对比分析. 海洋科学, 2005, 29(9): 60–64, 75]
Liu F, Pang SJ. Research advances on green tides in the yellow sea. Advances in Marine Science, 2012, 30(3): 441–449 [刘峰, 逄少军. 黄海浒苔绿潮及其溯源研究进展. 海洋科学进展, 2012, 30(3): 441–449]
Liu L, Heinrich M, Myers S,. Towards a better understanding of medicinal uses of the brown seaweedin traditional Chinese medicine: A phytochemical and pharmacological review. Journal of Ethnopharmacology, 2012, 142(3): 591–619
Mcdevit DC, Saunders GW. On the utility of DNA barcoding for species differentiation among brown macroalgae (Phaeophyceae) including a novel extraction protocol. Phycological Research, 2009, 57(2): 131–141
Su L, Shan TF, Pang SJ,. Analyses of the genetic structure ofin the Yellow Sea: Implications of the temporal and spatial relations among floating and benthic populations. Journal of Applied Phycology, 2018, 30(2): 1417–1424
Sun JZ, Chen WD, Zhuang DG,. In situ ecological studies of the subtidal brown algaat Nanji Island of China. South China Fisheries Science, 2008a, 4(3): 58–63 [孙建璋, 陈万东, 庄定根, 等. 中国南麂列岛铜藻实地生态学的初步研究. 南方水产, 2008a, 4(3): 58–63]
Sun JZ, Zhuang DG, Chen WD,. Studies on sexual reproduction and seedling production of the brown alga. South China Fisheries Science, 2008b, 4(2): 6–14 [孙建璋, 庄定根, 陈万东, 等. 铜藻繁殖生物学及种苗培育研究. 南方水产, 2008b, 4(2): 6–14]
Sun JZ, Zhuang DG, Sun QH,. Artificial cultivation trials ofat Nanji islands of China. South China Fisheries Science, 2009, 5(6): 41–46 [孙建璋, 庄定根, 孙庆海, 等. 铜藻人工栽培的初步研究. 南方水产, 2009, 5(6): 41–46]
Wang GC, Tang XX, He PM,. Progress of studies on the responses of the key physiological processes including photosynthese inO. F. Müller to environmental factors. Plant Physiology Journal, 2016, 52(11): 1627–1636 [王广策, 唐学玺, 何培民, 等. 浒苔光合作用等关键生理过程对环境因子响应途径的研究进展. 植物生理学报, 2016, 52(11): 1627–1636]
Wang WJ, Wang FJ, Chen SL,. PCR amplification and sequence analysis ofregions of. Marine Fisheries Research, 2008, 29(5): 124–129 [汪文俊, 王飞久, 陈松林, 等. 浒苔区的扩增和分析. 海洋水产研究, 2008, 29(5): 124–129]
White TJ, Bruns T, Lee S,. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols, 1990, 315–322
Yoshida T, Stiger V, Horiguchi T.sp. nov. (Fucales, Phaeophyceae) from Hokkaido, Japan. Phycological Research, 2000, 48(3): 125–131
Zeng CK, Lu BR. Marine algal flora of China, Volume 3 Phaeophyta, No.2 Fucales. Beijing: Science Press, 2000, 43–44 [曾呈奎, 陆保仁. 中国海藻志第三卷褐藻门第二册墨角藻目. 北京: 科学出版社, 2000, 43–44]
Zhan DM, Wang XY, Xin ML,. Nutritional constituents of three kinds of. Journal of Guangxi Academy of Sciences, 2016, 32(3): 221–225 [詹冬梅, 王翔宇, 辛美丽, 等. 三种马尾藻的营养组成分析. 广西科学院学报, 2016, 32(3): 221–225]
Analysis of the Similarity ofandI Sequences ofAlong the Offshore of China
LÜ Fang1,2, GUO Wen1, DIND Gang1,2, LIU Wei1,2, ZHAN Dongmei1,2, WU Haiyi1,2①
(1. Marine Biology Institute of Shandong Province, Qingdao 266104; 2. Qingdao Macroalgae Engineering Technology Research Center, Qingdao 266104)
Large-scale green tides have broken out annually in the Yellow Sea since 2007, which, upon twinning with floating, became a new hazard and increased the difficulty of preventing and controlling the green tide in Shandong Peninsula. In this study, the similarity ofandI sequences were analyzed usingsamples collected from ten free-floating populations and three benthic populations in 2016 and 2017 along the offshore of China. The results showed that theI sequences of 51 samples were consistent, while there were two variable nucleotide sites within thesequence. Based on genotypic differences,samples could be sorted into four categories, among which the genotype of free-floating samples from Dalian Longwangtang, Daqin Island, and Nanhuangcheng Island of Yantai were identical. Free-floating samples from the Golden Beach of Qingdao and benthic samples from Daqin Island of Yantai and Zhangzi Island of Dalian were identical; free-floating samples from Lidao of Weihai and Dongtou of Wenzhou were identical; and free-floating samples from the Sculpture Garden, Wanggezhuang, Dazhushan of Qingdao, Rushan of Weihai, and benthic samples from Gouqi Island were identical. However, there was no difference in genotype among individuals within the same population, even among those occurring in different years. A phylogenetic tree based onsequences ofshowed that samples from China were clustered together; however, there was some genetic distance from the Korean samples. It is possible that the genetic variation ofandI regions is low in different coastal strains of, and that drifting population could be of different origins. These findings will provide a basis for further understanding of the molecular genetic background ofalong the offshore of China.
; Free-floating; Benthic;;I; Sequence similarity
WU Haiyi, E-mail: wuhaiyi1997@163.com
吕芳, 郭文, 丁刚, 刘玮, 詹冬梅, 吴海一. 中国近海铜藻与I序列相似性分析. 渔业科学进展, 2018, 39(6): 141–146
Lü F, Guo W, Dind G, Liu W, Zhan DM, Wu HY. Analysis of the similarity ofandI sequences ofalong the offshore of China. Progress in Fishery Sciences, 2018, 39(6): 141–146
* 海洋公益性行业科研专项经费项目(201505022)和山东省农业重大应用技术创新项目共同资助[This work was supported by the Public Science and Technology Research Fund Projects of Ocean (201505022), and Agricultural Application Technology Innovation Project of Shandong]. 吕 芳,E-mail: lvfang8254@163.com
吴海一,研究员,E-mail: wuhaiyi1997@163.com
2017-11-21,
2017-12-18
10.19663/j.issn2095-9869.20171121001
S917.3
A
2095-9869(2018)06-0141-06
(编辑 马璀艳)
