成都市武侯区妇女高危型人乳头瘤病毒的流行病学研究
2018-12-18刘佳欣吴方银
刘佳欣, 吴方银, 梅 榕, 明 娟, 刘 玖
(四川省妇幼保健院, 1. 妇幼健康管理部; 2. 生殖医学中心, 四川 成都, 610045)
宫颈癌是较为常见的女性生殖系统恶性肿瘤,其发病原因与病毒感染有关,尤其与人乳头瘤病毒(HPV)16、18型感染高度相关[1-3]。HPV病毒种类多样,按照其引起的不同临床表现可分为黏膜高、低危型与皮肤高、低危型[4-6]。高危型HPV会引起外生殖器癌、子宫颈癌和宫颈上皮细胞癌变,对患者的生命健康造成严重威胁[7-8]。本研究选取34 000名检测HPV的女性,探讨HPV的类型分布特征及宫颈癌患病的高危人群,现报告如下。
1 资料与方法
1.1 一般资料
选取2016年1月—2018年4月四川省妇幼保健院行HPV检测的34 000位妇女为研究对象。纳入标准: ① 年龄25~65岁; ② 无精神失常类疾病以及其他身体缺陷; ③ 无外阴部细胞学与宫颈异常病史; ④ 子宫和宫颈完整,未采用手术切除或部分切除; ⑤ 无怀孕患者; ⑥ 户口所在地为成都市武侯区,且为辖区常住人口; ⑦ 同意签署知情同意书。经过筛选,有14 000名妇女被纳入调查,登记研究对象姓名并编号。
1.2 实验方法
1.2.1 宫颈细胞采样: 所有参加本次调查的医生以及调查人员进行2周的培训; 规范调查问卷书写方式和标准(如有不能书写的调查对象,则由该调查对象进行口头描述,研究人员代写); 规范宫颈脱落细胞的收集流程与保存的方式、方法。接受调查的所有人员先要填写一份调查问卷,不符合筛选条件的不再进行进一步分析。符合条件者需接受1个常规妇科检查,并在检查过程中采集宫颈脱落细胞标本,要求所有样本在3周内检测完毕。
1.2.2 试剂与仪器: 人乳头状瘤病毒核酸扩增荧光检测试剂盒、人乳头状瘤病毒核酸扩增分型检测试剂盒购自Takara; 琼脂糖、溴化乙锭、三羟甲基氨基甲烷购自美国Sigma公司;硼酸、乙二胺四乙酸购自北京化工厂;宫颈拭子、标本储存瓶购自北京艾然生物科技有限有限公司; PCR管购自美国Corning公司;微量移液枪购自法国Eppendorf公司; Hybri Max型导流杂交仪购自凯普生物科技公司; Nanodrop光度计购自Thermo Scientific。
1.2.3 检测方法: 先用HPV核酸扩增荧光检测试剂盒,该试剂盒可以检测出13种与宫颈癌相关的HPV类型(16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68), 但是该试剂盒不能对DNA进行分型。先用此试剂盒鉴定研究对象是否被HPV病毒感染,实验严格按照试剂说明书依次进行DNA提取、浓度测定,置于ABI Stepone PCR 扩增仪上扩增检测,根据扩增过程中收集的荧光信号判断是否存在HPV病毒的感染及判断阳性者的病毒载量,然后将PCR扩增产物通过人乳头状瘤病毒核酸扩增分型检测试剂盒进行分型检测。核酸扩增采用美国ABI公司7500型PCR仪,核酸杂交采用凯普公司配套生产的医用核酸分子快速杂交仪(Hybri Max)。感染2种及以上HPV基因型为复合型感染[9]。
1.3 统计学分析
使用Graphpad Prism数据处理软件对计数资料进行统计与作图分析,P<0.05为差异有统计学意义。
2 结 果
2.1 不同年龄组HPV阳性率比较
14 000名受检对象根据年龄分为A组(≤35岁)、B组(>35岁~≤45岁)、C组(>45岁~≤55岁)、D组(>55岁~≤65岁)。A组、B组、C组、D组HPV阳性率分别为7.93%(230/2 900, 95%CI为6.70~7.94)、8.90%(430/4 830, 95%CI为7.12~7.15)、9.94%(90/5 330, 95%CI为7.46~8.51)、9.57%(530/940, 95%CI为8.65~10.60), 其中A组与B组无显著差异(P>0.05), 但C组与A、B、D组相比均有显著差异(P<0.05)。本研究人群高危型HPV总感染率9.14%(1 280/14 000, 95%CI为7.63~8.11)。在1 280例高危型HPV病毒感染患者中,有120例不能与21型探针的任一基因型进行配对,将这些基因样本记为未知型X,下文只对余下的1 160例高危型HPV病毒类型的基因进行探讨。
2.2 与宫颈癌相关的人乳头瘤病毒类型及比例
在与宫颈癌相关的单一类型人乳头瘤病毒类型中,比例最高的为-52型(22.41%), 其次为-16型(12.56%), -33型(9.76%), -58型(5.26%), -68型(5.20%), -18型(5.16%), -31型(3.34%), -59型(4.01%), -39型(2.02%), -51型(1.32%), -56型(1.12%), -35型(0.48%), -45型(0.37%)。单一类型HPV感染率为69.82%, 还有27.90%人群被诊断为多种高危HPV感染。
2.3 复合HPV感染例数及比例
感染1种HPV病毒者810例(69.83%), 感染2种HPV病毒者160例(13.79%), 感染3种HPV病毒者140例(12.07%), 感染4种HPV病毒者30例(2.59%), 感染5种HPV病毒者18例(1.55%), 感染6种及6种以上HPV病毒者2例(0.17%)。
2.4 与宫颈癌相关的人乳头状瘤病毒的年龄分布
统计所有高危型HPV感染患者(包括单一感染和多重感染)的年龄,发现各高危型HPV亚型中不同年龄段比例的差异无统计学意义(P>0.05), 且呈随机分布,见表1。

表1 单一类型HPV感染类型的年龄分布情况[n(%)]
2.5 多种HPV感染与年龄分布
随着年龄的增加,人群中感染2种以上HPV的概率增大,其中D组感染3、4、5种HPV的患者比例最高(P<0.05), 各组感染1或6种HPV的患者比例无显著差异(P>0.05), 见表2。
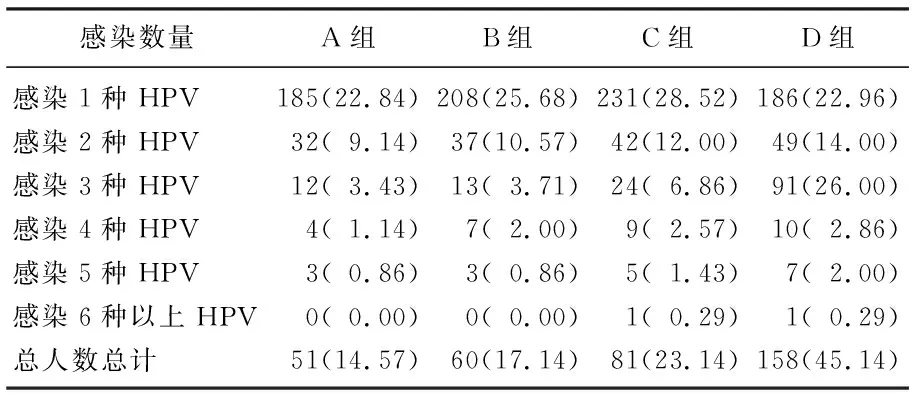
表2 多种HPV感染的年龄分布情况[n(%)]
3 讨 论
宫颈癌是较为常见的女性生殖器恶性肿瘤,与肝癌、肺癌、胃癌等许多原发癌症不同,宫颈癌可以通过分析宫颈脱落细胞学进行筛查,从而在宫颈细胞发生恶性转化前加以控制,降低宫颈细胞癌变对机体的损害[10]。研究[11]证明原发性宫颈癌的发生与HPV感染有关。HPV是一种可引起人体皮肤黏膜鳞状上皮细胞增殖的球形DNA病毒,有多种亚型,其中可以引发宫颈癌、直肠癌、口腔癌、扁桃体癌等多种癌症的统称为高危型HPV[12]。
有研究[13]指出,高危型HPV感染率与地域、年龄、生活作息习惯等有密切联系。本研究选取本地25~65岁妇女作为研究对象,其主要原因为35~60岁为宫颈癌的高发年龄,鉴于宫颈癌的发病有年轻化的趋势,所以将年龄范围扩展至25~65岁。作者发现成都市武侯区14 000例受检对象中共有1 280例调查对象被确认为与宫颈癌相关的HPV携带者,感染率为9.14%, 高于杨丽娟等[14]报道的西南地区HPV平均感染率7.89 %。处于45~55岁的高危型HPV感染率(9.94%)显著高于处于其他任一年龄段的高危型HPV感染率,原因可能与中国女性在45周岁以后开始出现绝经有关,绝经期后妇女的性激素水平与绝经前相比明显降低,这直接导致了绝经后妇女某一时段免疫力的下降,从而导致了HPV的易感性及潜伏时间的延长[15]。作者通过对不同年龄段-52型HPV感染情况进行对比发现, -52型HPV在年龄大于55岁以上的人群中具有较高的比例。在所有的HPV携带者中还有较高比例的人群被诊断为多种高危型HPV感染,该比例为27.34 %(350/1 280)。复合型HPV感染分析结果显示,复合型HPV感染率的感染型别与感染人数呈负相关,但是高危型HPV型别随着年龄的增加而呈现出一定的正相关性。
