缺氧诱导因子抑制剂对去卵巢大鼠骨质疏松症治疗效果的研究
2018-12-18张文韬陈勋宋涛杜晓龙喻姿瑞
张文韬 陈勋 宋涛 杜晓龙 喻姿瑞
西安市红会医院骨显微修复外科,陕西 西安 710054
骨质疏松症是一种骨代谢疾病,其特征为骨量减少,骨微结构恶化和骨折风险增加,破骨细胞的骨吸收超过成骨细胞的骨形成[1-2]。由于亚洲人口的体重指数较低,身高较矮,缺乏体力活动和低膳食钙摄入量,因此东方人出现骨质疏松症更为普遍[3]。随着抗吸收或合成代谢治疗药物研究的进展,大量的研究探索了骨质疏松症的科学发病机制和治疗骨质疏松症的治疗选择,但骨质疏松症的潜在机制和治疗仍有待阐明[4]。充足的氧气和营养物质对细胞存活和新陈代谢至关重要。缺氧在细胞生长抑制,氧化应激和凋亡中起着重要的作用[5]。缺氧可以抑制大鼠成骨细胞的骨形成能力,生长和分化[6]。低氧诱导因子是细胞对缺氧反应的主要调节剂,许多研究已经证明[7]低氧诱导因子水平降低能促进多能人类间充质基质细胞的募集和分化。此外,较低水平的低氧诱导因子可以通过在软骨内骨化中激活血管内皮生长因子来引起增强的骨重建[8]。因此,是否可以通过抑制低氧诱导因子介导的骨形成受限来治疗骨质疏松症?本研究将探讨缺氧诱导因子抑制剂[3-(5-羟基甲基-2-呋喃基)-1-苯基吲哚,QF-1]对骨质疏松大鼠的影响,验证这种方案的可行性。
1 材料和方法
1.1 实验动物
本实验使用16周龄雌性Sprague-Dawley大鼠(购自上海实验动物中心),体重245~278 g。动物喂食商品实验室食物。测试期间保持温度恒定为25 ℃,湿度恒定为(50±20)%,允许大鼠自由接近蒸馏水。将大鼠分成3组,每组10只。QF-1 (纯度98.00%)购自Sigma(St.Louis,MO)。
1.2 模型建立和治疗
适应7 d后,对大鼠进行卵巢切除术(n=20)和假手术(n=10)。10只大鼠接受假性卵巢切除术,作为对照组确定是否成功建立骨质疏松症模型。其余20只在戊巴比妥钠麻醉下行双侧卵巢切除手术。去卵巢大鼠随机分为Sham组,QF-1组,OVX组。测量每组的每日食物摄入量,并且每周称量这些大鼠。在去卵巢后为QF-1组立即皮下注射QF-1[2.5 mg (kg·d)],持续8周。
1.3 标本收集和生化评估
治疗8周后,在过量的异氟烷下处死大鼠。通过腹主动脉取血,离心获取血清进行生化指标分析,采用酶联免疫吸附试验(ELISA)试剂盒(北京北方生物技术公司)测定血清I型前胶原氨基末端前肽(PINP)和Ⅰ型胶原羧基端肽(CTX-I)浓度。
1.4 Micro-CT检测
采用Micro-CT(SkyScan 1174,Aartselaar,比利时)检测大鼠右侧胫骨。评估在近侧生长板下方1 mm处选择的3 mm厚的感兴趣的体积(VOI)。 Micro-CT参数:管电压50 kV;管电流:0.1mA;切片厚度:15 mm;像素尺寸:15 mm。 检测骨体积分数(bone volume ratio,BV/TV),骨密度(bone mineral density,BMD),骨小梁厚度(trabecular thickness,Tb.Th)、骨小梁数量(trabecular number,Tb.N)、骨小梁分离度(trabecular separation,Tb.Sp)。
1.5 生物力学评估
取大鼠右侧股骨,将其置于MTS-858型生物力学实验机上,支点跨距17 mm,中点为加压点,加载速度为 2 mm/min,计算机记录载荷-位移曲线,从载荷-变形曲线计算极限载荷(N),能量(J)和刚度(N/mm)。
1.6 统计学分析
2 结果
2.1 去卵巢手术对大鼠骨密度影响
来自Sham和OVX组的大鼠股骨干骺端的BMD为(230.32±29.23)mg/cm2和(184.45±26.95)mg/cm2。在定量分析中,来自Sham组的大鼠股骨干骺端的BMD比OVX大鼠的高27.3%。这些数据证实我们实验中OVX大鼠骨质疏松症的建立是成功的。
2.2 Micro-CT检测结果
治疗8周大鼠的胫骨Mciro-CT扫描结果如图1所示,微观参数如图2所示。与OVX组相比,QF-1组和Sham组的股骨远端骨量和小梁厚度显著增加(P<0.05);而OVX组的小梁间距增加(P<0.05)。但在QF-1组和Sham组中均降低(P<0.05)。骨组织形态计量学参数显示,QF-1对去卵巢大鼠胫骨骨量和骨密度起保护作用。

图1 治疗8周后大鼠胫骨Micro-CT扫描结果Fig.1 Micro-CT scans of tibia in rats after 8 weeks treatment

图2 治疗8周后大鼠胫骨微观参数Fig.2 Microscopic parameters of tibia in rats after 8 weeks treatment
注:与OVX比较,*P<0.05;与QF-1比较,#P<0.05。
2.3 生物力学性能
生物力学测试获得的数据见图3,Sham组具有最高的极限载荷,能量和刚度;与OVX组比较,QF-1组极限载荷,能量和刚度明显增加,差异有统计学意义(P<0.05)。
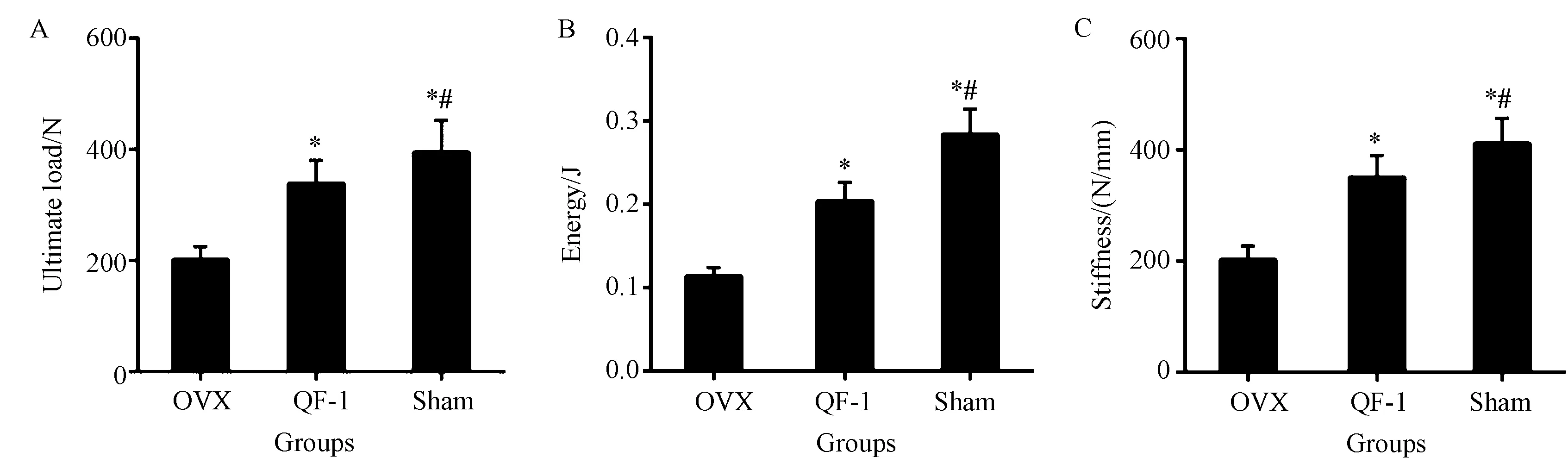
图3 治疗对大鼠股骨生物力学的影响Fig.3 Effects of treatment on femur biomechanics
注:与OVX比较,*P<0.05;与QF-1比较,#P<0.05。
2.4 治疗后大鼠血清CTX-I和PINP的影响
治疗后大鼠血清CTX-I和PINP如图4所示,与Sham组比较,OVX和QF-1组的CTX-I和PINP显著增加(P<0.05)。 QF-1组的CTX-I和PINP较OVX组明显降低,差异有统计学意义(P<0.05)。
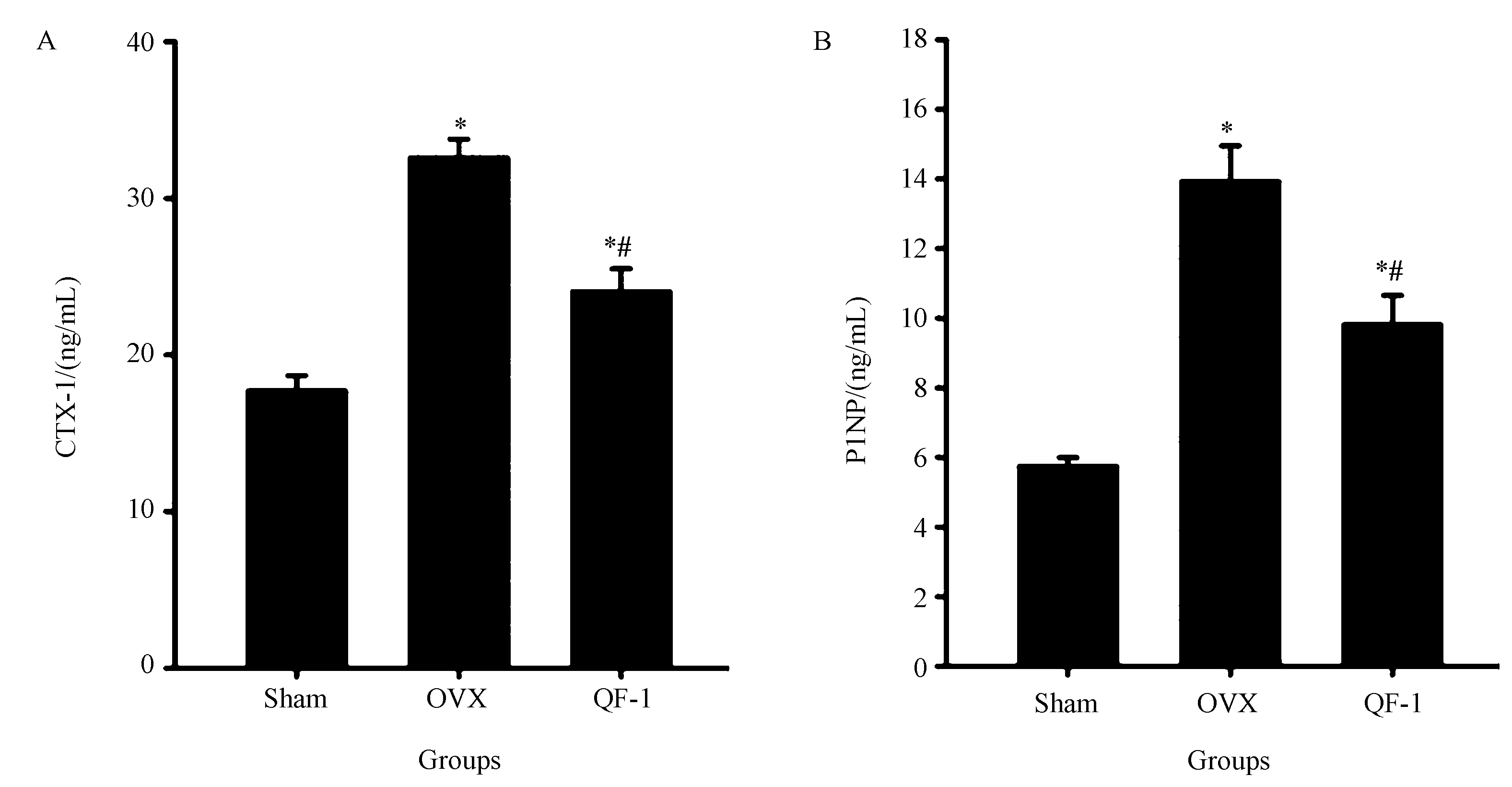
图4 治疗对大鼠血清CTX-I和PINP的影响Fig.4 Effects of treatment on serum CTX-I and PINP
注:与Sham比较,*P<0.05;与OVX比较,#P<0.05。
3 讨论
骨质疏松症是一种全身代谢性疾病,其特征为骨质疏松,骨结构细微破坏,骨强度降低和骨折风险增加。骨质疏松症可分为两类:原发性和继发性。在临床上,原发性骨质疏松症可能是绝经后妇女体内激素缺乏的结果,它可以表现为老年性骨质疏松症本身,由许多因素引起,或者可以将其归类为特发性。继发性骨质疏松症主要是由以下一种或多种原因造成的:内分泌因素,过量使用激素药物,营养不足,疾病或其他原因,如日光照射,吸烟,饮酒或维生素D合成问题。考虑到病情发展和当前状况,骨质疏松症已经成为重要的公共卫生问题之一。本研究中,在雌激素缺乏诱导的骨质疏松症的大鼠模型中测试QF-1的功效,并检查骨重建中的调节功能。在OVX动物中,QF-1改善了小梁骨微结构并减少了骨吸收。这些结果提供了QF-1作为新型抗吸收治疗绝经后骨质疏松症的有力证据。
绝经后骨质疏松症的骨丢失主要是由于骨形成反应不足导致的骨吸收相对过多[9]。雌激素主要通过对破骨细胞施加直接作用来抑制骨吸收,尽管雌激素对成骨细胞/骨细胞的作用和T细胞介导的破骨细胞调节也可能起作用。生理条件下的活性基础多细胞单位内,在重塑周期的再吸收阶段,骨被破骨细胞不断移除。逆转阶段后,在形成期间,发生骨吸收的部位处由成骨细胞产生新的骨基质,其中形成的骨量等于骨再吸收的量,从而维持骨量[10-11]。正常骨形成和维持需要成骨细胞和破骨细胞活性之间的平衡。已经描述了一种偶联机制,其中再吸收产物和破骨细胞衍生因子刺激成骨细胞谱系细胞的骨形成[10]。类似地,成骨细胞谱系中的细胞调节破骨细胞形成和活性。由于重塑的耦合性质,大多数可用的抗吸收剂也直接或间接减少骨形成,限制其对骨量的作用。在本研究中,我们观察到QF-1治疗组与OVX组相比,骨量明显增加。
此外,我们仅观察到QF-1对成骨细胞介导的骨形成作用较小,且无显著影响。 QF-1对骨骼的合成代谢作用是否需要进一步研究及QF-1处理的破骨细胞在骨骼重塑的逆转阶段中的作用尚待确定。各种抗吸收剂靶向破骨细胞中不同的信号通路,可能为复杂病理性骨重建阶段的骨质量和质量改善提供有用的工具[10]。应特别注意用于治疗绝经后或老年性骨质疏松症药物的禁忌症。QF-1通过引起破骨细胞凋亡而发挥抗骨质疏松作用[12],因此是骨吸收的强有力抑制剂。然而,双膦酸盐如阿仑膦酸钠在骨组织中的作用会持续数年,这可能导致不期望的临床副作用,包括骨坏死和非典型骨折。
联合治疗仍然是提高骨质疏松症患者抗骨折疗效的有效方法[13]。当考虑与其他抗吸收剂和合成代谢剂的组合疗法累加效应时,QF-1可能是更好的抗吸收性候选者。当然,本研究也有不足之处。首先,在本研究中,我们仅分析了QF-1在OVX诱导的骨质疏松大鼠的治疗中的一个剂量和给药途径。尽管观察到该剂量下QF-1的骨骼效应很明显,但是可以通过改变药代动力学、给药方式或治疗持续时间来进一步改善。通过Micro-CT测量,QF-1缓解并减少了OVX大鼠的骨吸收参数。通过显微CT测量以及血清骨吸收参数显示,QF-1可以改善OVX大鼠骨小梁的骨丢失。QF-1的抗吸收作用提示了绝经后骨质疏松症新的治疗尝试。
