基于多维蛋白质组学的孤儿受体NR2F2功能研究
2018-12-13秦兆宇贺福初
丁 铭 秦兆宇 丁 琛,3 贺福初,2,4
(1复旦大学生物医学研究院 上海 200032; 2国家蛋白质科学中心 北京 102206; 3复旦大学生命科学学院遗传工程国家重点实验室 上海 200438;4蛋白质组学国家重点实验室-北京放射医学研究所 北京 102206)
核受体是一类在生物体内广泛分布的、配体依赖的转录因子超家族,成员众多,可分为3类:类固醇激素受体、非类固醇激素受体和孤儿受体。核受体与相应的配体及其辅调节因子相互作用,调控基因的协调表达,从而涉及到如控制胚胎发育、细胞生命活动和稳态等重要的生理功能。除了正常的生理功能外,核受体家族成员还参与众多疾病,如癌症、糖尿病、类风湿关节炎、哮喘及激素抵抗综合征等。目前已知的人体核受体共有48个,其中25个为孤儿受体[1],其内源性配体及功能尚不明确。
我们在前期工作中筛选出多个孤儿受体与肺癌发生相关,其中包括NR2F2 (chicken ovalbumin upstream promoter transcription factorⅡ)。NR2F2在生命体内多个组织器官中广泛存在,在胃、小肠、结肠中有较高的表达[2],在乳腺癌、前列腺癌、结肠癌以及肺癌等多种肿瘤组织中也广泛存在[3]。NR2F2参与神经细胞的发育、视觉细胞以及血球细胞的生成。NR2F2的表达与小鼠出生早期胚胎发育相关,NR2F2缺乏的幼鼠会出现神经系统发育紊乱、出生缺陷或出生致死现象;还有研究表明NR2F2对于心血管的形成及心血管相关疾病起到至关重要的作用[4]。NR2F2在多种生命活动中起重要作用,但其具体功能以及参与调控的靶基因尚不明确。
本研究利用我们前期开发的转录因子快速鉴定模型(catTFREontips,TOT)技术[5],首先快速鉴定出活性受NR2F2影响的下游内源性转录因子;然后通过RNA-seq和全蛋白质谱(protein profiling-MS)检测,进一步发现NR2F2直接或间接调控的下游靶基因,并利用实时定量PCR (real time quantitative PCR,qPCR)和Western blot对上述基因进行验证,以期探索NR2F2的具体功能。
材 料 和 方 法
主要试剂与材料HEK293T、A549细胞购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。RPMI 1640和1X(10-040-CVR)购自美国Corning公司,Xba1快切酶(FD0685)、Nhe1快切酶(FD0973)和蛋白质预染标志物(SM0671)购自美国Fermentas公司,PrimeScript®RT试剂盒(DRR037A)和SYBR®PremixExTaqTM(DRR041A)购自日本Takara公司,TransZolUP(ET111-01)购自北京全式金生物技术有限公司,BCA蛋白质浓度测定试剂盒(P0012)和一抗稀释液(P0023D)购自碧云天生物技术研究所。
质粒构建NR2F2质粒来自于美国贝勒医学院,将Flag-NR2F2质粒连接到慢病毒载体pCDH-puro上,软件设计引物序列:正义链,5’-TGCTCT-AGAACCACCATGGATTACAAGGAT-3’;反义链,5’-ATAGTTTAGCGGCCGCTTATTGAATT-GCCATATACG-3’。
过表达稳定株的构建转染前一天准备293T细胞,转染1 h前换为无血清的培养基6 mL,取2支离心管(1.5 mL)各加入Opti-MEM培养基600 μL,其中一支加入4 μg pCDH-Flag-NR2F2、1 μg pSD和3 μg psPAX2,另一支加入4 μg pCDH-puro、1 μg pSD和3 μg psPAX2,再加入待转染质粒和24 μL PEI转染试剂。混匀后静置20 min,滴加到培养皿中,4~6 h后换为正常培养基,48 h后取病毒上清,感染A549细胞。
Westernblot待细胞长到90%的汇合度时,用SDS裂解液提取全蛋白质,用BCA法测蛋白质浓度,配置10%的SDS-PAGE凝胶,电泳后进行转膜,一抗稀释液稀释,4 ℃孵育过夜,二抗(2%奶粉溶液稀释)室温孵育1 h,用ECL发光试剂孵育,Las4000仪器扫膜获取蛋白条带。
catTFREontip收集细胞与提取核蛋白:pCDH-NR2F2过表达组与pCDH对照组各准备两皿细胞,胰酶消化收集,细胞沉淀用低渗溶液重悬,冰置30 min,液氮速冻,-80 ℃冷冻。制备TFRE-easy Tip:分别向T400枪头中加入乙腈100 μL,静置1 min,200×g离心1 min。分别向T400枪头中加入BC200溶液100 μL,200×g离心2 min。DNA和M280磁珠结合:每个样品取20 μL M280磁珠,分别加入0.5 pmol/L (1 μg) TFREDNA,置于4 ℃垂直混匀30 min。加载磁珠:将磁珠用少量体积的BC200重悬并转移至T400枪头中,分别加入约50 μg核蛋白,并与磁珠充分混匀。冰上静置10 min后500×g离心,每5 min将离心沉淀的核蛋白重新加入T400枪头中,并充分混匀磁珠。在去除非特异蛋白质之后转移磁珠到新的T400枪头中。磁珠上酶解:加入胰酶溶液,37 ℃静置1 h。乙腈洗脱:使用100 μL 50%乙腈(含有0.1%甲酸)洗脱,混匀后振摇5 min,300×g离心3 min,合并2次洗脱液,置于真空干燥仪抽干。将干燥后的肽段重新溶解到0.1%甲酸溶液中,溶解后样品在QExactivePlus质谱仪(美国ThermoFisher公司)上进行分离和质谱检测。利用MaxQuant对蛋白质进行定量,蛋白质和肽段水平错误发现率(false discover rate,FDR)小于0.01。
全蛋白质谱测定样品裂解:样品[(1~1.5)×106个细胞]中加入100 μL 8 mol/L尿素裂解液,置于冰上裂解15 min,超声后用Bradford法定量蛋白质,取10 μg蛋白质样品进行还原烷基化。FASP酶解:将裂解液加入超滤膜,装入套管,600 r/min涡旋1 min;装入套管,14 000×g离心15 min,弃废液;分别加200μL 8 mol/L尿素裂解液,600 r/min涡旋1 min,14 000×g离心15 min,弃废液;然后加入200 μL 50mmol/L碳酸氢铵溶液,14 000×g离心15 min,弃废液;加入胰蛋白酶,37 ℃消化4~6 h。酶解完成后14 000×g离心10 min,收集溶液。将样本浓缩合并至新离心管中,真空干燥。sRP:将抽干的样品梯度洗脱到对应的1.5 mL EP管中(表1),置于真空干燥仪抽干,进行质谱鉴定。干燥后的肽段重新溶解到0.1%甲酸溶液中,溶解后样品在QExactivePlus质谱仪上进行分离和质谱检测。利用MaxQuant对蛋白质进行定量,蛋白质和肽段水平FDR<0.01。
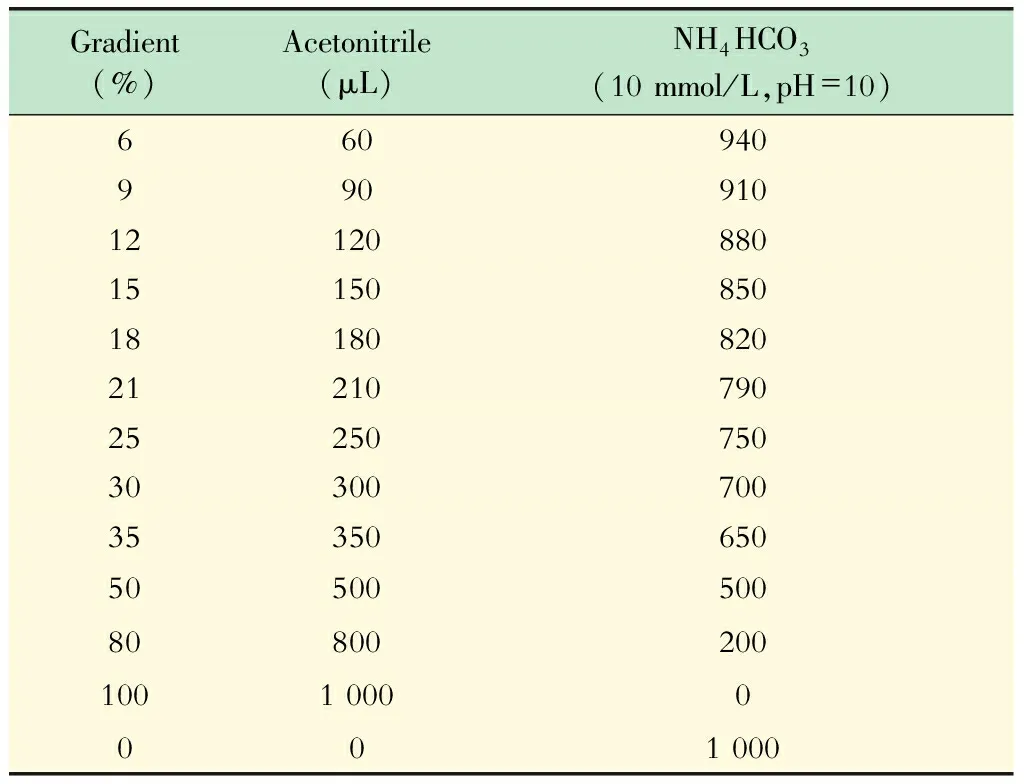
表1 样品洗脱梯度Tab 1 Gradient of sample solution
RNA-seq对照组和实验组各一皿细胞,1×PBS清洗后分别加入1 mL Trizol试剂,转移到1.5 mL EP管中,吹打混匀,静置30 min,保存于-8 ℃,由华大基因公司进行RNA-seq实验。
RT-qPCR用Trizol试剂提取总RNA,逆转录以后进行RT-qPCR,上、下游的引物序列见表2。
LC-MS/MS质谱待测样品通过NanoLC-MS/MS纳升液相高分辨质谱联用系统(Easy-nLC1000液相/QExactivePlus高分辨质谱仪/Nano-flex ESI离子源,美国ThermoFisher公司)进行分离和检测。液相自制预柱360 μm×2 cm,自制分析柱150 nm×10 cm,填料均为C18 (1.9 μm,120 A),(德国Dr.Maisch公司)。质谱上样:10 μL上样缓冲液(5%甲醇+0.2%甲酸)溶解待测样品,加入上样孔中,自动进样。
生物信息学分析利用IBQA (intensity based absolute protein quantification)方法定量计算蛋白质丰度并进行FOT(fraction of total protein)校正(将IBAQ值转换为占个组IBAQ总值的比例),通过计算实验组与对照组的FOT比值(fold-change)筛选显著性差异表达的蛋白质。对于转录组数据(质控FPKM>1),我们通过计算实验组与对照组的fold-change来筛选显著性差异表达的基因。最后通过R、DAVID6.8等软件进行分析和绘图。

表2 RT-qPCR引物Tab 2 RT-qPCR primer
统计学处理采用Graphpad 5.0软件对所有数据进行统计处理,采用双侧t检验,P<0.05为差异有统计学意义。
结 果
结合多维蛋白质组学对NR2F2进行功能研究通过TOT实验对转录因子结合活性进行检测,寻找NR2F2调控的转录因子;筛选显著性变化的转录因子,通过RNA-seq和全蛋白质谱来寻找这些转录因子下游靶基因,以此深入阐述NR2F2具体功能(图1A)。我们选用人非小细胞肺癌细胞系A549构建过表达稳定株,通过免疫荧光实验验证pCDH-Flag-NR2F2能够在细胞核内稳定表达(图1B)。以空质粒pCDH为阴性对照,pCDH-NR2F2为过表达稳定细胞株分别进行RT-qPCR和Western blot进行过表达效率的验证,均证明pCDH-NR2F2组能够显著过表达目标基因(图1C、1D)。
蛋白质非标定量质谱分析及数据可靠性分析以空质粒pCDH为阴性对照,过表达pCDH-NR2F2的稳定株细胞为实验组,分别进行TOT-MS和全蛋白质谱,上述实验均完成3次生物学重复,结果显示相关性较高(r=0.9,图2A)。同时对实验组和对照组的细胞进行RNA-seq,通过计算log2(fold-change)数值展示出转录组与蛋白质组的分布密度(图2B),显示转录组与蛋白质组之间的差异性。在完成TOT、全蛋白质谱和RNA-seq之后,结合三维蛋白质组学的数据进行整合分析(图2C):通过TOT数据寻找差异表达的转录因子;利用CELLNET网站(http://cahanlab.org/macellnet.html)从转录组和蛋白质组的结果中寻找上述转录因子对应的差异表达靶基因;通过对这些显著差异表达的基因进行功能聚类,寻找NR2F2调控的下游靶基因及信号通路。
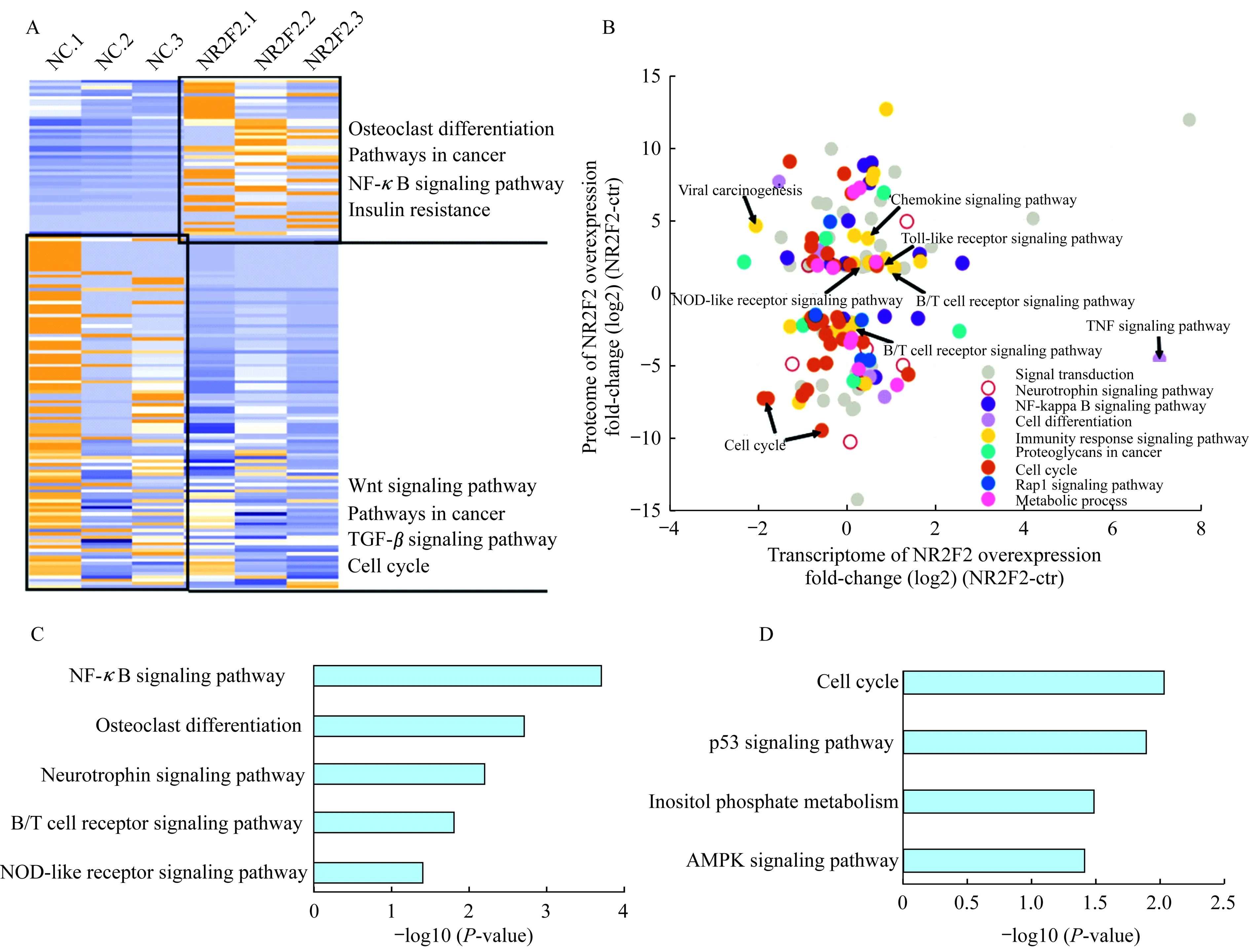
转录因子-DNA结合活性的改变及功能分析整合3次TOT实验结果,共鉴定出2 891个蛋白质,其中519个为转录因子(unique peptide>1,1%FDR);筛选3次生物学重复中至少出现2次的转录因子,计算其iBAQ定量值并进行FOT校准,进一步筛选fold-change>1.5或<0.67的转录因子(表3)。上述TFs与DNA的结合活性可能受到NR2F2的调控。对这些差异性表达的转录因子进行GO/KEGG功能聚类分析,发现NR2F2能够上调NF-κB信号通路和TNF信号通路等免疫调控相关的转录因子,同时下调细胞周期和TGF-β信号通路等相关转录因子(图3A),与TGF-β相关的SMAD家族成员SMAD2/4/5的转录活性亦受到显著下调。
下游靶基因功能分析利用CELLNET网站的转录因子-靶基因数据库,匹配到上述显著性变化转录因子(fold-change>1.5或<0.67)的靶基因,同时与RNA-seq(FPKM>1,fold-change>1.5或<0.67)和全蛋白质谱(fold-change>3或<0.33)的结果进行比较,获得可能直接或间接受NR2F2调控的高可信度的下游转录因子功能聚类分析(图3B)发现,这些靶基因多被富集到Toll-like通路、T/B cell通路等免疫信号通路(图3C)。NF-κB家族功能性亚单位NF-κB2、RELB也都发生显著上调。此外,细胞周期、P53信号通路和AMPK信号通路等均受到显著下调(图3D)。基于以上结果,能够预测NR2F2参与免疫以及细胞周期等功能调控。
NR2F2对NF-κB以及细胞周期信号通路的调控作用过表达NR2F2之后,多种免疫信号通路相关的转录因子及其下游靶基因显著上调(如NF-κB2、RELB),同时神经营养因子调控、细胞发育和肿瘤调控等多种信号通路相关的转录因子及其靶基因也会发生显著上调(图4A)。但与细胞周期信号通路相关的转录因子及其靶基因发生显著下调。为了进一步验证上述结果,我们在NR2F2稳定株中对部分靶基因的转录水平进行了RT-PCR检测,结果证实NF-κB2、RELB发生显著上调(P<0.05,图4B)。同时发现,细胞周期相关分子CCND3(cyclinD3)、CDKN1A(P21)均发生显著下调(P<0.05,图4C),TP53也发生显著下调;通过Western blot实验证实上述转录因子在蛋白质水平也发生显著变化(图4D)。上述结果证明NR2F2可能通过上调NF-κB2、RELB参与细胞免疫,同时通过下调CCND3(cyclinD3)、CDKN1A(P21)及TP53等参与细胞周期相关的功能调控。
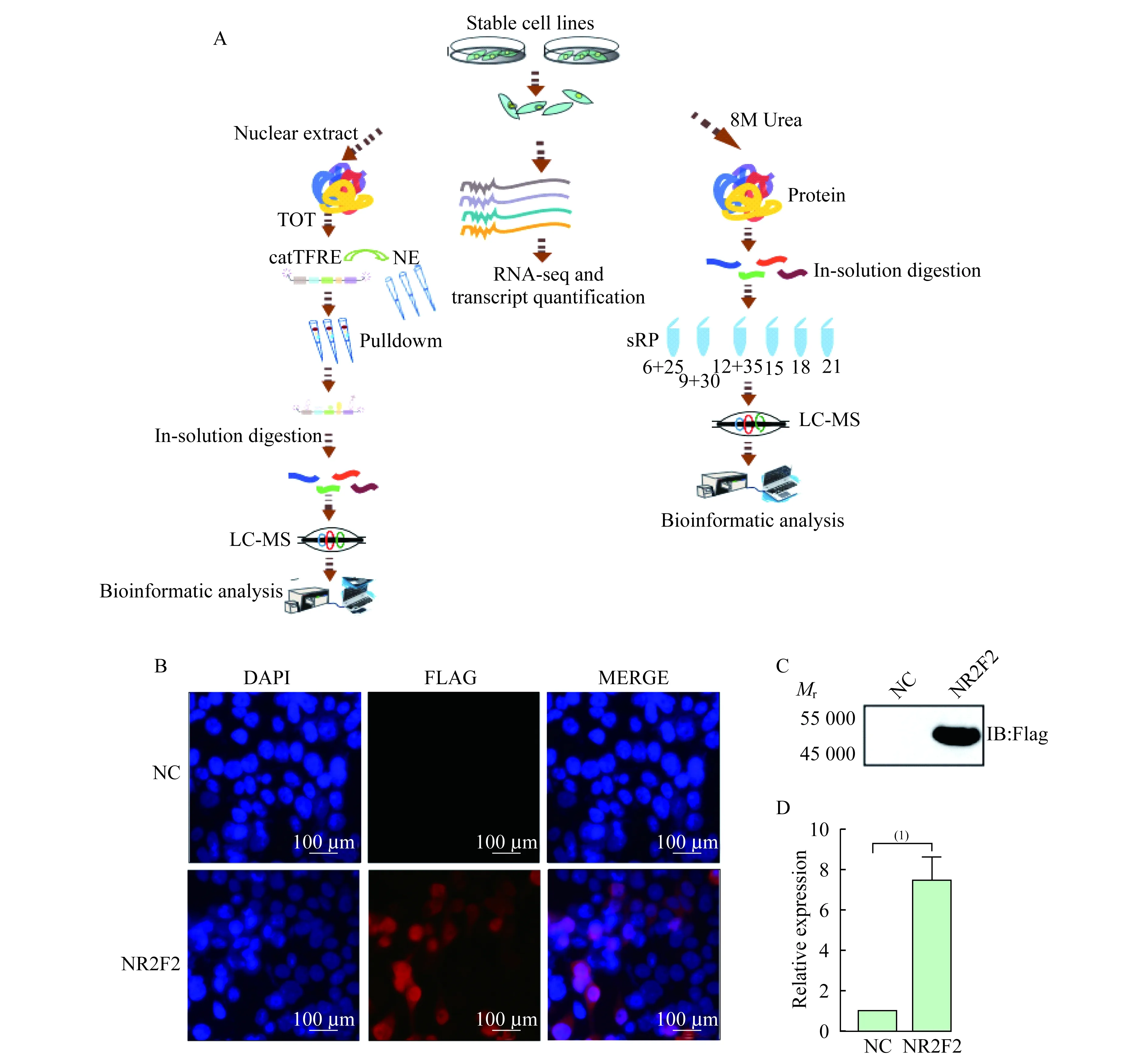
A:Experiment workflow (over-expression,TOT,RNA-seq and protein profiling-MS);B:Immunofluorescence showed exogenous NR2F2 can be successfully expressed in the nucleus;C and D:Over-expression effects verified by Westren blot and RT-qPCR.(1)P<0.01.
图1结合多维蛋白质组学手段对NR2F2进行功能研究
Fig1FunctionsofNR2F2revealedbymulti-dimensionalproteomics
讨 论
NR2F2在脑、神经及心脏中表达水平较高,其在神经发育、心血管发育中起重要作用。NR2F2调控多种发育相关转录因子,敲低NR2F2导致心脏房室隔发育不全[6];胚胎期间,NR2F2在静脉中高表达,在早期躯干发育过程中,Notch信号通路通过调控NR2F2的表达影响静脉分化[7];NR2F2在心脏收缩和心脏舒张的过程中也起重要作用[8];它还能参与部分缺血性损伤修复[9],与先天性心脏缺失有一定关系[4]。
研究表明NR2F2的下调还能抑制成骨细胞和脂肪细胞分化进程[10]。并且在神经干细胞分化过程中激活中枢神经相关的调控基因,在神经发育过程中,NR2F2常作为早期神经系统发育的标志物[11]。在小鼠星形胶质细胞中,NR2F2能上调或下调一些下游靶基因,如Ccl2、Lcn2、Chgb等[12]。同时NR2F2还能通过调控激素受体来调控滋养层的发育。研究表明,NR2F2能调控激素的分泌,例如敲低NR2F2导致雄性小鼠睾丸的缺失[13];NR2F2能通过调控雌激素受体的表达来调控肾素、高血压蛋白酶原的表达[14];它还通过调控孕酮旁分泌信号通路来调控子宫基质基因的表达,在正常子宫高表达,在子宫内膜异位的患者中低表达[15]。
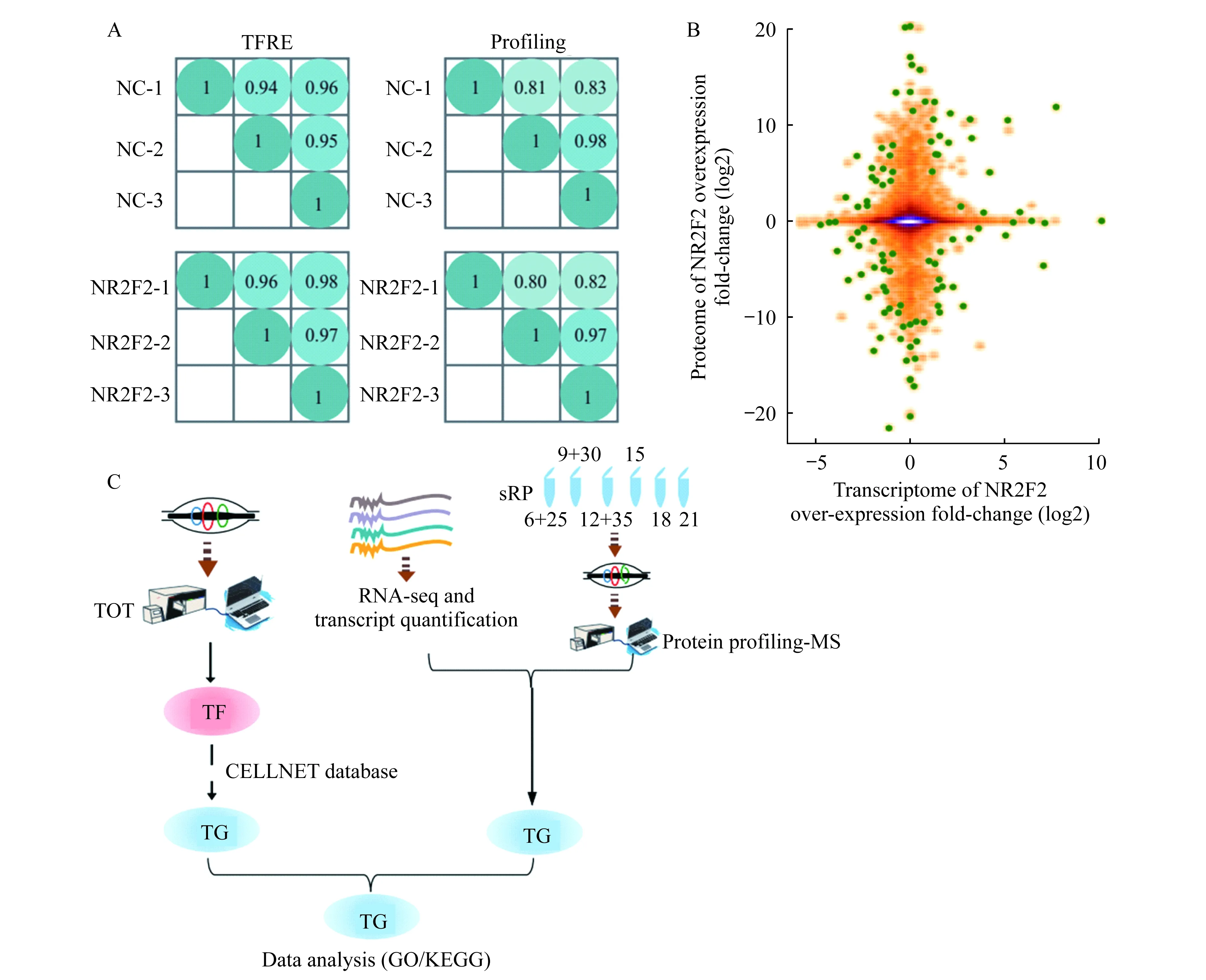
A:The left depicted the correlation between the 3 biological replicates in the control and over-expression groups in the TFRE experiment,the right one depicted the correlation between the three biological replicates in protein profiling experiment;B:The correlation between the quantified proteome and transcriptome changes of gene product after NR2F2 over-expression is shown as a density scatterplot.The abscissa is the quantitative value of FPKM log2 (fold-change) (OE/control) and the ordinate is the quantitative value of IBAQ log2 (fold-change) (OE/control);C:The workflow of bioinformatics analysis.
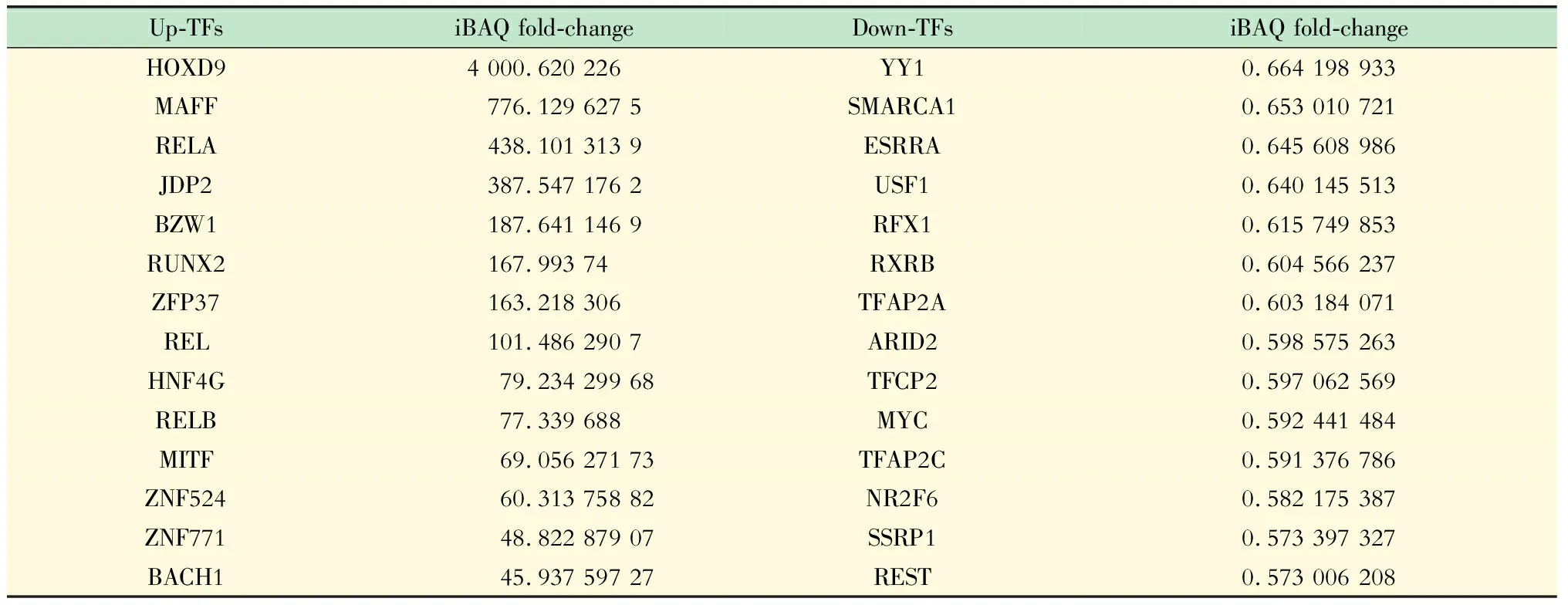
图2 蛋白质非标定量质谱分析及数据可靠性分析Fig 2 Protein label-free quantitation mass spectrometry analysis and reliability analysis of data
(续表3)
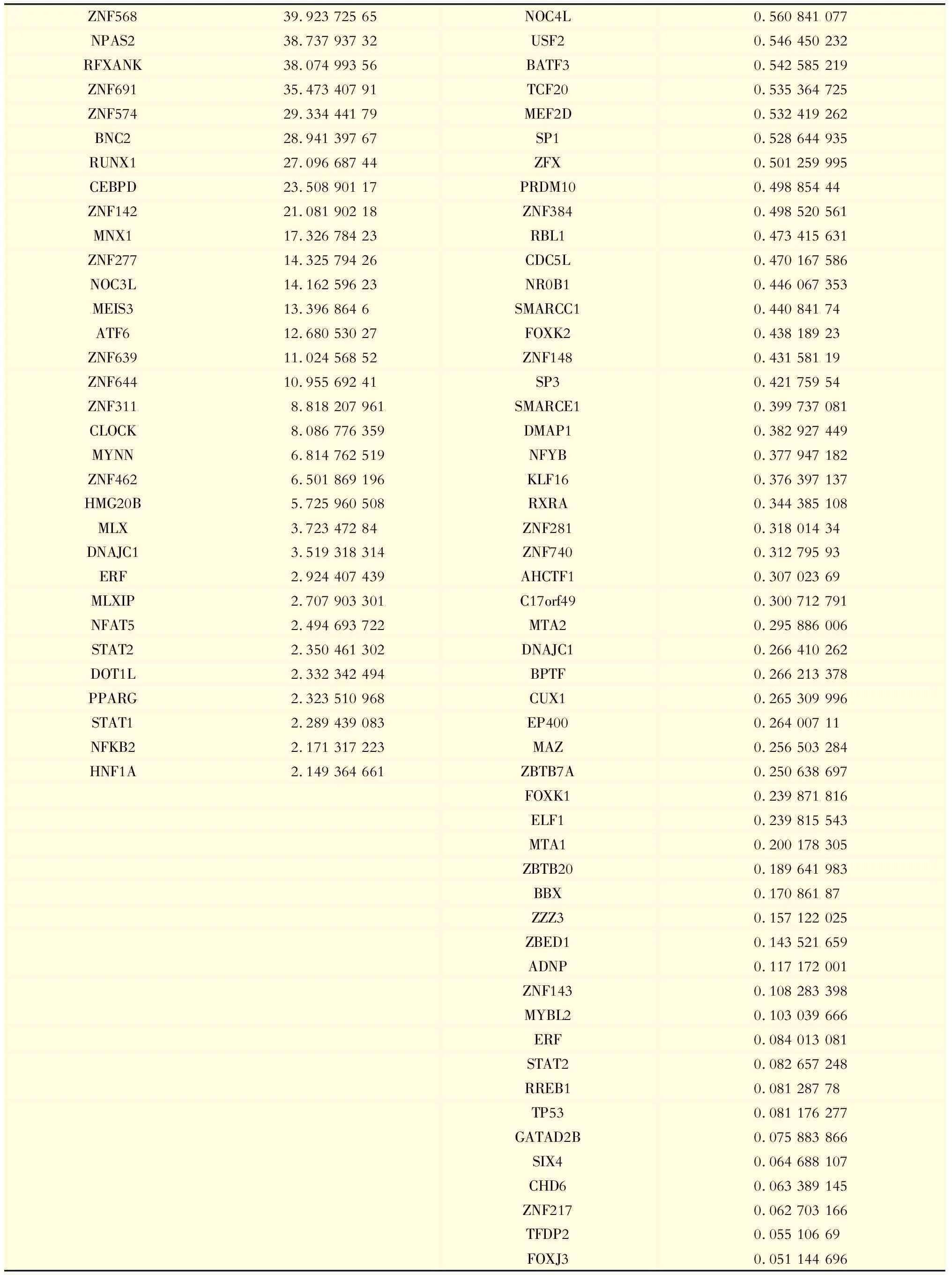
ZNF56839.923 725 65NOC4L0.560 841 077NPAS238.737 937 32USF20.546 450 232RFXANK38.074 993 56BATF30.542 585 219ZNF69135.473 407 91TCF200.535 364 725ZNF57429.334 441 79MEF2D0.532 419 262BNC228.941 397 67SP10.528 644 935RUNX127.096 687 44ZFX0.501 259 995CEBPD23.508 901 17PRDM100.498 854 44ZNF14221.081 902 18ZNF3840.498 520 561MNX117.326 784 23RBL10.473 415 631ZNF27714.325 794 26CDC5L0.470 167 586NOC3L14.162 596 23NR0B10.446 067 353MEIS313.396 864 6SMARCC10.440 841 74ATF612.680 530 27FOXK20.438 189 23ZNF63911.024 568 52ZNF1480.431 581 19ZNF64410.955 692 41SP30.421 759 54ZNF3118.818 207 961SMARCE10.399 737 081CLOCK8.086 776 359DMAP10.382 927 449MYNN6.814 762 519NFYB0.377 947 182ZNF4626.501 869 196KLF160.376 397 137HMG20B5.725 960 508RXRA0.344 385 108MLX3.723 472 84ZNF2810.318 014 34DNAJC13.519 318 314ZNF7400.312 795 93ERF2.924 407 439AHCTF10.307 023 69MLXIP2.707 903 301C17orf490.300 712 791NFAT52.494 693 722MTA20.295 886 006STAT22.350 461 302DNAJC10.266 410 262DOT1L2.332 342 494BPTF0.266 213 378PPARG2.323 510 968CUX10.265 309 996STAT12.289 439 083EP4000.264 007 11NFKB22.171 317 223MAZ0.256 503 284HNF1A2.149 364 661ZBTB7A0.250 638 697FOXK10.239 871 816ELF10.239 815 543MTA10.200 178 305ZBTB200.189 641 983BBX0.170 861 87ZZZ30.157 122 025ZBED10.143 521 659ADNP0.117 172 001ZNF1430.108 283 398MYBL20.103 039 666ERF0.084 013 081STAT20.082 657 248RREB10.081 287 78TP530.081 176 277GATAD2B0.075 883 866SIX40.064 688 107CHD60.063 389 145ZNF2170.062 703 166TFDP20.055 106 69FOXJ30.051 144 696
(续表3)

GATAD2A0.049 993 403ZBTB400.048 236 218MTA30.045 776 393GATAD10.042 329 079ZNF240.027 838 461SMAD40.026 622 923ZNF1460.024 245 678RFX50.023 597 564NR2C10.022 142 84SMAD20.020 478 522TOX40.017 652 834TGIF10.016 159 982ZNF2070.015 770 867FOXP10.011 576 512SPIB0.008 762 001MNT0.008 532 663E2F30.007 659 906
A:The heat-map for dynamic of transcription factors patterns[1.5 图3转录因子-DNA结合活性的改变及功能分析 A:TFs and downstream TGs were regulated by NR2F2;B:Validation of downstream TGs by RT-qPCR;C:Validation of downstream TGs by Western blot.(1)P<0.01. 图4NR2F2调控的下游靶基因功能分析 多项研究表明NR2F2参与肿瘤的发生[16]。在乳腺癌中,高表达NR2F2能降低生存期,同时抑制EMT发生[17];在结直肠癌中,miR-382通过调控NR2F2表达,从而抑制细胞的生长和侵袭[18];在子宫肌瘤中和卵巢癌中,NR2F2也表达异常[19];在胃癌、食管癌中,NR2F2高表达,并与cadherin-11表达相关[20]。 综上所述,NR2F2作为核受体家族成员之一,对多种生命活动起到重要的作用,但其具体功能及其调控的靶基因尚不明确。本研究利用本实验室的优势技术TOT够快速直接筛选出显著表达的转录因子;同时整合转录组和蛋白质组等多维蛋白质组学数据,筛选出NR2F2调控的转录因子及其下游靶基因;利用RT-qPCR等技术对上述潜在分子和通路进行验证,系统阐述NR2F2的功能。本研究发现NR2F2能下调TGF-β信号通路相关的转录因子,抑制SMAD7的表达[21],并且与SMAD4发生相互作用,这些可能与促进肿瘤的发生相关。进一步对NR2F2调控的转录因子分析发现,NR2F2能调控多个免疫信号通路和细胞周期相关信号通路,后期对下游靶基因的研究也证实这一点。NF-κB信号通路参与细胞的多种生命活动,NR2F2对NF-κB的调控至关重要,可以利用刺激等手段处理细胞继续研究NR2F2调控NF-κB信号通路的机制。NR2F2对于细胞周期的调控同时提示该分子能够调控肿瘤细胞生长,本研究显示其通过下调CCND3(cyclinD3)、CDKN1A(P21)及TP53等参与细胞周期相关的功能调控。此外,本研究所得数据显示NR2F2过表达能够显著上调NR2F1(数据待发表)。NR2F2与NR2F1属于同一家族成员,其结构类似,而NR2F1能够诱导肿瘤细胞沉默[22],因此后期还可以验证NR2F2是否通过与NR2F1协同作用共同诱导细胞周期发生改变。 我们研究孤儿受体功能的方法整合了多维蛋白质组学数据,有别于传统生物学研究方法,对预测的可能性结果进行生物学验证。该方法能够快速便捷找到目标蛋白质的下游靶基因、相互作用的蛋白质及其调控的信号通路,具有广泛的应用价值。
Fig3ChangeofTFs-DNAbindingactivityandfunctionalanalysis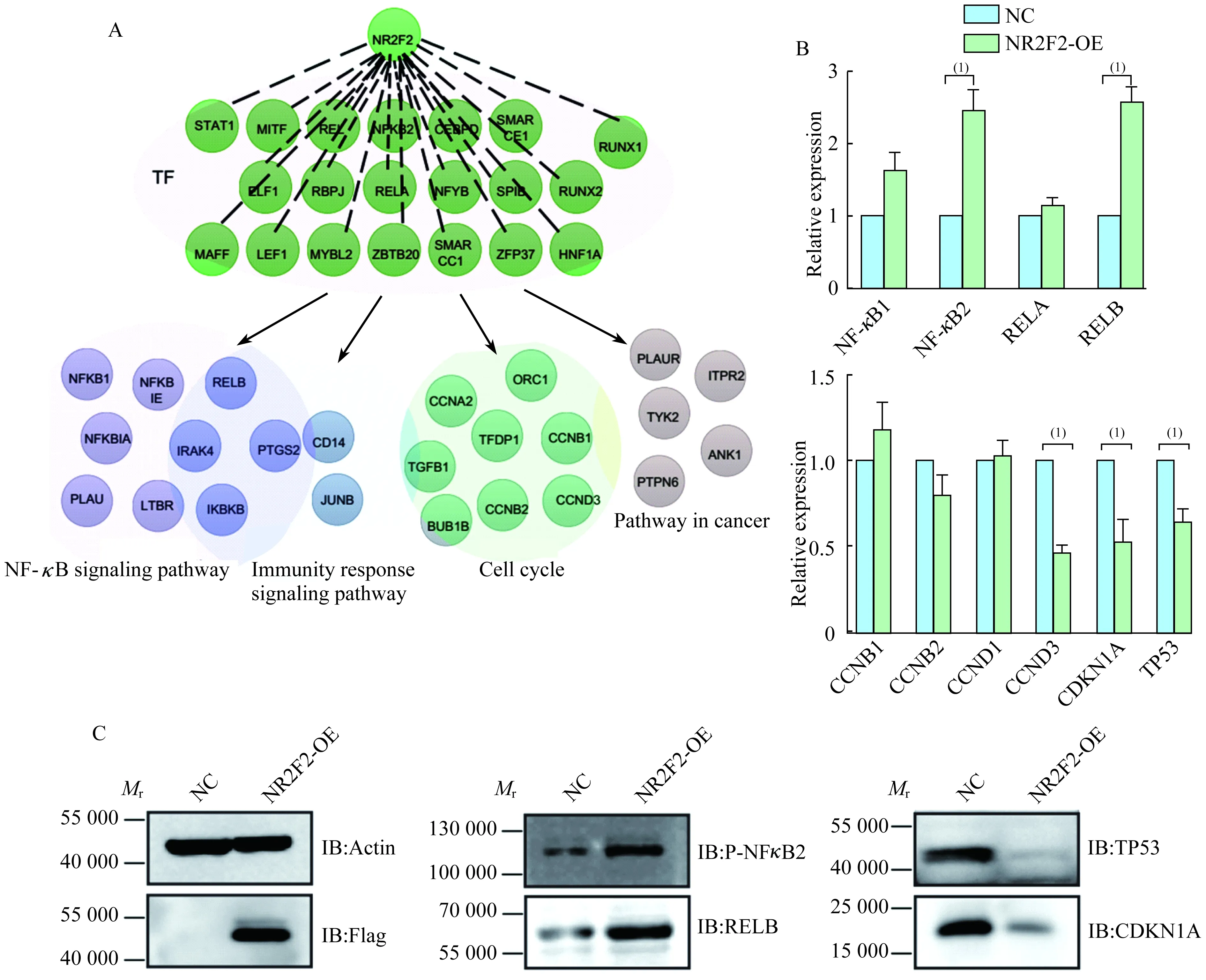
Fig4FunctionalanalysisofdownstreamtargetgenesregulatedbyNR2F2
