不同因素对猪瘟疫苗免疫效果的影响
2018-12-13代洪波周远成阴文奇
代洪波,林 艳,周远成,阴文奇
(1.畜禽生物制品四川省重点实验室,四川 成都 610200;2.四川省动物生物制品工程技术研究中心,四川 成都 610200)
猪瘟是一种高度接触性传染病,不同品种、不同年龄段的猪均易感,并且死亡率极高,每年给我国养猪业造成巨大的经济损失,猪瘟活疫苗免疫是防治该病的唯一有效途径。我国已经实施了几十年的猪瘟疫苗强制免疫,然而猪瘟的防控压力依然巨大,猪瘟疫苗免疫效果不佳甚至免疫失败的情况时有发生。猪瘟疫苗的免疫效果不仅受疫苗质量的影响,同时还受到母源抗体、动物体况、免疫抑制性疾病等一系列因素的影响[1]。如何提高仔猪猪瘟疫苗首次免疫后的抗体水平、缩短仔猪抗体保护空窗期,已经成为困扰我国规模化养猪的一大难题[2-3]。本试验分别开展不同剂量猪瘟疫苗免疫试验与不同母源抗体水平免疫试验,评价抗原量与母源抗体水平对猪瘟疫苗免疫效果的影响。同时结合规模化养殖场的实际案例,探讨如何缩短仔猪抗体保护空窗期等问题。
1 不同剂量免疫试验
1.1 试验时间、地点与试验动物
试验于2017年12月至2018年1月在四川某公司实验动物房进行。筛选4~5周龄猪瘟ELISA抗体阴性试验仔猪20头。
1.2 试剂与疫苗
猪瘟ELISA抗体检测试剂盒,购自IDEXX公司。猪瘟细胞源活疫苗(15 000 RID/头份),由四川华神兽用生物制品有限公司提供。
1.3 分组与接种
选用20头猪瘟抗体阴性仔猪,随机分为4组,每组5头。A组:每头仔猪肌肉注射30 000 RID的猪瘟细胞苗;B组:每头仔猪肌肉注射15 000 RID的猪瘟细胞苗;C组:每头仔猪肌肉注射7 500 RID的猪瘟细胞苗;D组:不接种,作为对照组。
1.4 采血与抗体检测
所有试验猪,分别在免疫后 14 d、21 d、28 d、35 d采血分离血清,用猪瘟ELISA抗体检测试剂盒进行抗体检测。
1.5 结果与讨论
不同剂量免疫试验猪瘟抗体检测结果见表1。对照组(D组)试验过程中猪瘟抗体检测结果均为阴性。
C组(7 500 RID/头)免疫后28 d猪瘟ELISA抗体全部转阳,阻断率均值69.4%;免疫后35 d阻断率均值上升至78.8%。B组(15 000 RID/头)免疫后28 d猪瘟ELISA抗体全部转阳,阻断率均值71%,比C组高1.6个百分点;免疫后35 d阻断率均值82.8%,比C组高4个百分点。A组(30 000 RID/头)免疫后21 d猪瘟ELISA抗体全部转阳,比B组与C组提前7 d;免疫后28 d阻断率均值77.6%,比B组高6.6个百分点;免疫后35 d阻断率均值84.6%,比B组高1.8个百分点。
分别以每头7 500 RID、15 000 RID、30 000 RID剂量进行猪瘟细胞苗免疫猪瘟抗体阴性仔猪,免疫后28 d即可产生高水平的ELISA抗体;提高猪瘟抗体阴性猪的免疫剂量,猪群ELISA抗体转阳的时间提前;随着猪瘟疫苗免疫剂量的提高,猪瘟ELISA抗体阻断率均值有所上升。
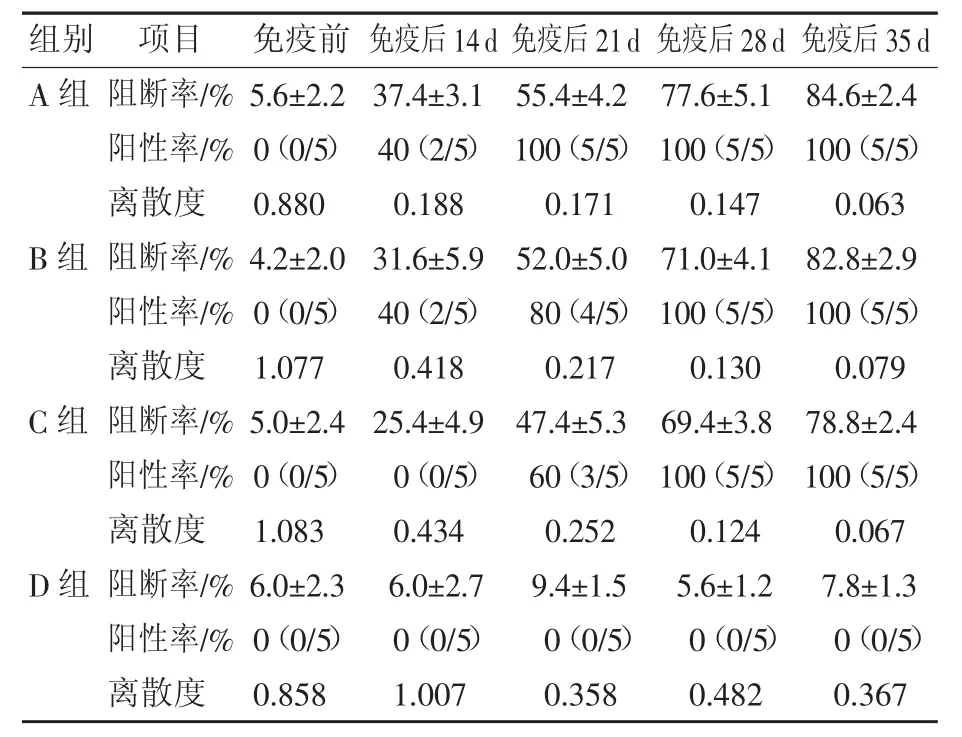
表1 不同剂量免疫试验猪瘟抗体检测结果
2 不同母源抗体免疫试验
2.1 试验时间、地点与试验动物
试验于2018年4—6月在四川某公司动物实验房进行。筛选3~4周龄猪瘟母源抗体阻断率60%~80%试验猪10头,猪瘟母源抗体阻断率值40%~50%试验猪5头,猪瘟抗体阴性试验猪10头。
2.2 试剂与疫苗
猪瘟ELISA抗体检测试剂盒,购自IDEXX公司。猪瘟细胞源活疫苗(15 000 RID/头份),由四川华神兽用生物制品有限公司提供。
2.3 分组与接种
将10头猪瘟母源抗体阻断率60%~80%试验猪随机分为2组,每组5头,记为第1组与第2组;将猪瘟母源抗体阻断率值40%~50%的5头试验猪记为第3组;将10头猪瘟抗体阴性试验猪随机分为2组,每组5头,记为第4组与第5组。第1组每头肌肉注射30 000 RID猪瘟细胞苗;第2组至第4组每头肌肉注射15 000 RID猪瘟细胞苗;第5组:不接种为对照组。一免后28 d,第1组至第4组分别以相同剂量进行二免。
2.4 采血与抗体检测
所有试验猪,分别在一免后14 d、一免后28 d(二免前)、二免后14 d、二免后28 d采血分离血清,以猪瘟ELISA抗体检测试剂盒进行抗体检测。
2.5 结果与讨论
不同母源抗体免疫试验猪瘟抗体检测结果见表2。对照组(第5组)试验过程中猪瘟抗体检测结果均为阴性。
第 1组(30 000 RID/头)与第 2组(15 000 RID/头)免疫前猪瘟母源抗体阻断率均值70%以上,一免后14 d抗体阻断率均值分别为64.4%与61%;一免后28 d阻断率均值分别为44.6%与38.4%;二免后14 d阻断率均值分别为67.2%与58.2%;二免后28 d阻断率均值为77.8%与68.6%,相差9.2个百分点。
第3组(15 000 RID/头)免疫前猪瘟母源抗体阻断率均值43.8%,一免后14 d抗体阻断率均值降低至41.6%;一免后28 d阻断率均值为51.6%,阳性率100%;二免后14 d阻断率均值上升至64.4%;二免后28 d阻断率均值79.6%,比第2组高11个百分点。
第4组无猪瘟母源抗体,二免后28 d猪瘟ELISA抗体阻断率均值为85.8%,比第1组高8个百分点,比第2组高17.2个百分点,比第3组高6.2个百分点。
高水平母源抗体组(阻断率值60%以上)一免后14 d仍维持较高水平的母源抗体,二免后的猪瘟抗体水平受到较大影响,与无母源抗体组存在较大差异。低水平母源抗体(阻断率值40%~50%)对一免后猪瘟疫苗抗体水平有一定影响,对二免后猪瘟疫苗抗体水平影响较小。在较高母源抗体的情况下,提高猪瘟疫苗的免疫剂量,可以在一定程度上改善猪瘟疫苗的免疫效果。
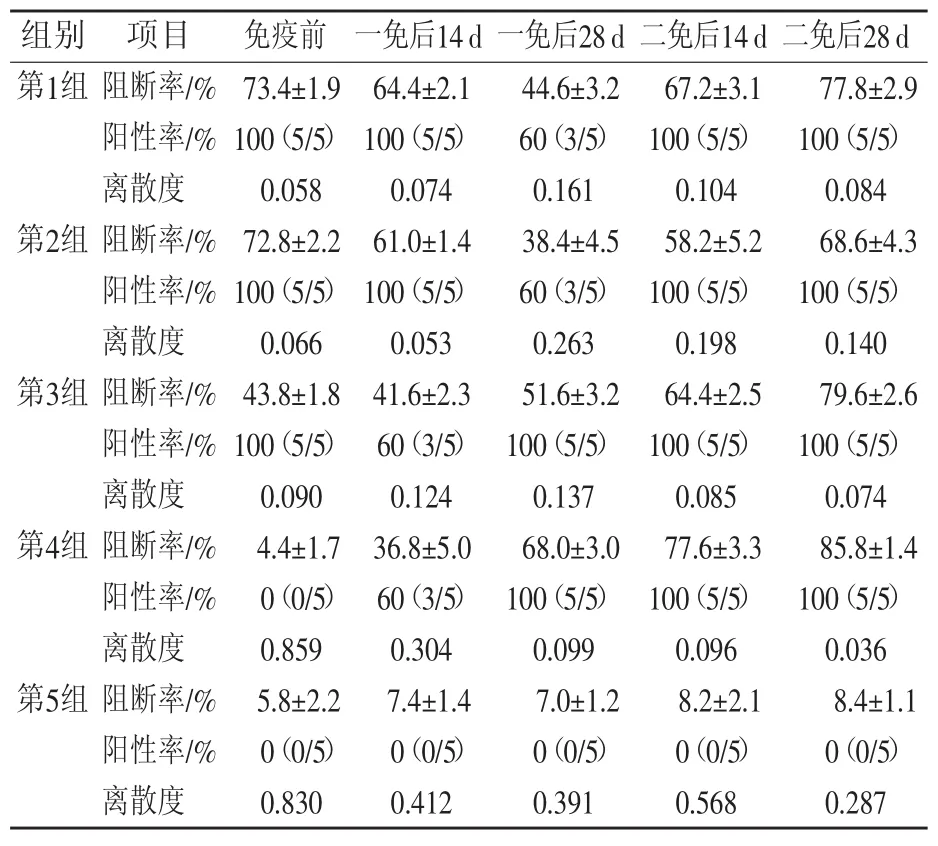
表2 不同母源抗体水平接种猪瘟疫苗ELISA抗体检测结果
3 免疫程序调整试验
3.1 试验猪场
四川某规模化养殖场,经产母猪3 000头左右。
3.2 试验前猪瘟疫苗免疫程序
后备猪:配种前间隔1个月进行2次猪瘟疫苗免疫;经产母猪:仔猪21日龄断奶时跟胎免疫猪瘟疫苗;仔猪:28日龄猪瘟疫苗一免,60日龄猪瘟疫苗二免。母猪与仔猪的接种剂量均为1头份/头。
3.3 试验前猪瘟抗体检测
2018年3月对不同阶段猪群采样进行猪瘟抗体检测,结果显示初产母猪阳性率100%,阻断率均值73.9%;经产母猪阳性率80%,阻断率均值54.0%。2周龄仔猪阳性率60%,阻断率均值44.7%;4周龄阳性率30%,阻断率均值35.3%;6周龄猪瘟抗体全为阴性;8周龄阳性率上升至70%,阻断率均值上升至41.2%。试验前猪瘟抗体检测结果见表3。
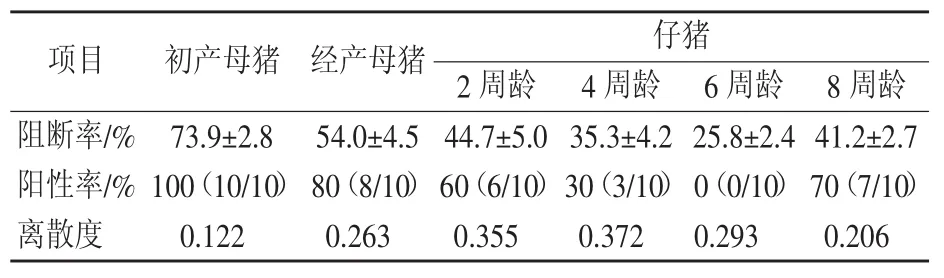
表3 试验前猪瘟抗体检测结果
结合免疫程序分析,初产母猪配种前完成2次猪瘟疫苗接种,猪瘟抗体水平较高;经产母猪每头接种1头份,仔猪断奶时猪瘟抗体水平不高,母源抗体持续时间有限;仔猪4周龄进行猪瘟一免,6周龄时疫苗免疫抗体水平较低,而母源抗体消减,导致6周龄仔猪抗体检测全部阴性;8周龄时猪瘟疫苗免疫抗体上升,阳性率与阻断率均值有所提高。
3.4 猪瘟免疫程序调整
为提高6周龄左右猪群的猪瘟抗体水平,分别开展母猪免疫剂量调整试验与仔猪免疫时间调整试验。1)母猪试验:免疫时间不变,将经产母猪的免疫剂量调整为2头份/头,提高仔猪的母源抗体水平;2)仔猪试验:免疫剂量不变,将仔猪的猪瘟疫苗免疫时间提前至21日龄,提高6周龄仔猪的猪瘟抗体水平。
3.5 采血与抗体检测
母猪试验:母猪产仔后,分别抽样采集2周龄、4周龄、6周龄、8周龄仔猪血液样本,母猪产后2周抽样采血。仔猪试验:分别采集3周龄(免疫前)、5周龄(免疫后14 d)、6周龄(免疫后21 d)、7周龄(免疫后28 d)仔猪血液样本。以IDEXX公司猪瘟ELISA抗体检测试剂盒进行检测。
3.6 免疫程序调整后猪瘟抗体检测结果
3.6.1 母猪试验结果 共选用50头母猪,将母猪免疫剂量调整为2头份/头,产仔后2周抽样检测,猪瘟ELISA抗体全部阳性,阻断率均值77.9%。仔猪2周龄猪瘟母源抗体阳性率100%,阻断率均值62.8%;4周龄母源抗体阳性率60%,阻断率均值51.4%。仔猪4周龄每头免疫1头份猪瘟细胞苗,6周龄猪瘟抗体阳性率60%,阻断率均值44.3%;8周龄阳性率上升至80%,阻断率均值50.8%。母猪试验猪瘟抗体检测结果见表4。
将母猪的免疫剂量调整为2头份/头,与调整前相比,2周龄与4周龄仔猪的母源抗体水平有所提高。6周龄(免疫后14 d)猪瘟疫苗免疫产生的抗体水平有限,母源抗体仍维持在一定水平,可以给猪群提供一定的抗体保护;仔猪8周龄时,首次免疫的猪瘟疫苗已经产生较高水平的猪瘟抗体。
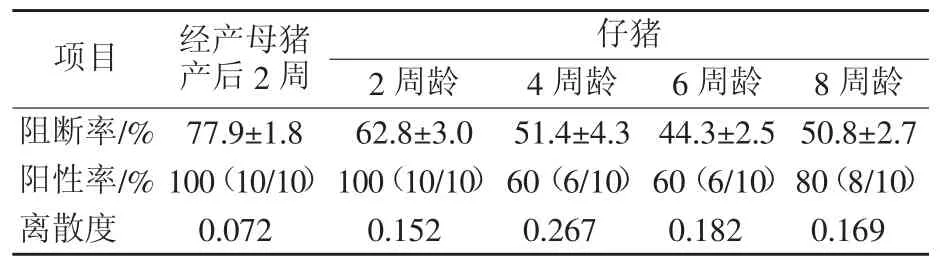
表4 母猪试验猪瘟抗体检测结果
3.6.2 仔猪试验结果 在母猪免疫剂量不变的条件下,共选用100头仔猪在3周龄进行猪瘟疫苗接种。仔猪3周龄(免疫前)母源抗体阳性率60%,阻断率均值47.3%;5周龄(免疫后14 d)猪瘟抗体阳性率降低至50%,阻断率均值42.2%;6周龄阳性率上升至60%,阻断率均值45%;7周龄阳性率上升至80%,阻断率均值49.9%。仔猪试验猪瘟抗体检测结果见表5。
在母源抗体水平有限的情况下,将猪瘟疫苗免疫时间提前至3周龄,仔猪6周龄时母源抗体消减,仔猪首次免疫的猪瘟疫苗已经产生较高水平的猪瘟抗体,有效缩短了6周龄左右猪群猪瘟抗体的空窗期。
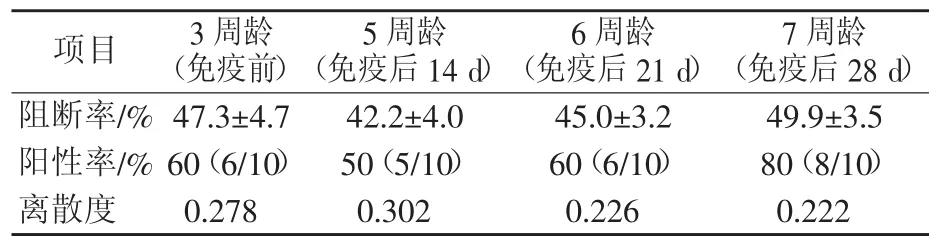
表5 仔猪试验猪瘟抗体检测结果
4 分析与讨论
我国猪瘟疫苗的种类与生产厂家众多,猪瘟疫苗的品质主要与疫苗种类、生产工艺和抗原含量有关。猪瘟脾淋苗每头抗原量不低于150 RID,细胞苗每头抗原量不低于750 RID、传代细胞苗每头抗原量不低于7 500 RID。随着我国猪瘟疫苗品质的不断提升,对猪瘟疫苗中牛病毒性腹泻病毒(BVDV)等外源污染越来越重视,猪感染BVDV后表现出亚临床感染,其症状和病理变化类似于温和型猪瘟[4]。猪瘟疫苗中污染BVDV,将干扰猪瘟疫苗的免疫效果,影响抗体水平[5]。本试验分别以每头7 500 RID、15 000 RID、30 000 RID剂量的猪瘟细胞苗免疫阴性仔猪,免疫后28 d全部产生较高水平的猪瘟抗体;随着免疫剂量的提高,猪瘟抗体转阳的时间提前,抗体阻断率均值有所上升,但组间无显著差异。与熊丁杰等[6]的试验结果一致,在没有母源抗体等因素影响的情况下,仔猪单次接种合理剂量的猪瘟活疫苗就能产生坚强的抗体保护。
在猪瘟疫苗使用过程中,母源抗体是影响仔猪免疫效果的最主要因素之一,在高水平母源抗体水平时进行猪瘟疫苗免疫,母源抗体会与猪瘟疫苗发生中和作用,导致疫苗首次免疫效果较差。若在母源抗体消减后再进行猪瘟疫苗免疫,将会产生较长时间的免疫空窗期,增加猪瘟病毒感染风险。因此,有条件的规模化养猪场需要定期进行猪瘟抗体检测,根据仔猪母源抗体水平适当调整免疫程序,以获得高水平的群体保护。
此外,其他动物疫病感染,以及动物体况等因素均会对猪瘟疫苗免疫效果造成较大的影响。宁宜宝等[7]通过试验证实,猪细小病毒、猪伪狂犬病病毒、猪繁殖与呼吸综合征病毒单独或混合感染,均会对猪瘟疫苗的免疫效果产生一定的影响,当猪群受到猪瘟强毒攻击时,无法有效清除猪瘟强毒,造成持续感染与对外排毒。笔者在规模化猪场开展猪瘟疫苗免疫试验时发现,同一批相同剂量免疫的仔猪,部分试验猪发生腹泻疾病,腹泻猪群的猪瘟抗体水平比其他猪低,并且抗体的离散度较大。规模化养殖场对猪瘟的防控,需要从疫苗品质、免疫程序、饲养管理等众多方面入手,做好每一个环节的把控,才能营造高水平的猪瘟抗体保护。
