有氧运动及膳食干预对肥胖大鼠减脂效果及Irisin调控的研究
2018-12-13刘子铭
刘子铭,于 亮,李 琳,付 悦
有氧运动及膳食干预对肥胖大鼠减脂效果及Irisin调控的研究
刘子铭1,于 亮2,李 琳3,付 悦4
北京体育大学, 北京 100084

Irisin;肥胖;运动;白色脂肪组织;棕色化
2012年,Bostrom提出运动诱导Irisin后认为Irisin具有减脂作用[4],之后人们对Irisin的关注和研究逐渐增加。Irisin是过氧化物酶体增殖物激活受体γ辅激活因子(Peroxisome proliferator-activated receptor gamma coactivator 1-alpha, PGC1-α)依赖性肌肉因子,目前可以确定的是PGC1-α能够上调骨骼肌中FNDC5的表达,促使FNDC5水解生成Irisin并释放入血,通过血液循环作用到组织、器官[4]。Irisin的主要生理功能是促进白色脂肪组织褐变,增加机体能量消耗[12],因此,这种因子有望成为治疗肥胖及糖尿病等慢性代谢性疾病的新靶点,但目前关于Irisin诱导白色脂肪组织褐变的调控机制尚无法确定。
因此,本研究建立8周高脂模型,通过观察4周有氧运动及膳食干预对肥胖大鼠骨骼肌FNDC5蛋白和白色脂肪棕色化相关蛋白表达的影响及减肥效果,检测PGC1-α、AMPK信号通路与FNDC5/Irisin以及脂肪中p38 MAPK信号通路与UCP1的表达情况,初步揭示FNDC5在体内以及运动减肥过程中的调控机制,为治疗肥胖等代谢性疾病可行性提供理论依据。
1 材料与方法
1.1 实验动物与分组
由北京维通利华实验动物技术有限公司购入5周龄SPF级雄性SD大鼠(130±15 g),共65只。大鼠经过3天预适应后开始实验,将65只大鼠随机分为对照组(N=5)和高脂模型组(N=60)。高脂模型组参考相关造模方法,用高脂饲料喂养大鼠。造模成功后,在高脂模型组中筛选40只大鼠并随机分为高脂膳食对照组(High-fat diet control, H)、高脂膳食+运动组(High-fat diet Exercise, HE)、普通膳食对照组(Normal diet Control, C)、普通膳食+运动组(Normal diet Exercise, E),每组10只。
1.2 方法
1.2.1 肥胖大鼠模型的建立

1.2.2 标本采集
在最后一次跑台运动结束后,各组大鼠均禁食12 h,于次日早晨麻醉后通过双能X线吸收测量法检测身体成分后,腹腔主动脉取血处死,麻醉剂为10%水合氯醛。血液经过高速离心后保留血清;取双侧比目鱼肌,并称量湿重;于肌腹正中处取下小块肌肉组织,使用包埋剂包埋后放入异戊烷与液氮中调整温度并凝结固定,做冰冻切片使用;取双侧附睾处白色脂肪,称量左右附睾湿重。上述所有样品及余下比目鱼肌均保存于-80℃冰箱,比目鱼肌及附睾处白色脂肪用于检测相关蛋白的表达。
1.2.3 双能X线吸收测量法(DEXA)
打开仪器(Lunar IDXA)进行校准,打开enCORE(2011)软件,麻醉大鼠后,将大鼠平置于扫描床上,在enCORE软件中点击小动物模式,录入大鼠身长、体重,随后仪器开始扫描,将得到数据保存并予以分析。
1.2.4 Western Blot
取各组比目鱼肌/附睾白色脂肪100 mg,剪碎后加入RIPA裂解液,匀浆后4℃冰上孵育30 min,在12 000 rmp条件下离心8 min后取上清并记录体积,测定蛋白浓度并将浓度调至统一。100℃加热10 min,冷却后-40℃冷冻备用。
Western Blot检测比目鱼肌中PGC1-α、AMPKα、p-AMPKα、FNDC5蛋白及白色脂肪中UCP1、p38 MAPK的表达。PGC1-α、AMPKα、pAMPKα采用10%分离胶浓度,UCP1、p38 MAPK、FNDC5采用12%分离胶浓度,进行SDS-PAGE电泳,300 mA下转膜1.5 h,5% BSA对PVDF膜封闭2 h,使用5% BSA 配制一抗,PGC1-α(浓度1︰1 000)、AMPKα(浓度1︰2 000)、p-AMPKα(浓度 1︰500)、FNDC5(浓度1︰1 000)、UCP1(浓度1︰2 000)、p38 MAPK(浓度1︰2 000)、GAPDH(浓度 1︰2 000),4 ℃孵育过夜。第二日使用TBST清洗PVDF膜后,加入相应二抗进行1 h的孵育,孵育结束后再次清洗PVDF膜,随后显影曝光。
1.2.5 免疫荧光检测laminin
冰冻切片机预冷后将温度调至-20 ℃,之后组织固定在冰冻切片机的底座上,调节切片厚度及角度,固定玻璃盖板,安装刀片。粗调到距离合适后用8μm细调,将切下来的组织固定好保存于-80 ℃冰箱中。
取出样品后,先用PBS摇床清洗,再用含有0.3% Triton的PBS破膜30 min。用免疫组化画圈笔在样本周围画圈,圈住样本后滴加5%羊血清室温封闭30 min。一抗laminin浓度1:500,滴加后湿盒内4 ℃过夜,次日避光操作加入荧光二抗(浓度1:500),封片后进行拍摄,之后统计横截面积大小。
1.2.6 血清Irisin检测
在酶标包被板上分别加入标准品和待测样品并留出空白孔,待测样品每组均5个复孔,封板后37 ℃孵育30 min。洗涤液清洗酶标包被板,拍干后在各孔中加入酶标试剂,封板孵育30 min,洗涤液清洗酶标包被板,拍干后在各孔中加入显色剂,摇晃混匀后37 ℃避光显色15 min。加入终止液后用酶标仪测定,调零后测量各孔的吸光度。
1.3 主要试剂及仪器
FNDC5抗体,ab174833,Abcam公司;PGC1α抗体,ab54481,Abcam公司;AMPKα抗体,ab80039,Abcam公司;p-AMPKα抗体,ab133448,Abcam 公司;p38 MAPK抗体,8690s,Cell Signaling公司;UCP1抗体,ab10983,Abcam公司;Irisin ELISA试剂盒,AD0002RA,Andy gene;laminin 抗体,ab11575,Abcam 公司;磷酸酶抑制剂,Roche公司;蛋白酶抑制剂,Roche公司;BCA蛋白测定试剂盒,Thermo公司。
Western Blotting电泳仪、电转仪,Bio-Rad公司;xMark酶标仪,Bio-Rad公司。
1.4 统计方法
2 结果
2.1 各组大鼠体重、体脂的变化
4周实验后,高脂膳食对照组体重高于实验前,高脂膳食+运动组、普通膳食对照组和普通膳食+运动组体重均明显低于实验前。高脂膳食+运动组与实验前对比有显著性差异(<0.05),与高脂膳食对照组对比非常具有显著性差异(<0.01);普通膳食对照组与实验前对比有显著性差异(<0.05),与高脂膳食对照组差异有显著性差异(<0.05);普通膳食+运动组体重下降最明显,与实验前对比差异非常具有显著性(<0.01),与高脂膳食对照组相比差异非常具有显著性(<0.01,表1)。

表1 各组大鼠体重
注:*<0.05,**<0.01,与H组相比;#<0.05,##<0.01,与实验前相比,下同。初始值为肥胖建模成功后大鼠平均体重。
实验开始前对大鼠进行麻醉,DEXA扫描测量大鼠体脂含量作为初始对照即干预前,实验结束后再次测量各组大鼠体脂含量(图1),发现高脂膳食对照组体脂含量升高,高脂膳食+运动组对比实验前有显著性差异(<0.05);普通膳食对照组体脂含量对比高脂膳食对照组有显著性差异(<0.05),对比实验前有显著性差异(<0.05);高脂膳食+运动组体脂含量显著下降,对比高脂膳食对照组有非常显著性差异(<0.01),对比实验前具有显著性差异(<0.01,表2)。
2.2 各组大鼠比目鱼肌湿重及肌纤维横截面积的变化
4周干预后,各组比目鱼肌湿重相比差异没有显著性差异(>0.05),干预手段对肌肉湿重影响不大(表3)。

表2 各组大鼠体脂含量
注:初始值为肥胖建模成功后每组大鼠平均体脂含量。
对各组大鼠进行冰冻切片,免疫荧光检测laminin,发现4周干预后,高脂膳食对照组肌纤维横截面积较大,与其他3组有显著性差异(<0.01,图2)。
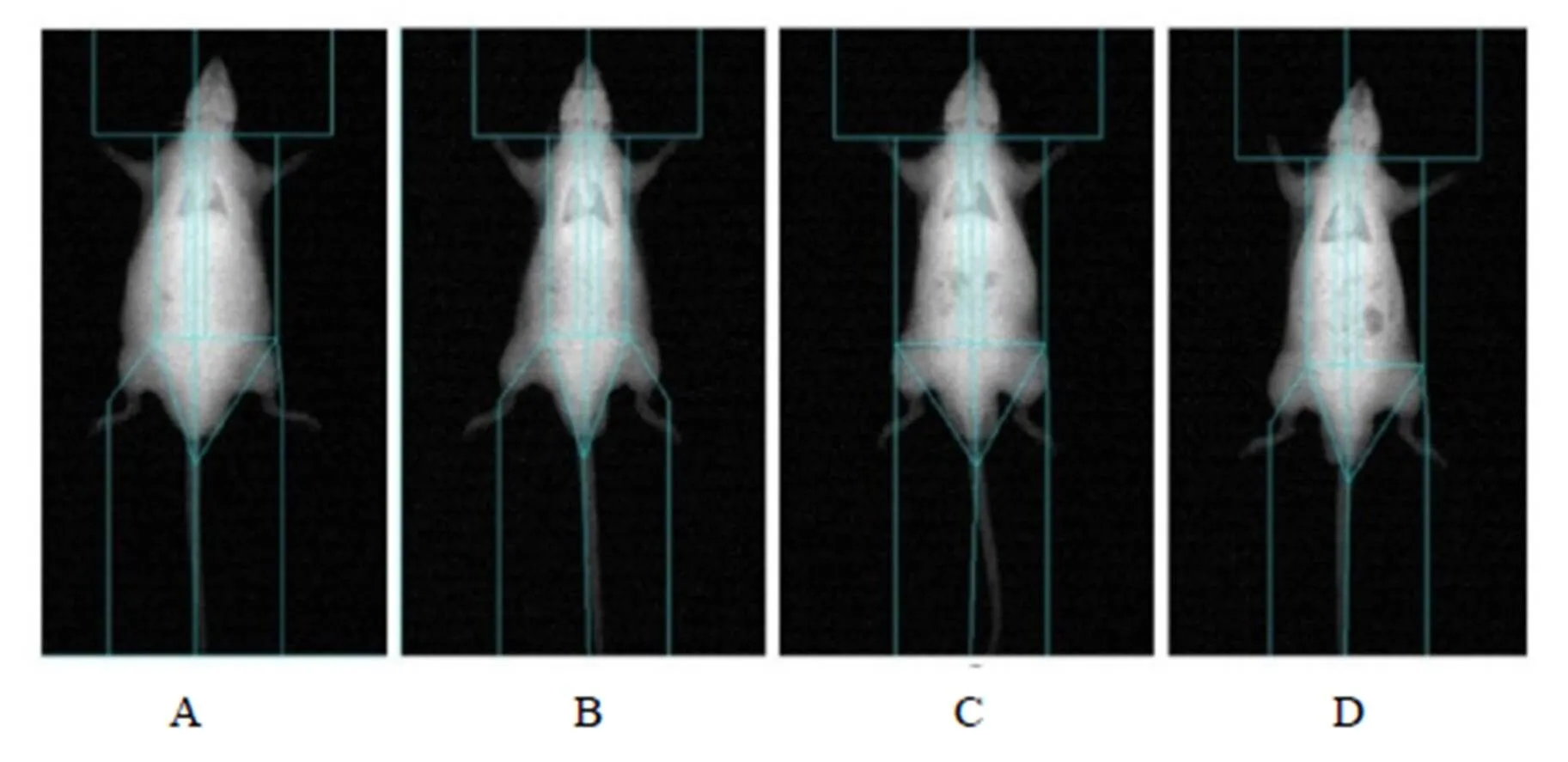
图1 DEXA检测大鼠体脂含量
Figure 1. DEXA Detects Body Fat in Rats
注:DEXA检测,A为H组;B为HE组;C为C组;D为E组。

表3 各组大鼠左右腿比目鱼肌湿重
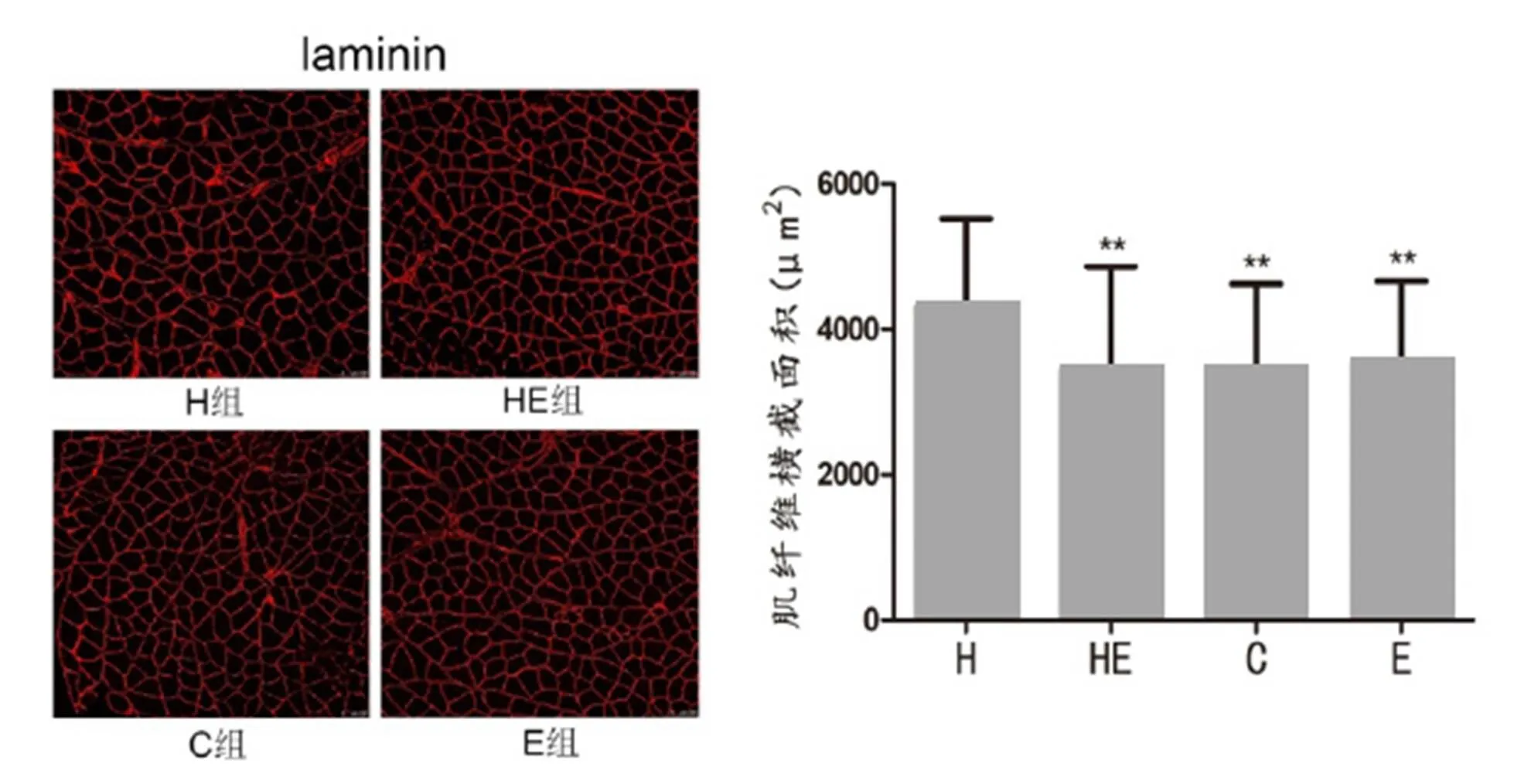
图2 大鼠比目鱼肌纤维横截面积
Figure 2. Soleus Muscle Fiber Cross-sectional Area of Rats
注:**<0.01,与H组相比。
2.3 各组大鼠白色脂肪称重
4周干预后,高脂膳食+运动组较高脂膳食对照组肾周处脂肪和附睾处脂肪分别下降了53.1%和47.5%,肩胛处棕色脂肪相比下降了44%(<0.01);普通膳食对照组较高脂膳食对照组肾周处脂肪和附睾处脂肪分别下降了50.2%和34.9%,肩胛处棕色脂肪相比下降了30.5%(<0.01);普通膳食+运动组较高脂膳食对照组肾周处脂肪和附睾处脂肪分别下降了69.8%和47.4%,肩胛处棕色脂肪相比下降了42.3%(<0.01,表4)。
2.4 各组大鼠血清Irisin水平
ELISA检测结果表明,4周干预后,高脂膳食+运动组血清Irisin水平较高脂膳食对照组升高,但没有显著性差异(>0.05);普通膳食对照组对比高脂膳食对照组较为升高(<0.05);普通膳食+运动组比高脂膳食对照组血清Irisin水平非常显著增加(<0.01,图3)。

图3 各组大鼠血清Irisin水平
Figure 3. Serum Irisin Levels of Rats in Each Group
注:*<0.05,**<0.01,与H组相比。
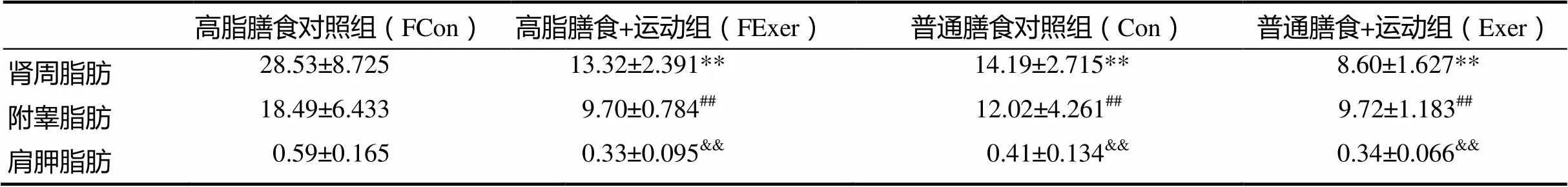
表4 各组大鼠白色脂肪与棕色脂肪重量
注:**<0.01,肾周脂肪与H组相比;##<0.01,附睾脂肪与H组相比;&&<0.01,肩胛脂肪与H组相比。
2.5 各组大鼠比目鱼肌中蛋白表达的变化
2.5.1 比目鱼肌PGC1-α蛋白表达变化
4周干预后,高脂膳食+运动组及普通膳食+运动组大鼠比目鱼肌内PGC1-α的表达均明显高于高脂膳食对照组(<0.01);普通膳食+运动组大鼠比目鱼肌内PGC1-α的表达较高脂膳食对照组大鼠增加(<0.05)。这表明运动诱导比目鱼肌中PGC1-α表达水平增加(图4)。
2.5.2 比目鱼肌AMPKα、pAMPKα蛋白表达变化
AMPK是生物能量代谢的关键因子,也是调控Irisin的上游信号。4周干预后,高脂膳食+运动组及普通膳食+运动组大鼠比目鱼肌内AMPKα、p-AMPKα的表达均明显高于高脂膳食对照组(<0.01),普通膳食对照组较高脂膳食对照组大鼠比目鱼肌内AMPKα、p-AMPKα的表达增加(<0.05)。表明运动增加能量消耗,而普通膳食较高脂膳食能量减少,在这个过程中激活了能量开关AMPK(图4)。
2.5.3 比目鱼肌FNDC5蛋白表达变化
经过4周干预后,普通膳食+运动组大鼠比目鱼肌内FNDC5蛋白水平非常显著地高于高脂膳食对照组(<0.01),高脂膳食+运动组和普通膳食对照组大鼠比目鱼肌内FNDC5蛋白水平高于高脂膳食对照组(<0.05,图4)。

图4 大鼠比目鱼肌内FNDC5相关蛋白表达
Figure 4. The Related Protein Expression Result of FNDC5 in Soleus Muscle of Rats
2.6 各组大鼠白色脂肪中蛋白表达变化
2.6.1 白色脂肪中p38 MAPK蛋白表达变化
4周干预后,高脂膳食+运动组及普通膳食+运动组大鼠白色脂肪中p38 MAPK蛋白表达水平显著高于高脂膳食对照组(<0.01),普通膳食对照组大鼠白色脂肪中p38 MAPK蛋白水平较高脂膳食组表达增加,有统计学意义(<0.05,图5)。
2.6.2 白色脂肪UCP1蛋白表达变化
UCP1是FNDC5/Irisin所调控的下游信号。经过4周干预后,高脂膳食+运动组及普通膳食+运动组大鼠白色脂肪中UCP1蛋白表达水平显著高于高脂膳食对照组(<0.01),而普通膳食对照组较高脂膳食对照组大鼠白色脂肪中UCP1蛋白表达水平没有差异(图5)。

图5 大鼠白色脂肪中p38 MAPK、UCP1蛋白表达
Figure 5. The Protein Expression Result of p38 MAPK and UCP1 in White Adipose of Rats
3 讨论
3.1 FNDC5在骨骼肌中表达
Irisin是通过FNDC5水解生成的一个由信号肽、两个纤维蛋白结构域及一个亲脂性结构域组成的膜蛋白[4]。现在已经知道PGC1-α是诱导FNDC5表达的重要调控物质,腺苷酸活化蛋白激酶(Adenosine 5-monophosphate(AMP)-activated protein kinase,AMPK)是生物能量代谢的关键因子,在细胞能量稳态中起到重要作用[10]。有研究表明,AMPK参与FNDC5的激活,在AMPK基因特异性敲除的小鼠骨骼肌中检测到FNDC5的表达显著低于野生小鼠[25],而抑制AMPK则会使PGC-1α和FNDC5的表达降低[14]。
饮食和营养变化以及缺乏运动会引起现代生活方式改变从而打破能量摄入和消耗平衡,是造成肥胖的主要原因[3,15]。肥胖的出现往往伴随着心律不齐[20]、高血压[11]、血脂过高[7]等慢性疾病。自从发现Irisin后,研究者试图证实和进一步阐明Irisin在减脂中发挥的作用。一些研究表明,Irisin作为肌肉因子,其在运动人群中的表达要明显高于久坐人群[5]。在急性亚强度跑台的实验中发现,训练后小鼠的血清Irisin水平提高近2倍[9]。Kraemer等在成年人跑台运动1 h后检测,发现受试者血浆中Irisin水平增加,90 min运动后即刻及休息20 min后受试者血浆中Irisin水平恢复至基础水平[13]。在我们之前的研究中观察到FNDC5蛋白表达的不同规律,在一次性离心运动72 h后,大鼠比目鱼肌中FNDC5蛋白表达量显著提高,而在一次性向心运动后即刻和12 h后,大鼠比目鱼肌中FNDC5蛋白表达量显著提高[1]。大多数实验表明,运动会使体内Irisin水平升高,而在饮食对Irisin的影响方面研究较少,只能根据Irisin在肥胖状态下的水平来推测其可能的影响。有研究检测了人体内循环Irisin水平,并发现了不同的结果,其中一些研究认为在肥胖状态下人体内循环Irisin水平增加[6],而另一些发现Irisin水平与肥胖呈负相关[16]。在肥胖小鼠实验中,研究者观察到肥胖组小鼠脂肪组织中FNDC5的蛋白表达比对照组小鼠降低[17]。在我们的研究中发现,在4周运动及饮食干预后,高脂膳食对照组大鼠血清中Irisin水平较低,与其他组别相比,比目鱼肌中FNDC5蛋白表达其他组别最低,普通膳食+运动组大鼠体重及体脂显著下降,血清中Irisin显著升高且比目鱼肌中FNDC5蛋白表达显著增加,高脂膳食+运动组血清中Irisin同样升高且比目鱼肌中FNDC5蛋白表达增加,但增加程度较普通膳食+运动组低,这表明运动和饮食在减脂过程中同样重要,而二者结合往往能发挥更好的作用。
3.2 Irisin与白色脂肪棕色化
运动促进骨骼肌中FNDC5蛋白表达后,进一步促进骨骼肌释放Irisin进入血液[2]。Irisin的主要生理功能是促进白色脂肪组织(white adipose tissue, WAT)的棕色化,增加机体能量消耗[21]。脂肪组织是由WAT和棕色脂肪组织(brown adipose tissue, BAT)组成[18]。WAT细胞内含有大量脂滴和小部分线粒体,主要负责将机体多余的能量变为脂肪储存在体内[22];BAT细胞体积小却含有大量线粒体,通过其细胞膜上的交感神经纤维将体内多余的能量转化成热能,防止体内储存过多的脂肪[23]。BAT细胞中含有一种叫做解耦联蛋白1(Uncoupling protein, UCP1)的物质,这种物质使得葡萄糖和脂肪酸分解产生的能量只能转化为热能,而不是ATP,这也是BAT生理功能发挥的基础[19]。米色脂肪组织(brite adipose tissue)是一种散在分布于WAT中的一种特殊脂肪组织,它会在某些特定的刺激作用下向BAT转变,具有与UCP1一样的生理功能,促进机体产热,消耗能量[24]。我们的研究中发现,4周干预后,高脂膳食对照组脂肪含量最多但其白色脂肪中UCP1蛋白表达水平较低,普通膳食+运动组脂肪含量最低且其白色脂肪中UCP1蛋白表达水平较高,这说明运动和饮食对大鼠体内WAT起到刺激作用,增加UCP1的蛋白表达促进WAT的褐变,增加机体产热消耗能量从而达到减脂的效果。
Boström等人通过给小鼠注射腺病毒载体,使小鼠体内Irisin过量表达,会增加小鼠的能量消耗,并且体重减轻[4]。研究已经表明Irisin可以通过上调WAT中UCP1的表达来促进WAT的褐变,而目前进一步发现,抑制p38有丝分裂激活蛋白(p38 MAPK)及胞外信号相关激酶(extracellular regulated protein kinases,ERK)的信号通路则消除了Irisin对UCP1的上调作用[26]。另一项研究发现,肥胖大鼠脂肪细胞中UCP1、p38 MAPK和CD137的表达显着降低,但在经过游泳干预后UCP1及p38 MAPK蛋白水平显著升高[8],该研究认为,通过饮食诱导使肥胖大鼠脂肪细胞肥大并且脂肪组织中UCP1蛋白水平下降,而脂肪细胞肥大在运动干预后减弱且UCP1、p38 MAPK蛋白表达水平增加,因此认为Irisin/FNDC5与p38 MAPK及UCP1表达成正相关。我们的实验观察到,在4周干预后,普通膳食+运动组白色脂肪中p38 MAPK和UCP1表达水平显著增加,大鼠在饮食和运动的双重干预后体脂含量显著降低(<0.01)。
我们的研究发现,运动可以增加肥胖大鼠血清Irisin水平及骨骼肌FNDC5蛋白表达、PGC1-α和AMPK磷酸化水平,白色脂肪组织中p38 MAPK和UCP1蛋白表达增加,与骨骼肌FNDC5呈正相关,这种趋势在普通膳食+运动组的大鼠中更为明显。这与Zhang等人的结果一致;普通膳食组在降低饲料热量的条件下也呈现Irisin水平及蛋白表达量增加的趋势,双重干预组变化趋势最为明显,有显著差异。这提示,运动和饮食调控可能是通过PGC1-α—AMPK—Irisin这一途径调节机体能量代谢,但其相互关系有待进一步研究证实。而在脂肪组织中的研究结果表明,Irisin可能通过p38 MAPK信号通路调控白色脂肪组织中UCP1的蛋白表达,从而改变机体能量消耗
4 小结
4周有氧运动结合饮食调控可以有效降低肥胖大鼠体脂含量,控制肥胖大鼠体重,这可能与Irisin激活脂肪组织中p38 MAPK信号通路,促进UCP1表达,增加机体产热及能量消耗有关。Irisin的主要生理作用是促进白色脂肪组织棕色化,在明确其生理作用机制后,有望通过相应技术提取Irisin或体外合成具有活性的类似物质,成为治疗肥胖、糖尿病等相关代谢性疾病新型治疗手段。
[1] 刘子铭,于亮.一次性离心运动和向心运动对大鼠骨骼肌FNDC5的影响[C]//井冈山:2017年中国生理学会运动生理学专业委员会会议暨“学生体质健康与运动生理学”学术研讨会, 2017: 218.
[2] 刘子铭, 于亮. Irisin:新的运动因子?[J]. 生理科学进展, 2018, 49(3): 207-211.
[3] ADAMS C E, GREENWAY F L, BRANTLEY P J. Lifestyle factors and ghrelin: critical review and implications for weight loss mainte-nance[J]. Obes Rev, 2011, 12(5): 211-218.
[4] BOSTROM P, WU J, JEDRY M P. A PGC1-α-dependent myokine that drives brown-fat-like deveopment of white fat and thermogenesis[J]. Nature, 2012, 481(7382): 463-468.
[5] BOUGHTON C K, MURPHY K G. Can neuropeptides treat obesity? A review of neuropeptides and their potential role in the treatment of obesity[J]. Br J Pharmacol, 2013, 170(7): 1333–1348.
[6] CRUJEIRAS A B, PARDO M, ROCA-RIVADA A,. Longitudinal variation of circulating irisin after an energy restriction-induced weight loss and following weight regain in obese men and women[J]. Am J Hum Biol, 2014, 26(2):198–207.
[7] EMMA H, HURSTING S D. Obesityand cancer: mechanistic insights from transdisciplinary studies[J]. Endocr Relat Cancer, 2015, 22(6): 365-386.
[8] ERION J R, WOSISKI-KUHN M, DEY A,. Obesity elicits interleukin 1-Mediated deficits in hippocampal synaptic plasticity[J]. J Neuro, 2014, 34 (7): 2618-2631.
[9] FAIN J N, COMPANY J M, BOOTH F W,. Exercise training does not increase muscle FNDC5 protein or mRNA expression in pigs[J]. Metab, 2013, 62: 1503-1511.
[10] HARDMAN S E, HALL D E, CABRERA A J,. The effects of age and muscle contraction on AMPK activity and heterotrimer composition[J]. Exp Gerontol,2014, 55: 120-128.
[11] JOHN E H,DO CARMO J M,DA SILVA A A,. Obesity-induced hypertension: interaction of neurohumoral and renal mechanisms[J]. Circ Res, 2015, 116(6): 991-1006.
[12] JOHN W, SONS L. Irisin – a myokine potentially bridg/kiuing muscle and fat tissue in cachexia[J]. J Cachexia Sarcopeni Muscle, 2015, 6(4):396-397.
[13] KRAEMER R R, SHOCKETT P, WEBB N D,. A transient elevated irisin blood concentration in response to prolonged,moderate aerobic exercise in young men and women[J]. Honn Metab Res, 2014, 46(2): 150-154.
[14] LALLY J S, FORD R J, JOHAR J,. Skeletal muscle AMPK is essential for the maintenance of FNDC5 expression[J]. Physiol Rep, 2015, 3(5): e12343.
[15] MADSEN R, THYFAULT J P, BROHOLM C,. A 2-wk reduction of ambulatory activity attenuates peripheral insulin sensitivity[J]. Appl Physiol, 2010, 108 (5): 1034-1040.
[16] MORENO-NAVARRETE J M, ORTEGA F, SERRANO M,. Irisin is expressed and produced by human muscle and adipose tissue in association with obesity and insulin resistance[J]. J Clin Endocr Metab, 2013, 98(4): E769–E778.
[17] MONA F S, BASMA K R, AZZA H A. Synergistic effect of carnosine on browning of adipose tissue in exercised obese rats: A focus on circulating irisin levels[J]. J Cell Physiol, 2018, 233(6): 5044-5057.
[18] MATHIEU P, LEMIEUX I, DESPRES J P. Obesity, inflammat-ion, and cardiovascular risk[J]. Clin Pharmacol Ther, 2010, 87(4): 407-416.
[19] PETROVIC N, WALDEN T B, SHABALINA I G,. Chronic peroxisome proliferator-activated receptor gamma (PPARgamma) activation of epididymally derived white adipocyte cultures revea-ls a population of thermogenically competent, UCP1-containing adipocytes molecularly distinct from classic brown adipocytes[J]. J Biol Chem, 2010, 285(10): 7153-7164.
[20] REZA A,MARIANNE Y, PICKAVANCE L,. Altered left ventricular ion channel transcriptome in a high-fat-fed rat model of obesity: Insight into obesity-induced arrhythmogenesis[J]. J Obes, 2016, 90(5):1244-1251.
[21] ROCA-RIVADA A, CASTELAO C, SENIN L L,. FNDC5/Irisin is not only a myokine but also an adipokine[J]. PLoS One, 2013, 8(4): 7365-7375.
[22] TANAKA-YACHI R C, TAKAHASHI-MATO K A, TANIMURA Y,. Promoting effect of α-Tocopherol on beige adipocyte differentiation in 3T3-L1 cells and rat white adipose tissue[J]. J Oleo, 2017, 66 (2):171-179.
[23] TEWS D, WABITSCH M. Renaissance of brown adipose tissue[J]. Horm Res Paediatr, 2011, 75:231-239.
[24] WU J, BOSTROM P, SPARKS L M,. Beige adipocytes are adistinct type of thermogenic fat cell in mouse and human[J]. Cell, 2012, 150(2):366- 376.
[25] YVONNE O, MARIE M, DIPANJAN C,. The recruitment ofAMP-activated protein kinase to glycogen is regulated by autophosphorylation[J]. J Biol Chem, 2015,290(18):11715-11728.
[26] ZHANG Y, LI R, MENG Y,. Irisin stimulates browning of white adipocytes through mitogen-activated protein kinase p38 MAP kinase and ERK MAP kinase signaling[J]. Diabetes, 2014, 63(2): 514-525.
Effects of Aerobic Exercise and Dietary Intervention on Fat Loss in Obese Rats and the Regulation of Irisin
LIU Zi-ming1, YU Liang2, LI Lin3, FU Yue4
Beijing Sport University, Beijing 100084,China.

G804.7
A
1002-9826(2018)06-0090-07
10.16470/j.csst.201806012
2018-04-28;
2018-10-07
国家自然科学基金资助项目(31500964);霍英东教育基金会资助(151095);中央高校基本科研业务费资助;北京体育大学自主科研课题(2017YB028)。
刘子铭,女,在读硕士研究生,主要研究方向为运动生理学,E-mail:1054020588@qq.com。
于亮,男,副教授,博士,硕士研究生导师,主要研究方向为运动与骨骼肌能量代谢,E-mail:yuliang@bsu.edu.cn。
