O型口蹄疫病毒抗体高通量液相阻断CLIA检测方法的建立
2018-12-12王世杰王春新卢菲杨艳坤刘学荣安芳兰白仲虎
王世杰, 王春新, 卢菲, 杨艳坤, 刘学荣, 安芳兰, 白仲虎
(1. 江南大学 粮食发酵工艺与技术国家工程实验室, 无锡 214122;2. 无锡市人民医院, 无锡 214000; 3. 中农威特生物科技股份有限公司, 兰州 730046)
口蹄疫(Foot-and-mouth disease,FMD)是由口蹄疫病毒引起的偶蹄动物(猪、牛、羊、骆驼等)共患的急性、热性、接触性传染病,该病是世界动物卫生组织(Office International Des Epizooties,OIE)列在法定上报的动物传染病之首,对畜牧业生产的危害极大。消灭和控制口蹄疫是各国政府共同关注的世界性问题[1-2]。口蹄疫病毒分为O型、A型、C型、SAT I型、SAT II型、SAT III和Asia I型7个血清型,其中O型和A型口蹄疫在我国流行最为广泛[3]。目前,我国对O型口蹄疫采取强制免疫政策,因此如何高效而准确地对免疫抗体进行监测十分重要[4]。
血清学检测是口蹄疫诊断中应用最广泛的方法。其中Hamblin等建立的O型口蹄疫液相阻断ELISA抗体检测方法(Liquid-phase blocking ELISA,LPB-ELISA),因其具有良好的敏感性、特异性和稳定性被OIE认定为口蹄疫国际贸易检测的指定方法之一[5-7]。马军武建立的LPB-ELISA方法是目前国内FMD流行病学调查和免疫抗体监测的主要方法,同时也是国家认证的口蹄疫诊断中的标准试剂盒。该方法根据检测动物类型不同而有不同的阴阳性临界值,其中猪血清阴阳性临界值为1∶64,牛血清阴阳性临界值为1∶128,当检测效价大于临界值时,判定为阳性血清,反之则为阴性血清[8]。
但O型口蹄疫液相阻断ELISA也有其弊端。实验时,需对样本进行倍比稀释后检测,每96孔板仅能定性检测20份样本,多孔板的利用率最高仅为20%,且对样本的倍比稀释操作繁琐,当进行大规模实验时,不可避免的形成巨大的浪费和带来大量的工作强度。本文拟开发样本血清单一稀释倍数检测方法,使用特定稀释倍数对所有样本血清进行稀释检测,计算抑制率(Percentage inhibition,PI)来对检测结果进行判断,通过受试者工作特征曲线(Receiver operating characteristic,ROC)确定试验的最佳临界值,从而达到高通量定性检测的目的。同时,用CLIA检测技术替代ELISA检测技术,提高检测体系的灵敏度及稳定性,为口蹄疫诊断提供一种高效、快速和有效的定性检测方法。
1 材料与方法
1.1 材料
1.1.1 血清样品154份口蹄疫阴性血清,其中牛血清17份,猪血清137份;202份已知背景O型口蹄疫阳性血清,其中牛血清60份,猪血清142份;326份田间血清样品。上述血清均由中农威特生物科技股份有限公司提供。
1.1.2 病毒抗原与主要试剂使用的O型FMDV灭活抗原均由中农威特生物科技股份有限公司提供,蛋白浓度为1.2 mg/mL。辣根过氧化物酶(HRP)和NHS-LC-LC-Biotin购自美国Thermo Fisher公司;链霉亲和素(SA)购自美国Sigma公司;化学发光板购自美国Costar公司;O型口蹄疫兔多抗由杭州启泰生物技术有限公司制备,蛋白浓度为1.6 mg/mL;对比试剂盒O型口蹄疫抗体液相阻断ELISA检测试剂盒由中农威特生物科技股份有限公司提供。
1.2 方法
1.2.1 生物素化抗原的制备称取1 mg的NHS-LC-LC-Biotin溶于20 mL O型口蹄疫灭活抗原溶液中,混匀,静置于室温反应2 h。温育结束后取出反应液进行透析,透析液组分为pH 7.4,0.1 mol/L磷酸盐缓冲液,1000 mL透析4次,每次2 h,透析温度为4℃。透析后加入50%(V/V)甘油,分装,-20℃保存。
1.2.2 最佳兔多抗包被浓度和最佳抗原工作浓度的确定用方阵滴定法确定最佳兔多抗包被浓度和最佳抗原工作浓度。用pH 7.0,0.1 mol/L磷酸缓冲液从1∶100连续2倍稀释兔多抗溶液横向包被化学发光板,100 μL/孔,室温过夜; PBST洗涤3次,300 μL/孔,拍干;用pH 7.4的PBST从1∶5连续两倍稀释生物素化抗原纵向加样,50 μL/孔,37℃孵育2 h;PBST洗板3次,拍干,每孔加入50 μL的酶标链霉亲和素(SA-HRP),37℃孵育30 min;PBST洗板3次,拍干,每孔加入100 μL化学发光底物,用化学发光读数仪读值,以光子数(RLU)超过5×107时最高的兔多抗包被浓度和抗原浓度作为两者的最佳使用浓度。
1.2.3 血清稀释倍数的确定取13份O型口蹄疫阳性血清以及11份口蹄疫阴性血清用PBST做1∶8~1∶256连续倍比稀释,用本方法进行检测。
1.2.4 临界值确定189份O型口蹄疫阳性血清和143份口蹄疫阴性血清被用于本方法结果判定标准建立实验,其中O型口蹄疫阳性血清包括55份牛血清,134份猪血清;口蹄疫阴性血清包括13份牛血清,130份猪血清。用1.2.3确定的稀释倍数对上述血清进行稀释检测,计算抑制百分率并使用SPSS 20.0对数据进行分析,绘制PI的ROC曲线确定试验最佳临界值[9]。

1.2.5 LPB-CLIA操作步骤将待检测血清用PBST稀释32倍,50 μL/孔加入U型反应板中,再加入50 μL/孔的生物素化抗原,震荡混匀,同时设立4组抗原对照孔,每孔加入50 μL的生物素化抗原以及50 μL的PBST,封板,37℃孵育1.5 h。待孵育结束后,每孔取50 μL整体平移至兔多抗包被板中,封板,37℃温育40 min,用PBST洗板5次,300 μL/孔,拍干,加入50 μL/孔的酶标链霉亲和素,封板,37℃温育30 min。同上洗板,拍干。将底物A和底物B等量混匀,以100 μL/孔加入包被板中,立即用化学发光读数仪读数。
1.2.6 重复性检验针对本方法的批内及批间变异系数进行测定。首先测定批内变异系数,取3份口蹄疫阴性血清(N1、N2、N3)和4份O型口蹄疫阳性血清(P1、P2、P3、P4)用PBST稀释32倍,分装为4份,-20℃冻存。每次实验各血清取一份分装品,使用同一批试剂(批号20171017)在相同实验条件下重复测定4次,记录RLU值变化及其变异系数。为了对批间变异系数进行测定,取2份口蹄疫阴性血清(N4、N5)和5份O型口蹄疫阳性血清(P5、P6、P7、P8和P9),用PBST稀释32倍,分装为3份,-20℃冻存。每次实验各血清取一份分装品,用3批试剂(批号20171017、20171020、20171023)在相同实验条件下重复测定3次,记录RLU值变化及其变异系数。
1.2.7 特异性和敏感性检验 326份田间样本血清按照1.2.5所述进行测定,并用O型口蹄疫抗体液相阻断ELISA检测试剂盒同时检测作为参比,考察本方法检测的特异性和敏感性。

图1 LPB-CLIA实验流程图
2 结果
2.1 最佳兔多抗包被浓度和最佳抗原工作浓度的确定
本实验用方阵滴定法确定兔多抗包被浓度以及最佳抗原浓度,根据实验原理选取兔多抗包被量大于抗原使用量且RLU值高于5×107时的两者浓度作为最佳浓度。结果如表1所示,兔多抗最佳包被浓度为2 μg/mL,抗原最佳工作浓度为15 μg/mL。

表1 方阵滴定法结果
2.2 血清稀释倍数的确定
将13份O型口蹄疫阳性血清和11份口蹄疫阴性血清做1∶8~1∶256倍连续倍比稀释进行检测,分析每个稀释度下阴阳性血清光子数分布情况,检测结果(见图2)表明:1∶8、1∶128和1∶256稀释时,阳性血清和阴性血清的RLU值出现了部分重叠,说明以这3种比例稀释时无法有效地区分血清的阴阳性;在1∶16和1∶64稀释时,阴阳性血清箱型的主体部分虽然得到明显的分离,但上下边缘有部分交叠,说明以这两种比例稀释时,检测会导致较高的假阳性率(或假阴性率);在1∶32稀释时,阴阳性血清RLU值没有重叠现象,表明阴阳性血清得到了良好的区分。最终,确定血清稀释倍数为1∶32。

图2 血清稀释倍数筛选实验结果
2.3 临界值的确定
为了对检测血清的阴阳性进行有效地判断,对189份O型口蹄疫阳性血清和143份口蹄疫阴性血清进行检测,同时以抑制率PI作为判断依据,利用SPSS 20.0对实验数据进行分析,绘制PI值的ROC曲线,以Youden index为指标确定本方法的最佳cut-off值,实验结果如图3和表2所示。结果显示ROC曲线面积为0.989,标准误为0.004,在PI值为62.5%时,Youden index达到最大值0.881,此时灵敏度为93.7%,特异性为94.4%,表明此时本试验具有良好的检测准确性。因此,将本方法的阴阳性临界值确定为62.5%,即当样本检测抑制率低于62.5%时,判定该血清为阴性血清;反之,则为阳性血清。
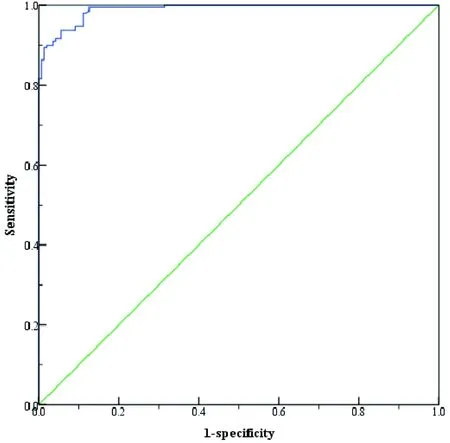
图3 ROC曲线

临界值(%)Cut-off value敏感性(%)Sensitivity特异性(%)Specificity约登指数Youden index67.389.996.50.86567.190.596.50.87066.391.096.50.87565.291.095.80.86864.791.595.80.87364.591.595.10.86664.391.594.40.85963.792.194.40.86563.192.694.40.87062.893.194.40.87562.593.794.40.88162.393.793.70.87462.293.793.00.86762.193.792.30.86061.793.791.60.85360.993.790.90.84660.494.290.90.85160.294.790.90.85659.994.790.20.84959.394.789.50.842
2.4 重复性检验结果
对本方法的批内及批间变异系数分别进行测定,实验结果见表3与表4。血清检测RLU值批内变异系数均小于10%,批间变异系数均小于15%;抑制率批内变异系数均小于6%,批间变异系数小于10%,其中阴性血清检测变异系数均略大于阳性血清检测变异系数;抗原对照的RLU值批内变异系数为4.18%,批间变异系数为5.01%。以上结果说明本方法检测CV符合行业标准(批内变异系数小于10%,批间变异小于15%),证明本试剂检测结果稳定,具有很好的可重复性。
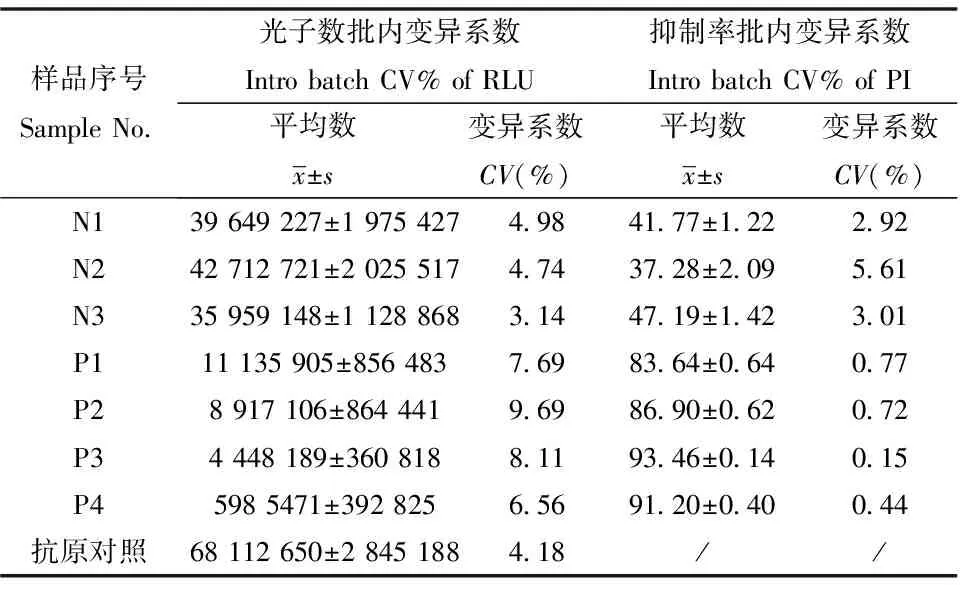
表3 批内重复性检测结果
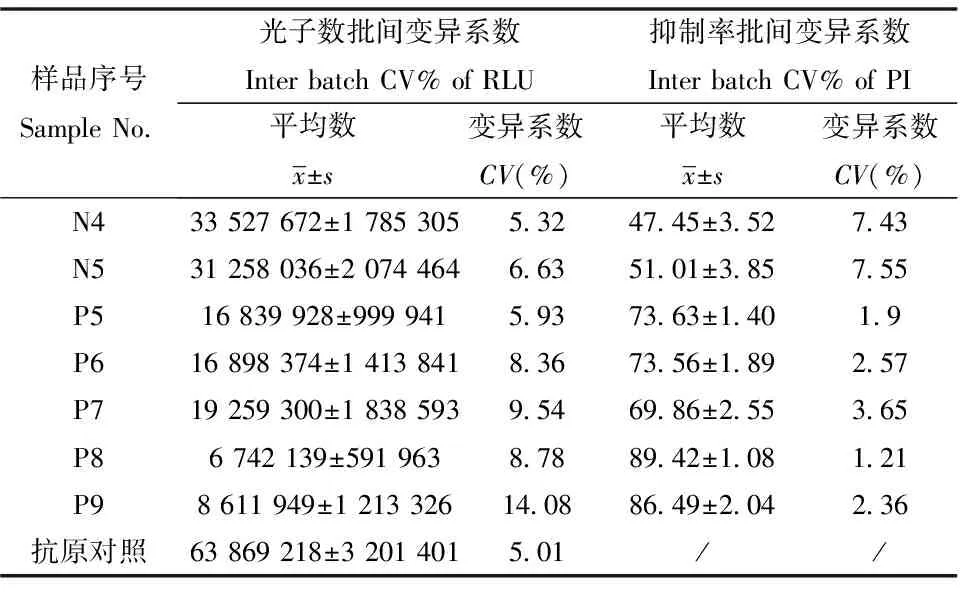
表4 批间重复性检测结果
2.5 敏感性和特异性检验
用本方法与兰州兽医研究所O型FMDV抗体液相阻断试剂盒同时检测323份田间血清。检测结果(如表5)显示,本方法的敏感性为94.6%,特异性为95.6%,准确度为95.1%,两者的诊断结果相关性显著,说明本方法检测结果具有可靠性,具有可信的临床诊断能力。
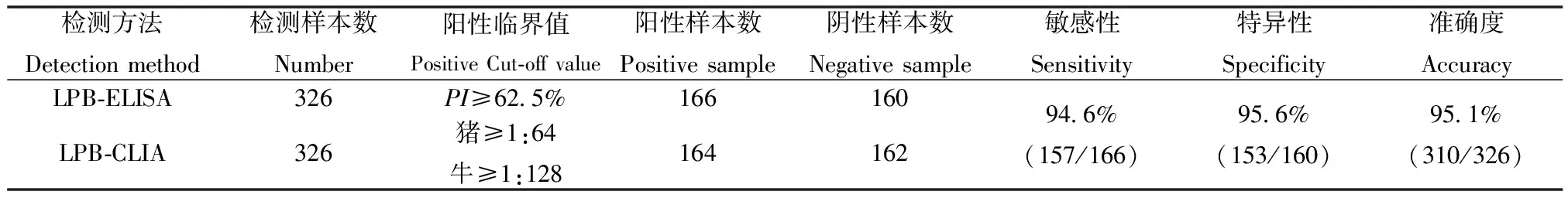
表5 敏感性和特异性检测结果
3 讨论与结论
血清学诊断技术是口蹄疫防治中的核心技术之一,目前,以国家参考实验室为龙头,研制了液相阻断ELISA、固相竞争ELISA、非结构蛋白3ABC抗体检测ELISA等多项技术,为我国口蹄疫疫情的监测和防治做出了重大贡献。液相阻断ELISA因其良好的敏感性、特异性和稳定性是国际中应用最为广泛的口蹄疫血清学诊断技术,但较低的检测通量限制了该方法在大批量血清检测时的应用。而多梯度的稀释正是导致低检测通量的主要原因。因此,为了提高试验的检测通量,本研究建立了液相阻断血清单一稀释倍数定性检测的方法。在确定血清稀释倍数时,笔者发现随着稀释倍数的变化,阴性血清的RLU值分布范围会相应地发生变化,在16倍和32倍稀释时,RLU值分布范围最广,而8倍稀释与64倍稀释时,RLU分布范围最窄,通过进一步分析发现,这是由于阴性血清中不同效价的血清在稀释过程中,RLU变化趋势不一致导致。阳性血清稀释检测中同样存在这一现象。笔者认为会存在某个合适的稀释倍数,可能为16倍或32倍,可以对不同效价的血清进行区分,当通过分析建立PI值与效价间的对应关系后,便可实现单一稀释倍数的抗体定量检测,但该定量检测的范围必定是有限和较窄的。这一猜想将在后续研究中展开。
本文使用ROC曲线分析法确定试验的最佳临界值。ROC曲线分析是临床诊断中确定临界值最为有效的方法,而在ROC曲线分析中,借助Youden index进行判断是较为常用的手段[9-10]。Youden index指该点的敏感性和特异性之和减1,其值可反映试验的真实性,Youden index越接近1,代表以该点为临界值时试验的真实性越高。以此为依据,确定了试验的最佳临界值为62.5%。同时,笔者发现临界值在59.9%~67.1%间时,试验的灵敏度和特异性均高于90%,后续研究可将这一区域认定为灰区,进一步提高试验的检测准确性。
本研究对试验的稳定性也进行了优化。Hamblin和Maanen等[11-12]对口蹄疫抗体液相阻断ELISA检测法的重复性进行了实验,结果发现检测25份血清中96%效价变化在2个滴度内,这与笔者在使用ELISA法检测时,发现样本检测效价会在±1个滴度内波动的实验现象相符。笔者认为这是由于ELISA检测体系限制导致的,因此本文使用CLIA检测法替代ELISA检测法,对本方法检测的可重复性进行了改良。重复性实验检验得到RLU和PI批内变异系数均小于10%,同时批间变异系数均小于15%,表明试验结果的可重复性强。虽然本方法现阶段只能定性的对血清进行检测,但在后续研究中,稳定的抑制率检测结果可为抗体定量检测奠定坚实的基础。
本文最终建立了一种O型口蹄疫病毒高通量液相阻断化学发光免疫分析抗体定性检测方法,使用单一稀释倍数对血清进行定性检测,避免了繁复的倍比稀释过程,对比LPB-ELISA检测通量提高了5倍左右,大大提高了检测效率以及对材料的利用率,缩减了时间和经济成本,为口蹄疫的检疫提供了更为高效、经济的手段。
