酶法提取地桃花多糖的工艺优化及其抗氧化活性
2018-12-10,,,,2,*
,,,,2,*
(1.玉林师范学院生物与制药学院,广西玉林 537000; 2.广西农产资源化学与生物技术重点实验室,广西玉林 537000)
天然植物多糖具有抗炎、抗氧化[1]、增强免疫[2]、抗病毒[3]、防衰老[4]等多种药理作用,且毒副作用低,越来越受到学者的重视[5]。植物多糖可作为食品和药品的有效添加成分,药食两用植物多糖系列产品的市场前景将非常广阔[6]。天然产物多糖来自于植物细胞膜和微生物细胞壁的天然高分子化合物,可采用有机溶剂、酶解等方法提取,其中酶解提取操作简单、条件较温和,在多糖结构研究以及活性保持方面具有一定的优势[7]。
地桃花(UrenalobataL.)又称肖梵天花、假桃花、野棉花等,属于锦葵科植物,主要产于广西、四川及贵州等地,富含多种药效成分如多糖类、黄酮类、苷类、香豆素、木脂素以及蛋白质[8-10]。研究报道地桃花提取物具有明显的抗炎、抗菌及抗氧化等药理活性[11-13]。地桃花可清热解毒、祛风利湿及活血消肿,用于治疗感冒、痢疾等疾病,是中成药花红片生产的原料成分之一[14],对其有效成分多糖的研发将有助于提升其药食两用价值。目前有关地桃花单一成分提取及其生物活性的研究报道很少,针对多糖成分,仅见蓝峻峰等采用超声波辅助半仿生法提取,结果表明,在液料比30∶1、超声功率60 W、提取温度75 ℃、提取时间50 min的条件下,地桃花多糖得率为12.86%[14],此工艺相比酶法具有提取温度高、需要超声设备、工艺复杂等缺点。为了解地桃花多糖生物活性及优化其提取工艺,本文研究了纤维素酶提取地桃花多糖的最佳条件,并探讨其体外抗氧化活性,为地桃花多糖进一步开发及抗氧化活性的深入研究提供一定的科技支持。
1 材料与方法
1.1 材料与仪器
地桃花采自广西容县,经陈晓白教授鉴定为锦葵科梵天花属地桃花干燥全草;纤维素酶(食品级,5万U/g)、维生素C、D-无水葡萄糖 购自北京索莱宝科技有限公司;DPPH(1,1-二苯基-2-三硝基苯肼) 购自日本TCI公司;其它试剂 均为国产分析纯。
5810R型高速离心机 德国Eppendorf;Alpha-1506型紫外分光光度计 上海谱元仪器;SHA-BA双功能水浴恒温振荡器 常州华普达教学仪器;PHS-25型pH计 上海雷磁;SHB-III型循环水真空泵、2L-ARE旋转蒸发器 上海皓庄仪器。
1.2 实验方法
1.2.1 地桃花多糖的提取 地桃花全草自然晾干,精确称取5.0 g粉碎并过100目筛后的地桃花粉,按设定酶解条件(pH、液料比、酶添加量、酶解时间、酶解温度),在180 r/min摇床上进行酶解提取实验,得到多糖浸提液。多糖浸提液经90 ℃高温灭活、6000 r/min离心分离10 min、抽滤、滤液用旋转蒸发仪80 ℃浓缩至1/10、乙醇沉淀、Sevag法除蛋白、透析除杂、乙醇二次沉淀、真空冷冻干燥(温度-55 ℃,压力0.05 MPa)一系列步骤[15],最终获得地桃花多糖。
1.2.2 地桃花多糖含量的测定 多糖测定采用苯酚-硫酸法[16],葡萄糖标准曲线方程为y=8.4986x-0.0185,R2=0.9903,式中y为490 nm条件下的吸光度值,x为葡萄糖质量浓度(mg/mL)。多糖得率计算公式如下:
多糖得率(%)=cnV/m×100
式中,c为样品稀释液中多糖的浓度(mg/mL),n为稀释倍数,V为样品稀释液体积(mL),m为地桃花粉质量(mg)。
1.2.3 单因素实验 酶解时摇床转速固定为180 r/min,分别考察pH(3.0、4.0、5.0、6.0)、液料比(4∶1、8∶1、12∶1、16∶1、20∶1、24∶1 mL/g)、酶添加量(2、6、10、14、18 mg/mL)、酶解时间(40、80、120、160、200 min)和酶解温度(35、45、55、65 ℃)对地桃花多糖得率的影响,其中各因素固定水平为pH5.0、液料比8∶1 mL/g、酶添加量10 mg/mL、酶解时间80 min、酶解温度45 ℃。
1.2.4 响应面试验 响应面因素水平设计见表1,自变量包括液料比、酶解时间、酶添加量、酶解温度四个因素,以多糖得率为响应值。响应面试验因素及水平表如表1所示。

表1 响应面因素设计与水平表Table 1 Factors and levels of response surface design
1.2.5 地桃花多糖体外抗氧化活性测定
1.2.5.1 DPPH自由基清除能力测定 取不同质量浓度的地桃花多糖溶液2 mL和2 mL DPPH溶液(0.2 mmol/L)混匀,反应30 min后在517 nm处测定其吸光度A1,同法测定2.0 mL乙醇加样液的吸光度A2,以及2.0 mL DPPH溶液与2.0 mL蒸馏水的吸光度A0,以维生素C作为对照,样品对DPPH自由基的清除率Y(%)=[1-(A1-A2)/A0]×100[15]。
1.2.5.2 ·OH的清除能力测定 取不同质量浓度的地桃花多糖溶液2 mL,依次加入浓度均为5 mmol/L的FeSO4溶液、H2O2溶液各2 mL,混匀,静置10 min,再加入5 mmol/L的水杨酸溶液2 mL,混匀,37 ℃水浴30 min后,波长510 nm处测定吸光度B1,用蒸馏水代替水杨酸测定吸光度B2,以蒸馏水代替样品溶液测定吸光度B0,以维生素C作为对照,样品对·OH的清除率Y(%)=[1-(B1-B2)/B0]×100[15-16]。
1.3 数据处理
所用数据是3次平行实验的均值±标准差,响应面数据分析采用Design Expert 8.06软件,采用 SPSS 20.0 进行数据间的显著性分析,并利用GraphPad Prism 6.0软件进行绘图。
2 结果与分析
2.1 单因素实验
2.1.1 纤维素酶添加量对地桃花多糖得率的影响 由图1可知,当酶添加量从2 mg/mL增加到10 mg/mL时,多糖得率显著提高(p<0.05),由8.19%上升至12.78%,进一步加大酶用量,多糖得率没有显著变化(p>0.05),说明在该底物浓度下,酶浓度已经趋于饱和,继续增加纤维素酶用量,对多糖得率没有显著影响(p>0.05)。因此,选择10 mg/mL作为纤维素酶的最佳添加量。
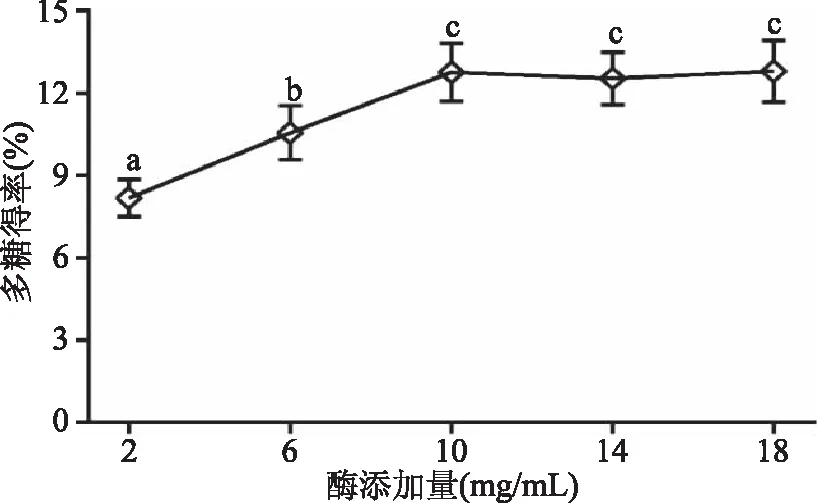
图1 纤维素酶添加量对多糖得率的影响Fig.1 Influence of cellulase dosage on the polysaccharide extraction rate注:不同小写字母表示差异显著(p<0.05),图2~图5同。
2.1.2 pH对地桃花多糖得率的影响 由图2可知,当pH由3.0增加到5.0时,多糖得率由8.65%增加至最大值12.46%(p<0.05),pH增大到6.0时,多糖得率反而减小,得率为11.98%,与pH4.0、pH5.0比较差异均不显著(p>0.05)。因为在最适pH时,酶分子上活性基团的解离状态最适于与底物结合,pH高于或低于最适pH时,活性基团的解离状态可能发生改变,酶和底物结合力减弱,酶反应速率降低。因此,酶解最适pH选定为5.0。
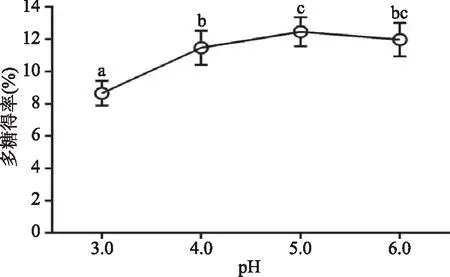
图2 pH对多糖得率的影响Fig.2 Influence of pH value on the polysaccharide extraction rate
2.1.3 液料比对地桃花多糖得率的影响 由图3可知,当液料比由4∶1增加到8∶1时,多糖得率由9.45%增加至13.25%(p<0.05),之后,随着液料比继续增大,多糖得率反而减小,原因可能与过高液料比不利于多糖物质溶出有关,此外,水用量过大加重后续浓缩工作负担,不利于工业化实际生产。故液料比选择为8∶1 mL/g。
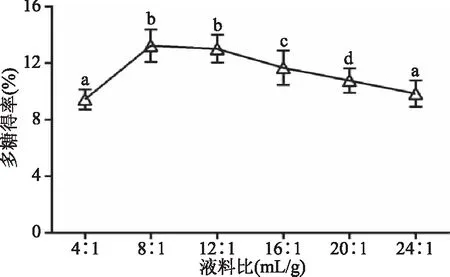
图3 液料比对多糖得率的影响 Fig.3 Influence of the ratio of water to material on the polysaccharide extraction rate
2.1.4 酶解温度对地桃花多糖得率的影响 由图4可知,温度由35 ℃上升到45 ℃,多糖得率由9.35%增大至13.28%,主要因为温度升高增强酶活性,促进有效成分溶出,55 ℃时多糖得率为13.07%,与45 ℃比较变化不显著(p>0.05),进一步提高温度至65 ℃,此时多糖得率显著减小(p<0.05),这是因为温度过高导致酶活力减弱所致。因此选择45 ℃为最适酶解温度。
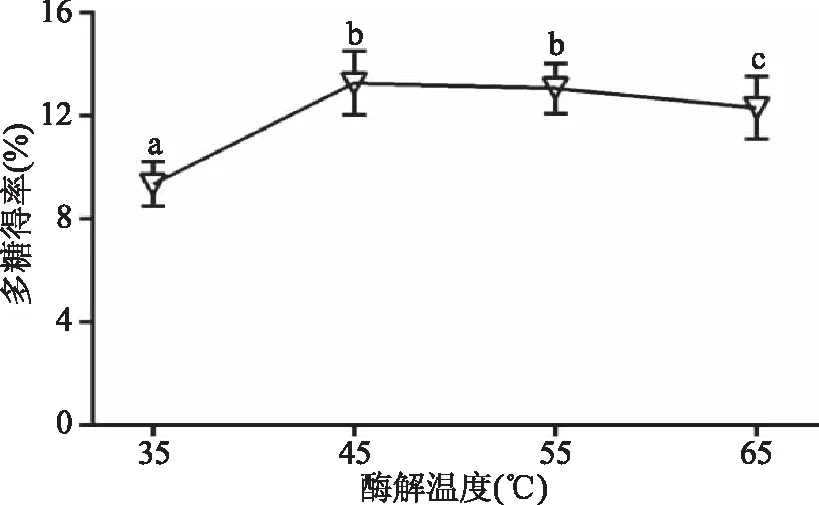
图4 酶解温度对多糖得率的影响 Fig.4 Influence of hydrolysis temperature on the polysaccharide extraction rate
2.1.5 酶解时间对地桃花多糖得率的影响 由图5可知,酶解40 min时多糖得率为8.65%,当时间延长至80 min时,多糖得率接近160 min时的最大值,再继续延长提取时间,多糖得率变化不显著(p>0.05),多糖提取效率反而降低,此外,酶解时间过长,酶催化活性减弱反而对多糖提取不利,考虑实际生产效率。因此,本研究选择80 min为最佳酶解时间。
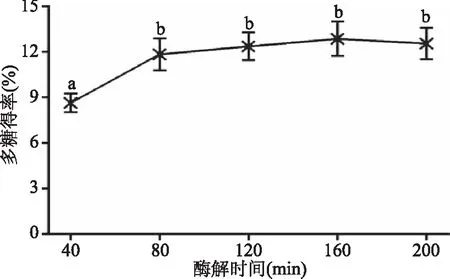
图5 酶解时间对多糖得率的影响 Fig.5 Influence of hydrolysis time on the polysaccharide extraction rate
2.2 响应面优化试验
2.2.1 响应面试验结果与分析 试验设计及结果见表2,回归模型方差分析见表3。对表2中数据进行回归拟合,获得自变量(液料比、酶解时间、酶添加量、酶解温度)与地桃花多糖得率(Y)的二次多项回归方程:
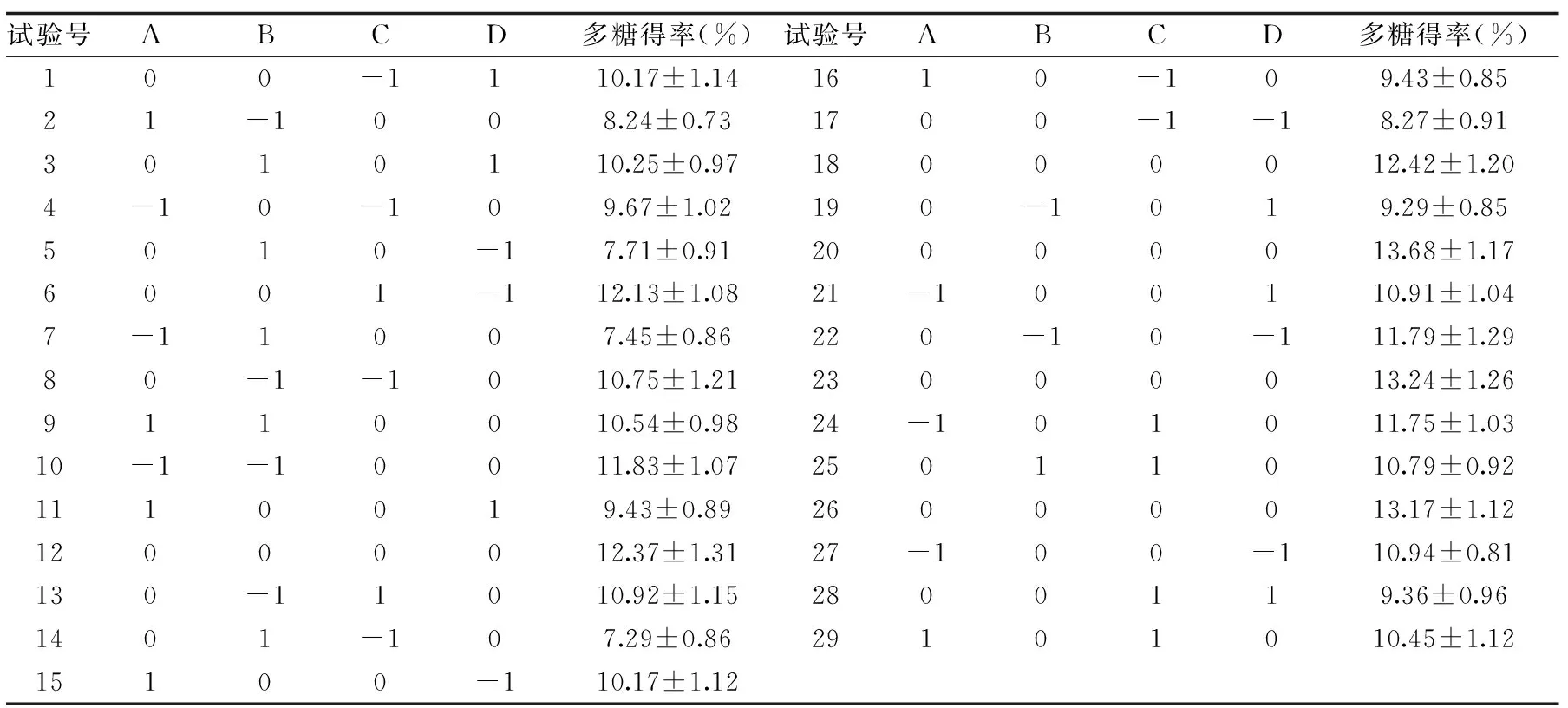
表2 地桃花多糖提取的响应面试验结果Table 2 Results of response surface design for Urena lobata L. polysaccharides extraction
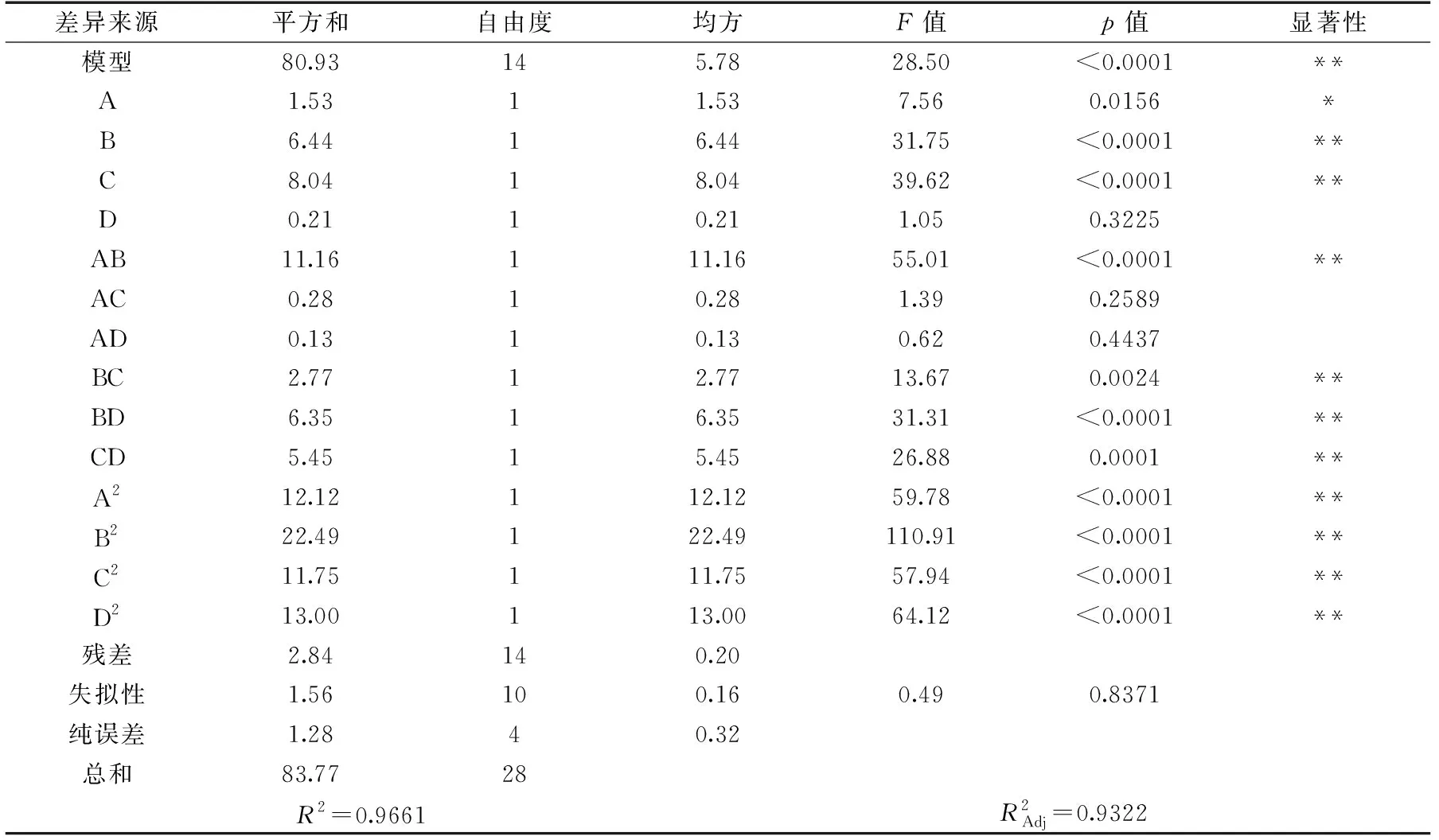
表3 方差分析Table 3 Variance analysis
Y=12.98-0.36A-0.73B+0.82C-0.13D+1.67AB-0.27AC-0.18AD+0.83BC+1.26BD-1.17CD-1.37A2-1.86B2-1.35C2-1.42D2。
由表3的F值可知,地桃花多糖纤维素酶法提取影响因素的主次顺序为:酶添加量(C)>酶解时间(B)>液料比(A)>酶解温度(D),其中A影响极显著(p<0.01),B、C影响显著(p<0.05),D影响不显著(p>0.05)。平方项A2、B2、C2、D2影响极显著(p<0.01)。因素间交互作用对地桃花多糖得率的影响如图6所示。由图6(a、d、e、f)和表3方差分析结果可知,AB、BC、BD、CD交互作用对多糖得率影响达到极显著水平(p<0.01),AC、AD间交互作用对多糖得率影响不显著(p>0.05)。
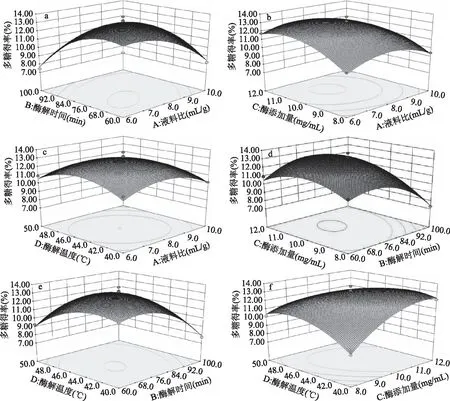
图6 各因素交互作用对多糖得率影响的响应面图 Fig.6 Response surface graphs of effect of interactions of various factors on polysaccharide yield
2.2.2 最佳提取条件预测及验证 对回归模型方程求解,获得地桃花多糖纤维素酶提取的最佳条件为液料比7.2∶1 mL/g,酶解温度 43.2 ℃,酶解时间71.8 min,酶添加量10.74 mg/mL,此条件下多糖得率为13.37%。考虑实际操作方便,将上述最佳提取参数修改为液料比7∶1 mL/g,酶解温度 43 ℃,酶解时间72 min,酶添加量10.8 mg/mL,根据工艺条件进行三组平行实验,所得多糖得率为13.32%±1.15%,与回归方程理论多糖得率13.37%的相对误差为0.37%,提示本响应面法得到的回归模型有效、可靠,得到的纤维素酶提取地桃花多糖工艺条件具有实际应用价值。
2.3 地桃花多糖的体外抗氧化活性
2.3.1 地桃花多糖对DPPH自由基的清除作用 由图7可知,当地桃花多糖浓度在0.2~10 mg/mL时,对DPPH自由基清除率不断增大,当质量浓度为10 mg/mL时,地桃花多糖对DPPH自由基清除率为90.06%,而维生素C对DPPH自由基清除率可达94.12%,地桃花多糖清除DPPH自由基的半数抑制浓度IC50为1.082 mg/mL,维生素C的IC50为0.643 mg/mL,两者比较,地桃花多糖清除能力较弱于维生素C。以上结果提示地桃花多糖具有较好的DPPH自由基清除作用。
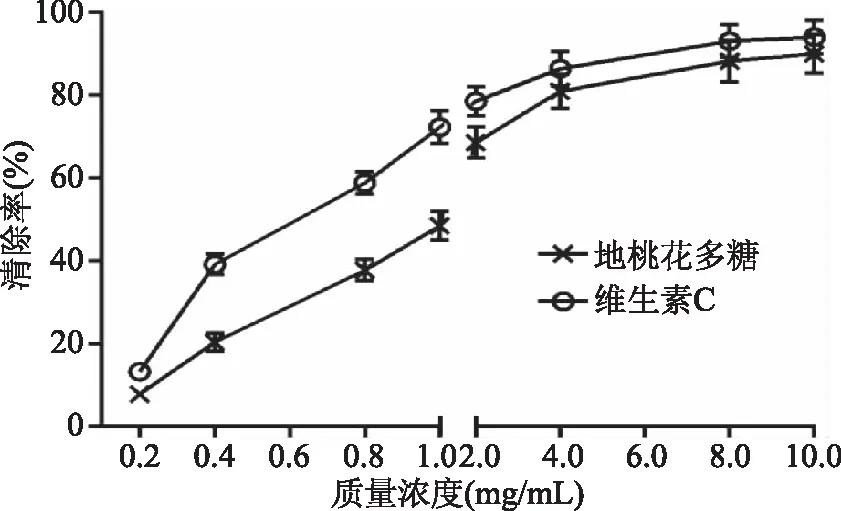
图7 地桃花多糖对DPPH自由基的清除作用Fig.7 The scavenging effect of polysaccharide from Urena lobata L. on DPPH radical
2.3.2 地桃花多糖对·OH清除作用 由图8可知,当地桃花多糖浓度在0.2~10 mg/mL时,对·OH清除率稳步提升,而维生素C在浓度4 mg/mL时对·OH清除率就已达到最大值,之后趋于稳定。当质量浓度为10 mg/mL时,地桃花多糖对·OH清除率为89.75%,维生素C对·OH清除率可达96.38%,地桃花多糖清除·OH的IC50为3.202 mg/mL,维生素C的IC50为0.368 mg/mL,两者比较,维生素C清除能力强于地桃花多糖。以上结果说明,地桃花多糖具有较好的·OH清除作用。
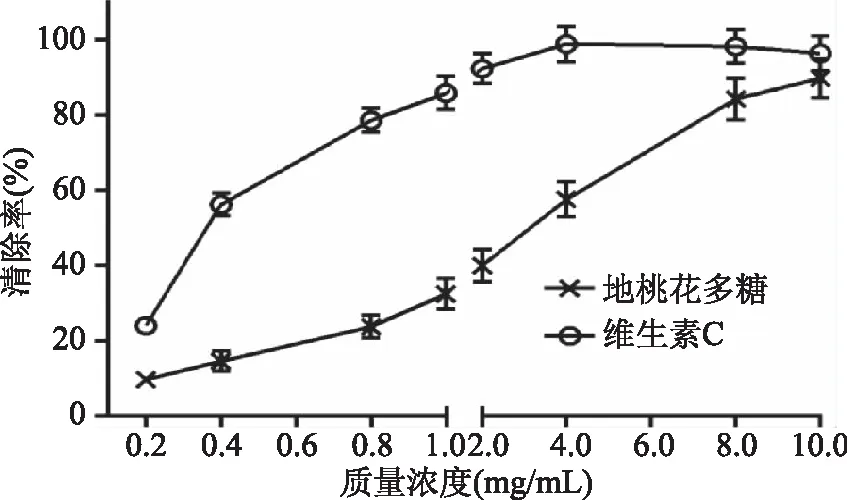
图8 地桃花多糖对·OH的清除作用Fig.8 The scavenging effect of polysaccharide from Urena lobata L. on hydroxyl radical
3 讨论与结论
本研究在单因素实验基础上,通过响应面优化试验考察了地桃花多糖纤维素酶提取的工艺。结果发现,纤维素酶添加量对地桃花多糖得率影响最大,其次是酶解时间和液料比,而酶解温度对其多糖提取影响最小;地桃花多糖最佳酶解提取条件为酶添加量10.8 mg/mL、酶解时间72 min、液料比7∶1 mL/g、酶解温度43 ℃、pH=5.0,在此条件下地桃花多糖的得率为13.32%,与回归模型方程预测值13.37%相比,相对误差小于5%。蓝峻峰等[14]探讨超声波法辅助半仿生法提取地桃花中多糖的最佳工艺,采用半仿生提取,在超声波协同作用的基础上,以正交试验法考察超声功率、超声时间、超声温度等因素对多糖得率的影响,结果获得地桃花多糖得率为12.86%,稍小于本研究中的多糖得率,本研究酶法提取温度43 ℃明显低于其提取温度75 ℃,节约能源,且不需要大型设备,液料比明显减小,可一定程度上提高生产效率。
体外抗氧化活性试验表明,地桃花多糖对DPPH自由基、·OH均具有较强的清除能力,在本实验质量浓度下,其对两种自由基的清除能力均呈现一定的正相关关系。地桃花多糖清除DPPH自由基的IC50为1.082 mg/mL,清除·OH的IC50为3.202 mg/mL。但与维生素C比较,地桃花多糖清除两种自由基的能力较弱。薛井中等也研究地桃花水提取物清除·OH和DPPH自由基、及抑制油脂氧化的能力,结果表明地桃花提取物各部位均有一定的抗氧化能力,但抗氧化活性都弱于维生素C[17],与本研究结果一致。以上结果为地桃花功能成分的研究开发提供一定的前期理论基础。
