响应面优化藜麦糠黄酮类化合物的提取及其抗氧化性研究
2018-12-10,,,,
,,,,
(山西大学生命科学学院,山西太原 030006)
藜麦(Chenopodiumquinoawilld),原产于南美洲的玻利维亚、厄瓜多尔和秘鲁。在欧洲、非洲与亚洲普遍为实验性种植。随着藜麦作为公认的“全能食物”在全球的盛行[1-2],1987年藜麦引入我国西藏,因其需要特殊的培育种植环境,目前在山西、四川、青海、陕西等地均建立了藜麦实验种植区[2]。藜麦富含纤维素,多不饱和脂肪酸种类丰富,各类维生素及多种矿物质含量普遍高于普通谷类[3]。在抗氧化、降血压降血脂、消炎抗菌等方面天然黄酮效果极为明显,近年来存在于植物中的天然黄酮类化合物多用于药品及保健品的开发。藜麦中含量较高生物活性物质具有防癌、消炎、降血压、减脂等生理活性,如:芦丁、异槲皮素、槲皮素、山奈酚等,特别是藜麦类黄酮中的槲皮素与其苷类化合物的抗肿消炎、抗氧化的效果极为明显[4]。
目前,对于藜麦籽粒中营养组成、健康功效及其在食品中应用现状的研究和报道详细[5-6],梁彬等[7]采用微波辅助提取藜麦种子总黄酮提取量为6.5 mg/g。孙雪婷等[8]利用乙醇浸提法提取藜麦种子黄酮提取得率2.64 mg/g,董晶等[9]利用超声波法提取藜麦黄酮提取率为0.31%,陆敏佳等[10]利用乙醇回流法提取藜麦叶片黄酮提取得率为0.619%等。上述研究多集中在籽粒,且籽粒中黄酮含量较低,而关于藜麦糠中黄酮的研究却鲜有报道。藜麦糠作为藜麦的副产品,应加以开发和利用。本实验以藜麦糠为原料,利用超声波辅助提取其中的黄酮类化合物,在优化提取工艺的基础上进一步对其抗氧化活性进行研究,以期提高对藜麦的综合开发与利用价值,为藜麦副产物的充分利用提供理论依据。
1 材料和方法
1.1 材料与仪器
藜麦糠 山西省华青藜麦产品开发有限公司;芦丁标准品(AR≥98%)、DPPH(1,1-二苯基-2-三硝基苯肼)(AR≥95%) 美国Sigma公司;其他所用试剂 均为分析纯。
HRHS24型电热恒温水浴锅 青岛海尔医用低温科技有限公司;JP-040ST 型超声波清洗机 深圳市洁盟清洗设备有限公司;TG16A-WS型高速离心机 武汉爱斯佩科学仪器有限公司;SP-2000UV型紫外可见分光光度计 上海光谱仪器有限公司。
1.2 实验方法
1.2.1 藜麦糠黄酮的提取 通过索氏提取法去除样品中油脂等杂质(GB/T5009.62003)。然后精密称取一定质量样品粉末于干燥烧杯中,加入乙醇溶液浸泡10 min后利用超声波清洗器辅助提取,结束后经过4000 r/min离心20 min后收集上清液进行真空抽滤,滤液备用。
1.2.2 藜麦糠黄酮得率的测定 将芦丁标准品经过110 ℃恒温干燥至恒重并冷却至室温备用,配浓度0.186 mg/mL标准溶液。分别精密吸取0.00、1.00、2.00、3.00、4.00、5.00 mL芦丁标准品溶液于20 mL具塞试管中。30%乙醇补至5 mL,摇匀,向各组加入5%亚硝酸钠0.3 mL,10%硝酸铝溶液0.3 mL,静置5 min,加4%氢氧化钠溶液2.0 mL,待其充分反应,分别补加30%乙醇溶液至10 mL,摇匀后静置}于510 nm处测定吸光度。记录数据,并绘制以吸光度为纵坐标以浓度为横坐标的标准曲线[11],所得回归方程为Y=0.9932X+0.044(R2=0.991),式中Y为吸光度;X为芦丁质量浓度(mg/mL)。
测定样液时,精密吸取1 mL样液于具塞试管中,按照1.2.2的方法处理,在510 nm处测定其吸光度。根据公式(1)求出样品中黄酮的得率:
式(1)
式中,Y为样品中黄酮的得率(%),W为藜麦糠粉末重量(g),C为根据标准曲线得的样液黄酮浓度(mg/mL),V为定容体积(mL),N为稀释倍数。
1.2.3 单因素实验 实验考察了乙醇浓度、液料比、超声时间和超声温度等因素对样品中黄酮类化合物得率的影响。称取2.00 g已预处理的藜麦糠粉末。固定乙醇浓度60%,超声时间为20 min,超声温度为60 ℃,考察液料比在10∶1、20∶1、30∶1、40∶1、50∶1 mL/g条件下黄酮类化合物的得率。固定液料比为30∶1 mL/g,超声时间为20 min,超声温度为60 ℃,考察乙醇浓度在50%、60%、70%、80%、90%条件下黄酮类化合物的得率。固定液料比为30∶1 mL/g,乙醇浓度60%,超声温度为60 ℃,考察超声时间在10、20、30、40、50 min条件下黄酮类化合物的得率。固定液料比为30∶1 mL/g,乙醇浓度60%,超声时间为20 min,考察超声温度在30、40、50、60、70 ℃条件下黄酮类化合物的得率。
1.2.4 响应面试验设计 以单因素实验结果为基础,按照Box-Behnken设计试验[12],其因素与水平设计见表1。
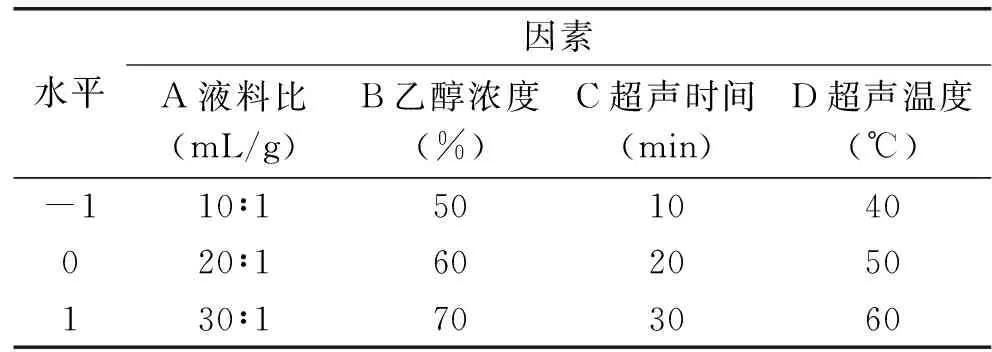
表1 响应面优化试验因素水平表Table 1 Levels and factors of the response surface experiment
1.2.5 藜麦糠黄酮类化合物抗氧化实验
1.2.5.1 清除DPPH自由基的测定方法 按照由响应面实验得出的最佳提取方案提取黄酮类化合物,并将其稀释处理。得到0.1、0.2、0.3、0.4、0.5、0.6 mg/mL的黄酮提取液,以同浓度的VC作为对照进行实验[12]。取1.0 mL不同质量浓度的黄酮提取液于试管中,分别加入0.052 mg/mL DPPH溶液1.0 mL,摇匀后将其在避光条件下放置30 min得到Ax,设置空白对照为2.0 mL乙醇、对照组A0为1.0 mL DPPH与1.0 mL乙醇混合液记为[13]。反应充分后于517 nm处测定并记录其吸光度值,按照公式(2)计算DPPH的清除率。
式(2)
1.2.5.2 清除羟自由基(·OH)的测定方法 配制9 mmol/L FeSO4溶液、9 mmol/L水杨酸-乙醇溶液备用与8.8 mmol/L H2O2溶液。配制0.1、0.2、0.3、0.4、0.5、0.6 mg/mL的黄酮提取液,以同浓度的VC作为对照进行实验。取各质量浓度的黄酮类化合物提取液1.0 mL于试管中,向各试管中分别依次加入1.0 mL已配制好的FeSO4、1.0 mL的水杨酸-乙醇溶液。再依次在试管中加入1.0 mL已配制的H2O2,将加好药品的试管置于水浴锅中设置温度为37 ℃,30 min后于510 nm波长处得到样品组吸光度Ax。将样品组的H2O2用蒸馏水代替其他步骤同上得到对照组吸光度Ay。A0记为用蒸馏水代替样品得到对照组吸光度[14],按公式(3)计算清除率。
式(3)
1.2.6 数据处理 采用Design-Expert V8.0.6软件进行实验数据分析。
2 结果与分析
2.1 单因素实验
2.1.1 液料比对黄酮类化合物得率的影响 由图1可知,当液料比低于20∶1 mL/g时得率随着液料比的增大逐渐上升,20∶1 mL/g时达到最大0.887%,随后得率反而逐渐降低。推测原因可能是在液料比小于20∶1 mL/g时,由于溶剂的增加增大了提取液乙醇与提取物藜麦糠的接触面积,使溶出的黄酮类化合物量增大;液料比20∶1~30∶1 mL/g之间黄酮得率趋于平缓,虽减小但并不明显,黄酮类化合物的溶出逐渐趋于动态平衡[14],在液料比大于20∶1 mL/g后得率下降是由于其它杂质的溶出对黄酮化合物产生拮抗作用。可见,当液料比为20∶1 mL/g时,藜麦糠中黄酮类化合物的得率相对较高。
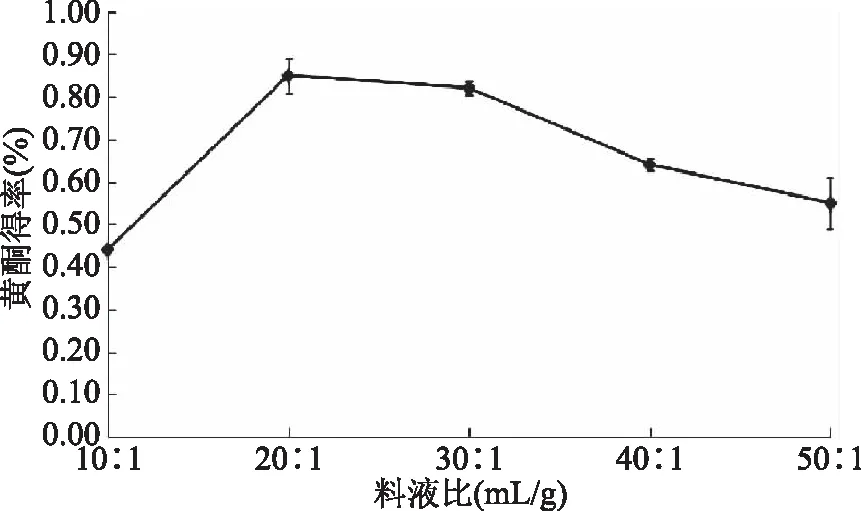
图1 液料比对黄酮得率的影响Fig.1 Effect of liquid/solid ratio on flavonoid yield
2.1.2 乙醇浓度对黄酮类化合物得率的影响 由图2可知,乙醇浓度在50%~60%黄酮得率为先上升趋势,体积分数为60%达得率最大0.884%,在乙醇浓度大于60%时,黄酮得率逐渐降低,当乙醇浓度为90%时,其得率为实验范围内最低。根据相似相溶原理,推测黄酮类化合物的极性与60%乙醇溶液最为接近,并且在乙醇浓度为60%时,黄酮类物质溶出趋于饱和。当体积分数继续增大时,由于其他醇溶性的杂质等的析出[15],由此可知,当乙醇浓度为60%时,藜麦糠中黄酮类化合物的得率较高。
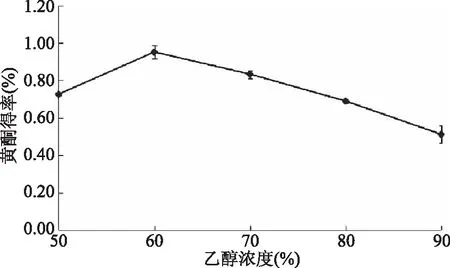
图2 乙醇浓度对黄酮得率的影响Fig.2 Effects of ethanol concentration on flavonoid yield
2.1.3 超声时间对黄酮类化合物得率的影响 由图3可知,在超声时间为10~30 min时,黄酮得率呈先升高而后略微降低的趋势,在超声时间为30 min之后黄酮得率基本保持不变。在超声时间为20 min时得率达最大值0.74%,在20 min以后得率略微减小且均在0.6%左右。在超声时间20 min之内,由于时间的延长,物料与乙醇溶液逐渐充分接触,使物料中黄酮类化合物能充分地溶出。当时间延长至20 min后,有可能使溶出的黄酮类物质发生降解或也伴随其他杂质的溶出[15],故得出最适超声时间为20 min。
2.1.4 超声温度对得率的影响 由图4可知,超声温度较低于40 ℃时提取较为困难得率较低,低于0.5%;随着提取温度的升高,得率也逐渐增加,在超声温度高达50 ℃时得率达到最大值0.889%,之后继续升高温度得率反而降低,在70 ℃时,得率降至 0.5%左右。经分析此变化产生的原因可能是,在温度在低于50 ℃时随着温度的升高,物料内分子运动速率逐渐增加,使黄酮类化合物更容易溶出[15]。但在50 ℃以上,高温使提取液中其他杂质成分与黄酮类化合物发生化学反应出现絮状沉淀,导致有效成分减少[16],且温度高于60 ℃时溶剂挥发量增加导致得率降低,故得出超声温度50 ℃为最适温度。
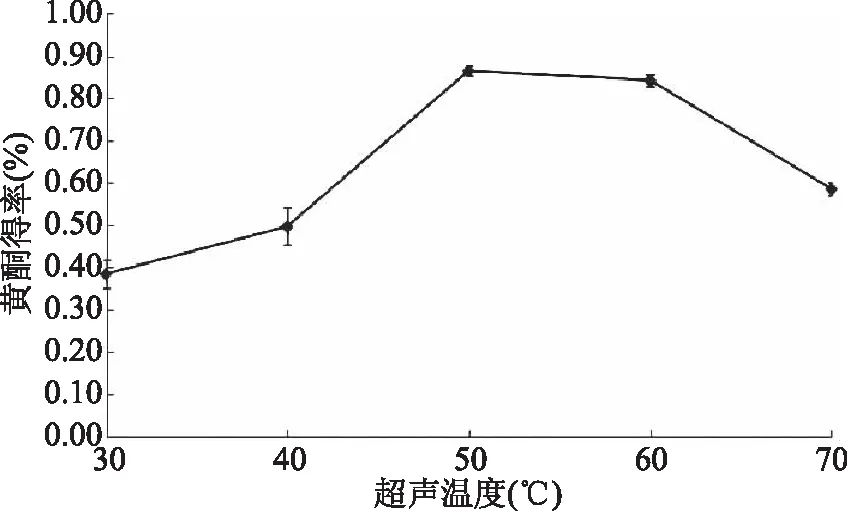
图4 超声温度对黄酮得率的影响Fig.4 Effects of extraction temperature on flavonoid yield
2.2 响应面分析及藜麦糠黄酮类化合物工艺优化
利用Design-Expert V8.0.6软件的Box-Behnken设计,以液料比、乙醇浓度、超声时间、超声温度为响应变量,黄酮得率为响应值,进行响应面实验,结果如表2所示。
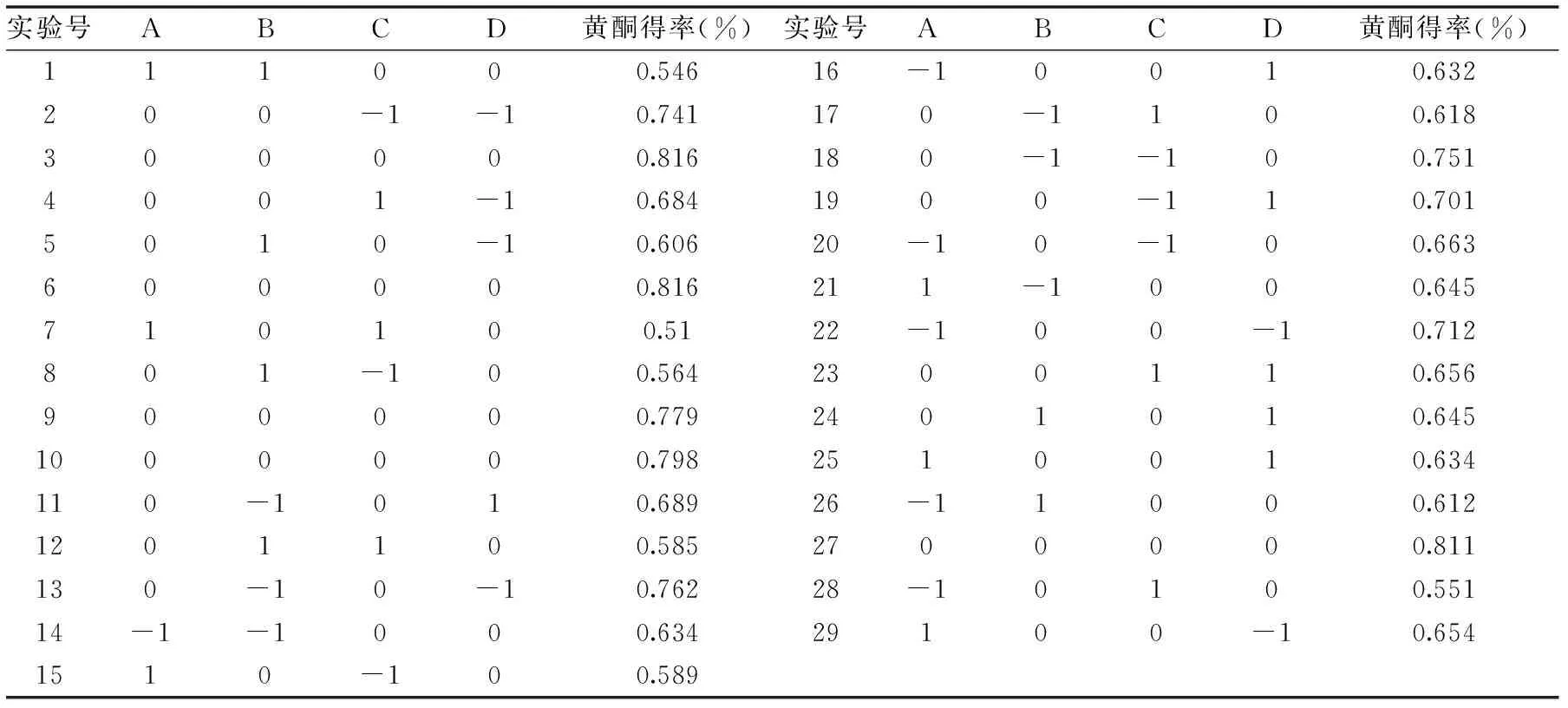
表2 Box-Behnken方案及结果Table 2 Box-Behnken test design and results
2.2.1 模型建立和显著性分析 由表3可知,得到回归方程为:
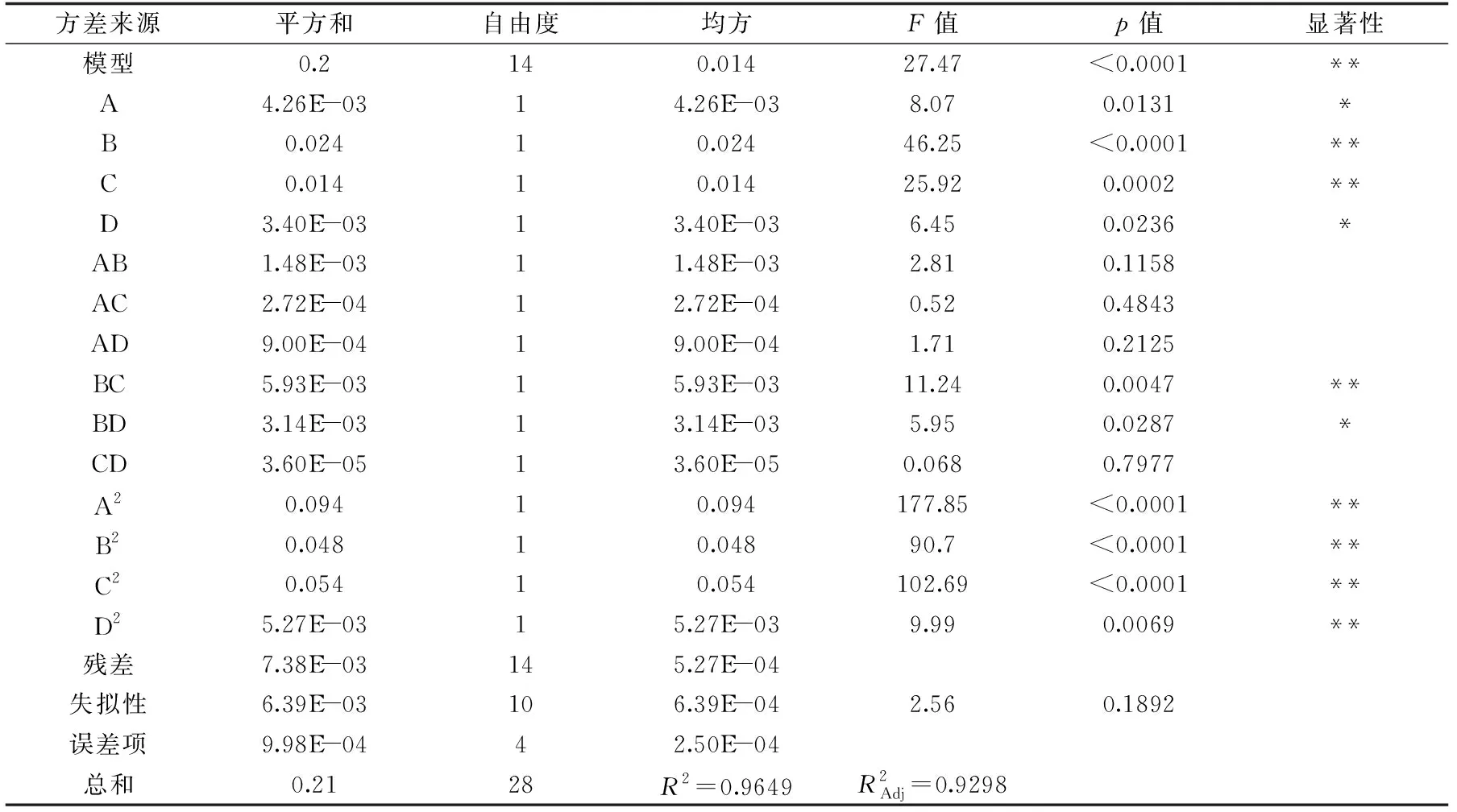
表3 回归模型的方差分析Table 3 Variance analysis for the regression equation
Y=0.80-0.019A-0.045B-0.034C-0.017D-0.019AB+0.00825AC+0.015AD+0.039BC+0.028BC+0.003CD-0.12A2-0.086B2-0.091C2-0.029D2
由表3与回归方程分析可知,p<0.001,则显示模型为极显著,此模型中失拟性不显著,表示此模型设计预测值能与实际值相近,有良好的线性关系,根据此模型不仅可以得到藜麦糠黄酮类化合物提取的最优工艺,并且可以真实的反映藜麦糠中的黄酮类化合物含量。由表3可知,从F值可以看出:对于本实验黄酮类化合物的提取影响因素排序为:B乙醇浓度>C超声温度>A液料比>D超声时间。实验因素中,一次项:A、D,交互项BD对实验结果有着显著影响,而一次项:B、C,交互项BC及各二次项均对实验结果为极显著的影响,而其余项对实验指标影响不显著[17-18]。
2.2.2 响应面交互作用分析 根据表2设计,经过Densign-Eexpert 8.0分析得知,固定一个因素为0水平,分析另外两个因素的交互作用对藜麦糠黄酮类化合物得率的影响,两因素交互作用的影响如图5所示。
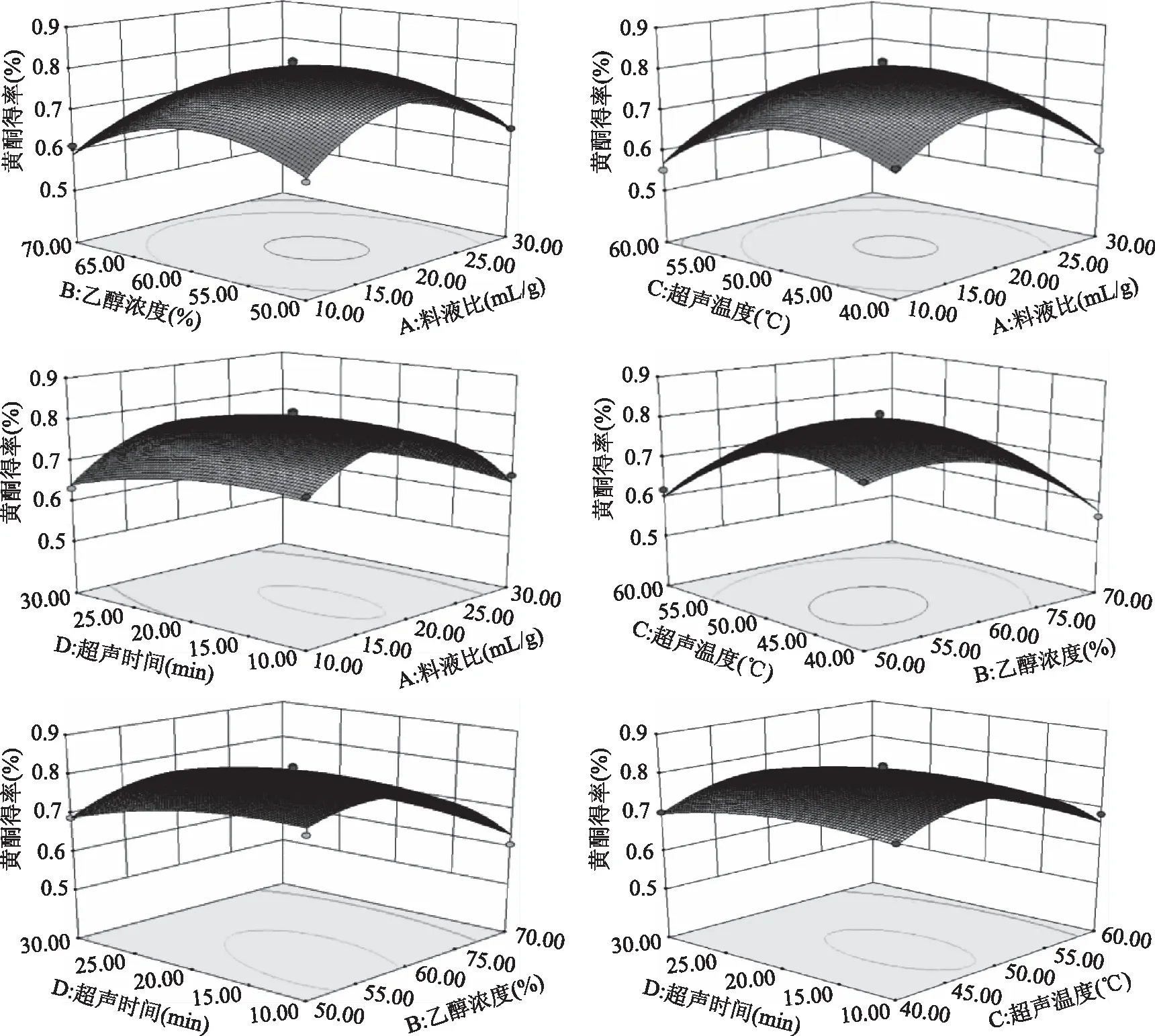
图5 各因素交互作用对黄酮类化合物得率的影响Fig.5 Response surface graphs showing the effect of extraction conditions on the yield of flavonoid
在其他实验因素固定不变的情况下,考察交互项对得率的影响,响应面分析图可用于评价实验因素对黄酮得率影响的交互作用。在两因素交互作用3D图中,图形的坡度越陡,表明响应指标对响应因素的变化越敏感[19-20]。在交互相对得率的影响中,乙醇浓度与超声温度和乙醇浓度与超声时间之间交互作用明显,而其他因素两两交互作用对得率影响并不明显,这与方差分析结果一致。
由Design-Expert分析,藜麦糠黄酮类化合物提取的最优提取工艺为乙醇浓度为56%,液料比为20∶1 mL/g,超声时间为14 min,超声温度为58 ℃,预测得率为0.821%。按照上述工艺条件,进行三次重复实验,实际得率为0.802%±0.012%。故此条件具有可靠性和可操作性。
2.3 抗氧化性实验结果与分析
2.3.1 藜麦糠黄酮类化合物提取物的DPPH清除能力 由图6可知,VC溶液的DPPH清除能力随着其浓度变化在浓度0.1~0.2 mg/mL之间清除率变化最小,在0.2~0.3 mg/mL时清除率变化最大。黄酮提取液于0.1~0.3 mg/mL时,其清除率呈线性增加。提取液浓度范围在0.3~0.4 mg/mL时,其清除率增加显著,而在0.4 mg/mL后,其DPPH清除率增加较为缓慢[21]。但黄酮类化合物提取液的清除能力始终弱于VC,在质量浓度较低小于0.2 mg/mL时,两者DPPH清除能力均较弱且相差不大,在本实验中VC质量浓度在0.5 mg/mL时清除率达89%,同浓度黄酮类化合物提取液的DPPH清除率达64%左右,表明藜麦糠黄酮类化合物提取液有良好的自由基清除能力。
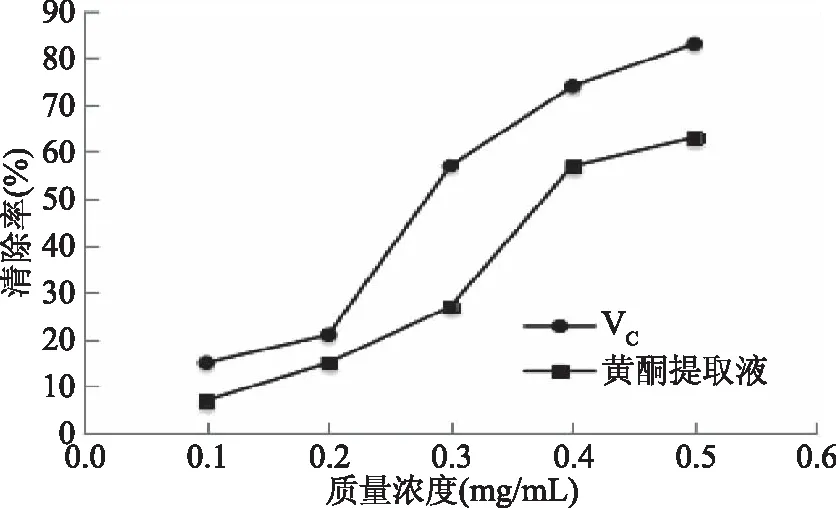
图6 藜麦糠黄酮类化合物提取物的DPPH清除能力Fig.6 DPPH free radical scavenging capacity of flavonoid from Chenopodium quinoa bran
2.3.2 藜麦糠黄酮类化合物提取物的羟自由基(·OH)清除能力 由图7可知,黄酮提取液的羟自由基清除能力与其质量浓度成正比[22],在二者质量浓度小于0.3 mg/mL时黄酮类化合物提取液清除率远低于VC。当二者质量浓度高于0.3 mg/mL后,二者清除率能力相差不大,在0.3 mg/mL时二者清除率最为接近。黄酮类化合物提取物质量浓度为0.5 mg/mL时的羟自由基清除率达77%,在此浓度下其清除羟自由基能力与VC相差不大。但总体来说,样液羟自由基清除能力的趋势与VC大致相似。
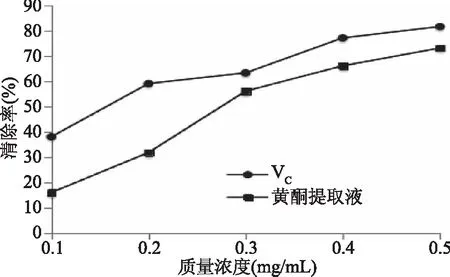
图7 藜麦糠黄酮类化合物提取物的羟自由基(·OH)清除能力Fig.7 Hydroxyl free radical scavenging capacity of flavonoid from Chenopodium quinoa bran
3 结论
以藜麦糠为原料,借助超声波辅助提取藜麦糠黄酮类化合物,通过响应面优化提取工艺,并对其提取物进行抗氧化实验分析。实验得出最佳的提取条件为:乙醇浓度56%,液料比20∶1 mL/g,超声时间14 min,超声温度58 ℃,在此条件下黄酮的得率为0.802%±0.012%。按响应面设计最佳提取条件,进行三次重复实验实际得率为0.802%,与预测值大致相符。此外,进行了藜麦糠黄酮类化合物的抗氧化性实验测定。表明,藜麦糠黄酮作为一种天然的抗氧化剂,具有与VC相当的清除羟自由基清除能力和较强的DPPH清除能力。此实验为藜麦糠中生物活性物质的开发提供了重要依据。
