刺梨白粉病拮抗菌的筛选及其抑菌机制初探
2018-12-10,,*,,,
, ,*,, ,
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳 550025; 2.贵州大学酿酒与食品工程学院,贵州贵阳 550025; 3.贵州理工学院制药工程学院,贵州贵阳 550003)
刺梨(RosaroxburghiiTratt)属于蔷薇科蔷薇属,多年生灌木落叶缫丝花的果实,富含丰富的纤维素、黄酮、维C和多酚类物质[1],是贵州一种集聚品质和观赏价值的区域特色药食两用新资源植物。刺梨在贵州很多地区均有种植,如六盘水、毕节,安顺、织金等,随着刺梨成分研究的深入,越来越多的刺梨产品出现,如刺梨干、刺梨饮料、刺梨酒以及刺梨饼干等[2],刺梨的需求也越来越大。白粉病(Sphaerothecapannosa)作为刺梨的一种常见真菌性病害[3],病菌可浸染所有的绿色组织,病变组织呈灰白色斑块,导致果实果粒不膨大或者萎缩,是影响产量的重要病害之一。其在瓜类、葡萄、小麦、玫瑰等很多植株生长过程均能侵染植株[4]。病原菌一般以孢子的形态潜伏于土壤和残枝废叶中,在每年的4 月上、中旬开始病发,到6月白粉病发生较重,7月以后随着叶片的老化,病情逐渐下降,影响刺梨的生长、开花和结果整个阶段[5]。
目前,刺梨白粉病的防治措施主要是喷洒15%粉绣宁(三锉酮),化学名称是1-(4-氯苯氧基)-3,3-二甲基-1-(1H,1,2,4-三唑-1-基)-2-丁酮,其对由真菌引起的病害有一定的治疗作用。研究发现,粉绣宁药效持续时间长,需要控制采收季节喷洒;其次施药后会抑制茎芽叶的生长、叶片变小、植株生长缓慢甚至停止生长;此外,对皮肤和眼睛有刺激性,对人畜有低毒[6]。随着三锉酮的长期使用,极大可能会使得刺梨产生抗病性,因此生物防治应用的需要也迫在眉睫。生物防治是利用生物物种间的关系,以一种生物抑制另一种生物,具有高效、环保、安全等特点。作为生物防治剂的微生物叫拮抗菌,拮抗菌的筛选是研究生物防治的关键,其主要来源于土壤和植株表面,能抑病原菌生长繁殖且不会对植物生长和发育造成影响,Prashar等[7]报道生防菌对植株生长和功能不仅不会造成影响,还能抑病原菌生长繁殖。拮抗菌用于植物病害防治已得到大量的研究证实,很多新成果在不断的涌现。Lin Li等[8]研究发现苏云金芽孢杆菌生物农药在我国得到了规模生产应用;祝学海等[9]从半夏根际土壤筛选对半夏块茎腐烂病病原菌有拮抗活性的细菌;Xu S J等[10]发现芽孢杆菌对番茄灰霉病具有生物防治作用等。生物防治在植物病害防治上的应用越来越广,关于刺梨白粉病的生物防治方法鲜少,有待进一步开展实验。
试验拟从健康刺梨枝叶及其根系土壤分离筛选对刺梨白粉病病原菌有防治效果的拮抗菌;通过形态学、生理生化鉴定以及分子生物学鉴定刺梨白粉病拮抗菌;通过叶盘实验检测不同浓度拮抗菌溶液的对刺梨白粉病的防治效果并绘制拮抗菌生长曲线观察生长趋势;研究拮抗菌对白粉病菌丝及其孢子萌发的影响,同时探究拮抗菌代谢抗性相关酶的情况,为刺梨白粉病的生物防治提供新的菌种资源和理论依据,以及为进一步生物防治应用奠定基础。
1 材料及方法
1.1 材料与仪器
无籽金刺梨植株 贵州毕节刺梨种植基地;刺梨白粉病病原菌(Sphaerothecapannosa) 贵州大学酿酒与食品工程学院发酵工程与生物制药重点实验室分离保藏;牛肉膏蛋白胨固体培养基(NA)、牛肉膏蛋白胨液体培养基(NB)、苯并咪唑培养基(50 mg苯并咪唑,5 g琼脂,1 L蒸馏水溶解)、酪蛋白培养基、纤维素刚果红培养基、果胶培养基、几丁质培养基 上海博威生物科技有限公司;苯并咪唑,琼脂,无水乙醇,磷酸二氢钠,磷酸氢二钠,戊二醛 上海博威科技有限公司;实验所用试剂 均为分析纯;天根细菌DNA提取试剂盒 天根生化科技(北京)有限公司;PCR聚合酶 宝生物工程(大连)有限公司。
TOMY高压蒸汽灭菌锅 日本TOMY;SPX-250B-Z型生化培养箱 上海博讯实业有限公司医疗设备厂;电热恒温培养箱 上海跃进医疗器械厂;SwCJ-lF型超净工作台 上海博讯实业有限公司医疗设备厂;恒温培养摇床 上海诺晶生物科技有限公司;CK31型倒置显微镜 奥林巴斯(中国)有限公司;S-3400N扫描电子显微镜 HITACHI(日立)公司;721型可见分光光度计 上海精密仪器仪表有限公司;FA1004N型电子天平 上海精密仪器仪表有限公司;2720型PCR仪 美国 ABI 公司;RJ-TGL-16G离心机 北京瑞邦兴业科技有限公司;DHG-9015A电热恒温鼓风干燥箱 上海圣科仪器设备有限公司;1-4/LDC-1M冷冻干燥仪 博励行仪器有限公司。
1.2 实验方法
1.2.1 拮抗菌的筛选
1.2.1.1 刺梨白粉病菌的培养 春天种植半年生刺梨苗盆栽若干,三株刺梨苗用于白粉病菌的培养,孢子抖落接种于刺梨苗,于20 ℃左右培养5~7 d至叶片表面长出病斑,取孢子配制单位为105个/mL悬液备用,用于下文的叶盘实验。
1.2.1.2 拮抗菌的分离纯化 取健康植株的枝叶1 g剪碎,用无菌水冲洗3~4次,浸泡于50 mL无菌水中25 ℃摇床2 h,同时取1 g根系土壤研磨,加50 mL无菌水25 ℃摇床2 h;取上清液分别稀释10-1、10-2、10-3倍并涂布培养于NA固体培养基上37 ℃培养12 h,挑取形态不同的菌落划线培养至单菌落,纯化保藏备用。
1.2.1.3 拮抗菌发酵液的制备 分离纯化的形态不同的细菌液体培养,分别配制成108CFU/mL的种子液,分别取5 mL的种子液接种于100 mL的NB培养基中,37 ℃摇床培养24 h后得到发酵液。
1.2.1.4 筛选 采用叶盘实验进行筛选[11],剪取1.2.1.1盆栽健康刺梨的叶片无菌水冲洗,于无菌操作台上用直径10 mm的打孔器制成叶盘,浸泡于1.2.1.3得到的不同细菌发酵液中12 h后,取出正面朝上贴于苯并咪唑培养基上,每个培养基贴6片,并喷洒1.2.1.1所得的10 mL孢子悬浮液,置于光照培养箱28 ℃培养5~6 d后肉眼观察病斑;空白对照组的叶片无需细菌发酵液的浸泡。通过病级指数筛选拮抗菌,病级指数表示叶盘实验中病斑面积,分级标准:0级未感染病菌;1级(+)病斑面积占5%以下;2级(++)病斑面积占5%~25%;3级(+++)病斑面积占25%~50%;4级(++++)病斑面积占50%以上。
1.2.1.5 不同浓度拮抗菌的抑制效果 将筛选得到的拮抗菌制备成不同菌悬液浓度108、106、104CFU/mL的发酵液,进行叶盘实验,通过计算病情指数和防治效果分析不同浓度拮抗菌的抑制效果[12]。
病情指数(%)=[∑(病级指数×代表数值)]/(总株数×发病最重级的代表指数)×100
防治效果(%)=(对照病级指数-处理病级指数)/对照病级指数×100
1.2.2 拮抗菌的鉴定
1.2.2.1 形态学鉴定 拮抗菌培养于NA培养基上37 ℃培养24 h后观察单菌落外观形态;显微镜进一步观察微观形态特征;扫描电镜进一步观察形态特征[13]。
1.2.2.2 生理生化鉴定 参照文献[14]选取氧化酶、过氧化氢酶、Kovacs吲哚、M-R、V-P、苯丙氨酸脱氨酶、明胶液化、硫化氢等9项生理生化指标,采用细菌微量生化鉴定管进行鉴定。
1.2.2.3 拮抗菌 液体培养筛选得到的拮抗菌,16S rRNA序列分析拮抗菌培养液,收集菌体提取DNA,采用16S rRNA通用引物27F(5′-AGAGTTTGAT CCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTT ACGACTT-3′)进行扩增,PCR特异性产物送天霖生物科技有限公司测序,得到目的片段的碱基序列,根据NCBI获得的BLAST结果,结合系统发育树进行同源性分析。
1.2.2.4 拮抗菌JK-6和JK-32的生长曲线绘制 参照文献[15]的方法进行,取JK-6和JK-32的种子液,按5%接种量接种于500 mL的NB液体培养基三角瓶中,混匀后平均分装试管50支试管中,先取两支试管中的菌液测OD600的吸光度为零,其余标记好置于37 ℃摇床中140 r/min振荡培养,之后每1 h取两支试管的菌液测OD600值。记录数据绘制生长曲线。
1.2.3 拮抗菌的抑菌机制初探
1.2.3.1 拮抗菌对白粉病孢子萌发率的影响 配制2%的琼脂溶液,拮抗菌发酵液稀释菌浓度为108、107、106、105CFU/mL,分别取10 mL的发酵液、10 mL琼脂溶液和1 mL白粉病菌孢子悬浮液混合,将混合液分别滴加与载玻片中央制成圆形培养基编号,空白对照组用10 mL的蒸馏水、10 mL琼脂溶液和1 mL孢子悬浮液混合滴加到载玻片中央制备培养基。28 ℃下光照培养,分别于24 h显微镜观察孢子萌发情况(孢子芽管大于孢子短半径的视为萌发)、测量芽管长度,观察的孢子数不小于100个,实验重复3次,计算萌发率:
萌发率(%)=(对照孢子萌发率-处理孢子萌发率)/对照孢子萌发率×100
1.2.3.2 拮抗菌对白粉病菌丝的影响 剪取健康盆栽刺梨大小相似的叶片,分别浸泡于拮抗菌发酵液中,12 h后取出正面朝上贴于苯并咪唑培养基上,每个培养基贴2片,并喷洒10 mL孢子悬浮液,置于光照培养箱28 ℃培养12~24 h后,挑取单病斑菌丝与显微镜下观察菌丝形态变化,空白对照组的叶片无需浸泡发酵液。
1.2.3.3 拮抗菌产酶情况的探究 参照关小敏等[16]。蛋白酶定性检测:蛋白酶通过酪蛋白培养基平板检测,在固体培养基上放置直径为5 mm的滤纸片,取10 μL的1.2.1.3得到的拮抗菌发酵液滴到滤纸片上,分别做三个平行,置于培养箱37 ℃培养24 h观察是否有透明圈。
纤维素酶定性检测:纤维素酶通过纤维素刚果红培养基检测,在不加刚果红的纤维素固体培养基上放置5 mm的滤纸片,取10 μL的拮抗菌发酵液滴到滤纸片上,分别做三个平行,置于培养箱37 ℃培养24 h后,用1%刚果红溶液染色30 min,再用1% NaCl脱色,观察是否有透明圈。
果胶酶定性检测:果胶酶通过果胶培养基检测,在固体培养基上放置直径为5 mm的滤纸片,取10 μL的拮抗菌发酵液滴到滤纸片上,分别做三个平行,置于培养箱37 ℃培养24 h观察是否有透明圈。
几丁质酶定性检测:几丁质酶通过几丁质培养基检测,在固体培养基上放置直径为5 mm的滤纸片,取10 μL的拮抗菌发酵液滴到滤纸片上,分别做三个平行,置于培养箱37 ℃培养24 h观察是否有透明圈。
1.3 数据处理
实验中每个处理重复三次,采用SPSS 17.0软件进行数据的显著性分析,应用Origin 8.5和MEGA5制作图表。
2 结果与分析
2.1 拮抗菌的筛选结果
经过对健康刺梨枝叶及其根系土壤分离共得到48株细菌,初筛结果(表1)表明,对比空白对照有21株细菌的病级指数小于5级,其中JK-6和JK-32具有较好的拮抗效果。为了考察不同浓度拮抗菌的防治效果,使用不同浓度菌液进行叶盘实验,结果如表2,拮抗菌JK-6和JK-32的不同浓度发酵液对叶盘的病情指数以及防治效果有差异。对比空白对照83%的病情指数,JK-6和JK-32溶液浓度为108CFU/mL时病情指数低至32%和35%,显著低于空白对照组(p<0.05),防治效果也达到了60%和57%。
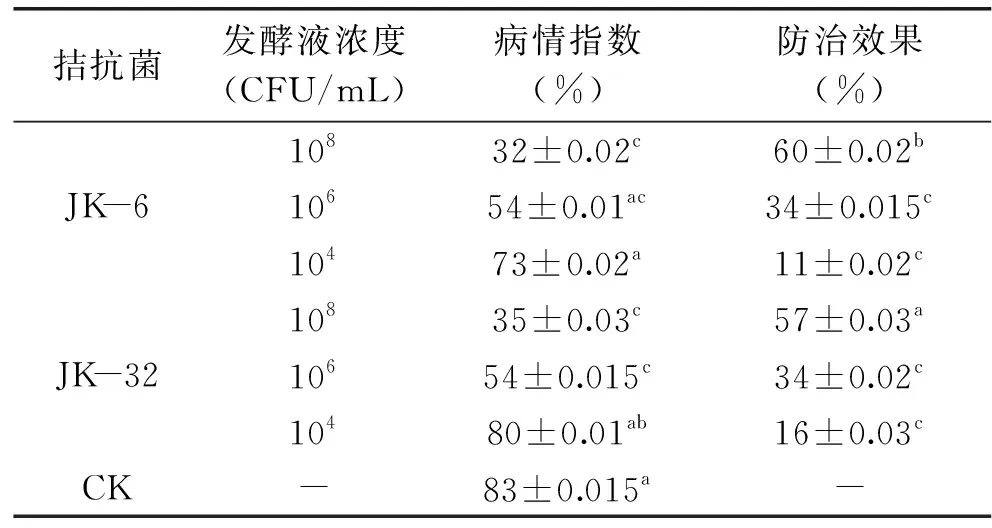
表2 不同溶液浓度拮抗菌发酵液对刺梨白粉病叶盘防治效果Table 2 Antagonistic bacteria fermentation at different dilutions on Cili powdery mildew leaf disc prevention and treatment
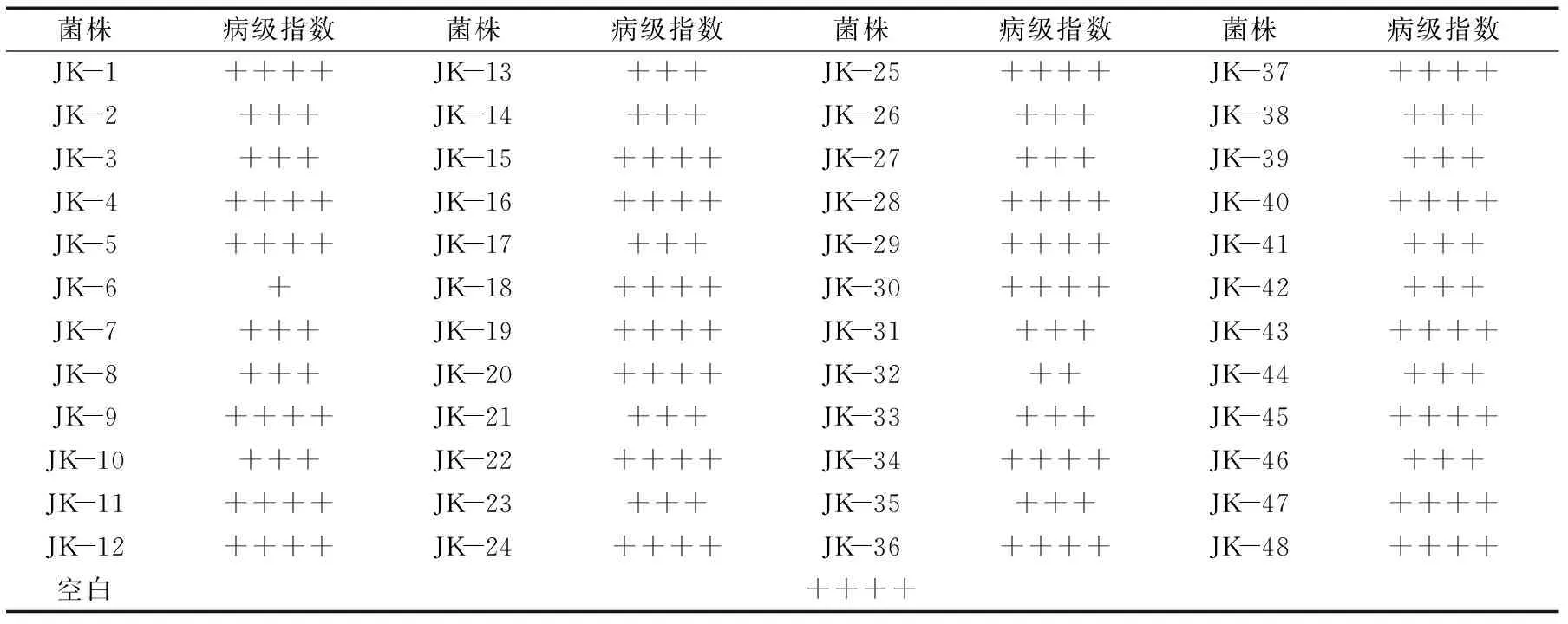
表1 不同细菌对刺梨白粉病的病级指数Table 1 Infected index of bacterine powdery mildew by different bacteria
2.2 拮抗菌的鉴定结果
2.2.1 形态学鉴定 由图1可知,菌落呈圆形隆起、乳白色、不透明、表面有皱褶且干燥、粘稠厚重、菌体呈椭圆杆状,大小为长径1.3~1.5 μm、短径600~800 nm,需氧型革兰氏染色阳性菌;JK-32在LB平板上37 ℃培养24 h后,菌落呈圆形无隆起且菌落湿润、有皱褶、不透明、奶白色、菌体呈杆状,长径2.1~2.3 μm、短径为750~760 nm。
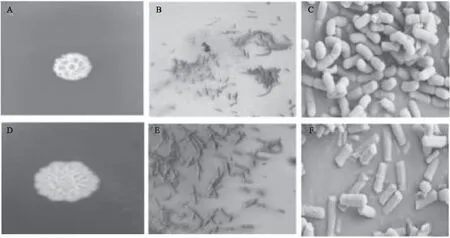
图1 拮抗菌JK-6和JK-32的形态学图Fig.1 Morphology of antagonistic bacteria JK-6 and JK-32注:A:JK-6的单菌落;B:JK-6显微镜图(40×);C:JK-6的电镜图;D:JK-32的单菌落;E:JK-32显微镜图(40×);F:JK-32的电镜图。
2.2.2 生理生化鉴定 JK-6和JK-32的主要生理生化特征见表3,根据JK-6和JK-32的菌落形态和生理生化特征,参照《细菌鉴定手册》可以初步推断为芽孢杆菌属,具体判断需要进一步进行16S rDNA序列测定。
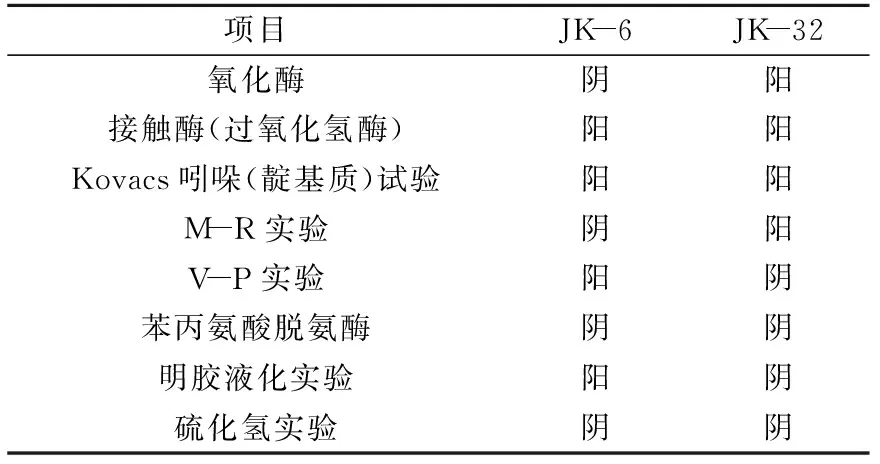
表3 JK-6与JK-32的各项生理生化检查结果Table 3 Results of physiological and biochemical tests ofJK-6 and JK-32
2.2.3 拮抗菌16S rRNA 序列分析 提取两株拮抗菌的基因组,分别进行16S rRNA序列扩增[17],目的片段约1400 bp[18]。JK-6和JK-32经PCR扩增均得到单一条带(图2),PCR产物进行测序。将测序结果与NCBI(https://blast.ncbi.nlm.nih.gov)数据库进行同源性比对。比对结果显示JK-6的序列与解淀粉芽孢杆菌(Bacillusamyloliquefaciens/GenBank登录号:MPA 1034)菌株的16S rRNA基因序列相似度高达99%。将JK-6的16S rRNA 序列在BLAST分析后结果进行系统发育树的构建,如图3所示,JK-6与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)处于最小分支,亲缘关系最近,结合形态学和生理生化特征,将JK-6鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。比对结果显示JK-32的序列与空气芽孢杆菌(Bacillusaerius/GenBank登录号:NR118439)的相识度到达了100%。将JK-32的16S rRNA序列在BLAST分析后结果进行系统发育树的构建,如图4所示,JK-32与Bacillusaerius处于最小分支,亲缘关系最近,结合形态学和生理生化特征,将JK-32鉴定为空气芽孢杆菌Bacillusaerius。
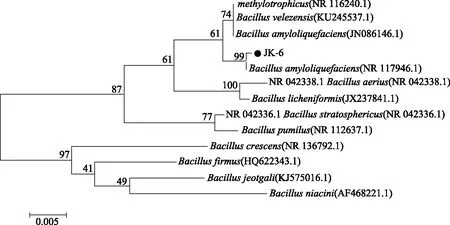
图3 JK-6基于16S rRNA 序列系统发育树Fig.3 JK-6 phylogenetic tree based on 16S rRNA sequence
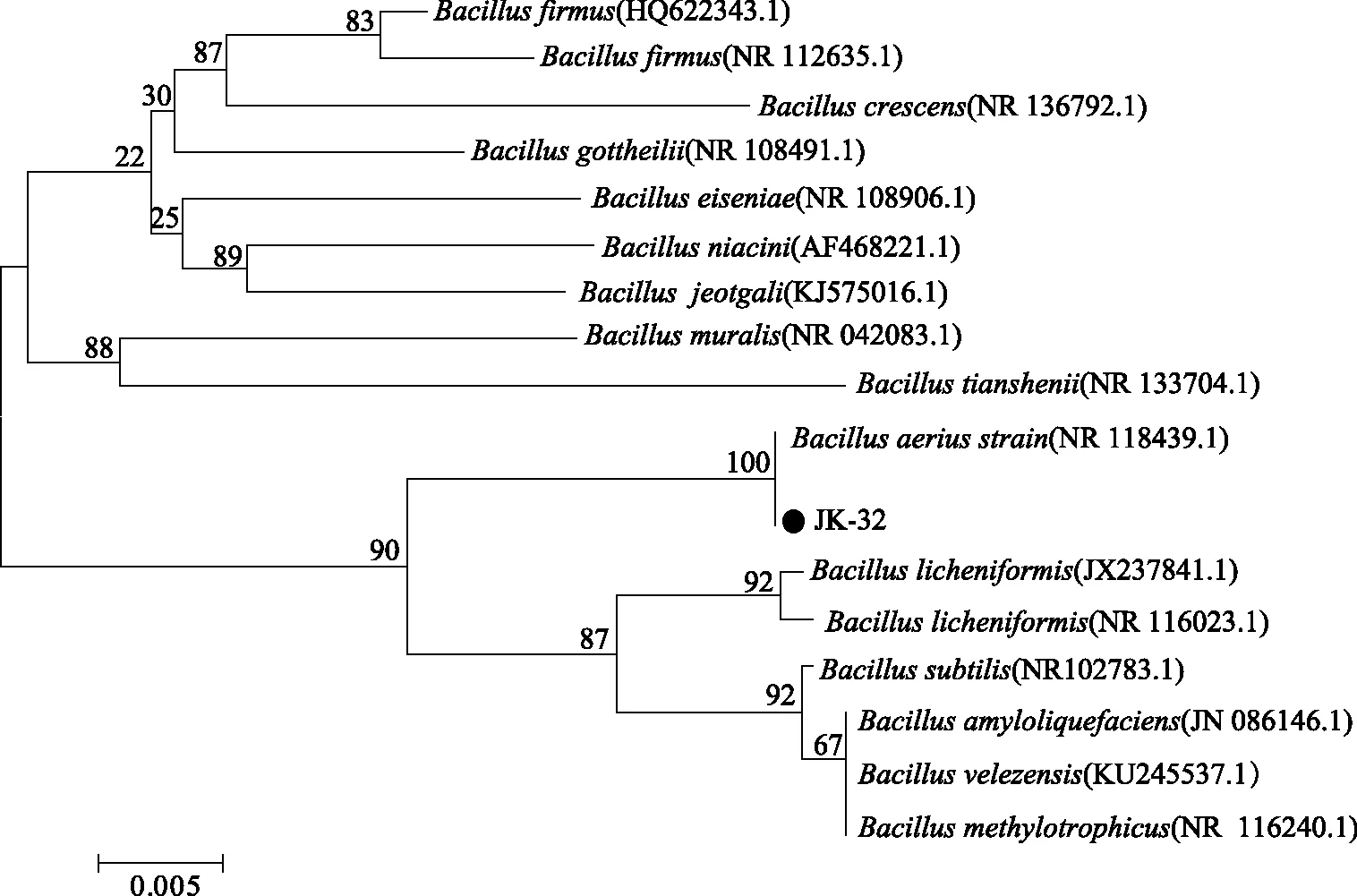
图4 JK-32基于16S rRNA序列系统发育树Fig.4 JK-32 phylogenetic tree based on 16S rRNA sequence
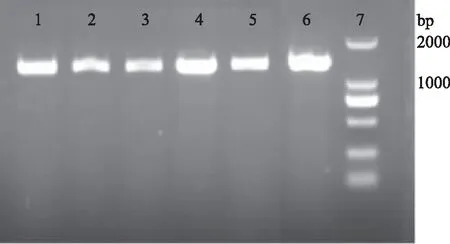
图2 JK-6和JK-32拮抗菌16S rRNA PCR产物核酸电泳图Fig.2 JK-6 and JK-32 antagonistic bacteria 16S rRNA PCR products注:1~3:JK-32;4~6:JK-6;7:DL2000。
2.2.4 JK-6与JK-32生长曲线的绘制结果 绘制JK-6和JK-32的生长曲线如图5所示,JK-6在0~5 h属于延滞期,5~17 h处在对数生长期,17~21 h属于稳定期,21 h以后进入衰亡期;JK-32在0~5 h属于延滞期,5~16 h处在对数生长期,16~20 h属于稳定期,20 h以后进入衰亡期。对比JK-6和JK-32的生长曲线,J两株菌的生长周期相似,但JK-6的生长能力较JK-32强。
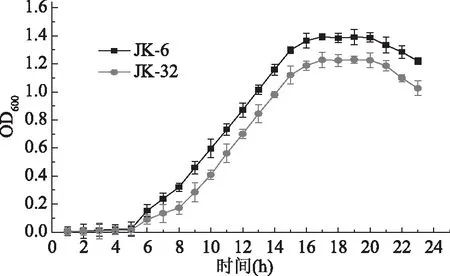
图5 拮抗菌JK-6和JK-32的生长曲线Fig.5 Antagonistic growth curve of bacteria JK-6 and JK-32
2.3 拮抗菌对白粉病菌孢子萌发率的影响
如表4所示,随时间的变化和拮抗菌发酵液浓度的不同,对白粉病的萌发抑制程度也不一样。结果表明,在12 h和24 h后,显微镜下的观察结果显示,拮抗菌JK-6和JK-32对刺梨白粉病的孢子萌发均有抑制作用。空白培养24 h后孢子的平均萌发率为85.0%,孢子芽管平均长度为64.3 μm;而在拮抗菌JK-6和JK-32浓度为108CFU/mL发酵液处理24 h后,孢子萌发率分别为20.1%和25.0%,芽管长度分别为11.0 μm和9.3 μm,显著低于空白对照组(p<0.05)。对比正常萌发孢子图片(图6),拮抗菌处理过的萌发孢子数量减少,其中JK-6抑制的作用更强。
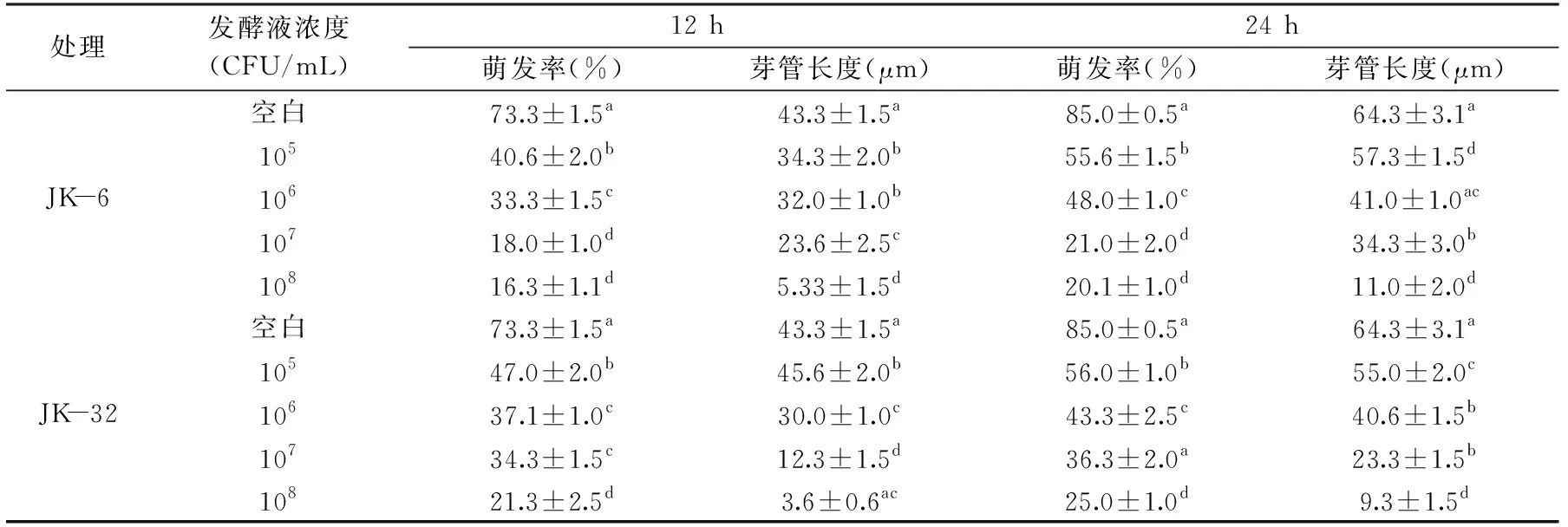
表4 不同浓度拮抗菌发酵液对刺梨白粉病孢子萌发的影响Table 4 Effects of fermentation solution with different concentration of antagonistic bacteria on spore germination of powdery mildew
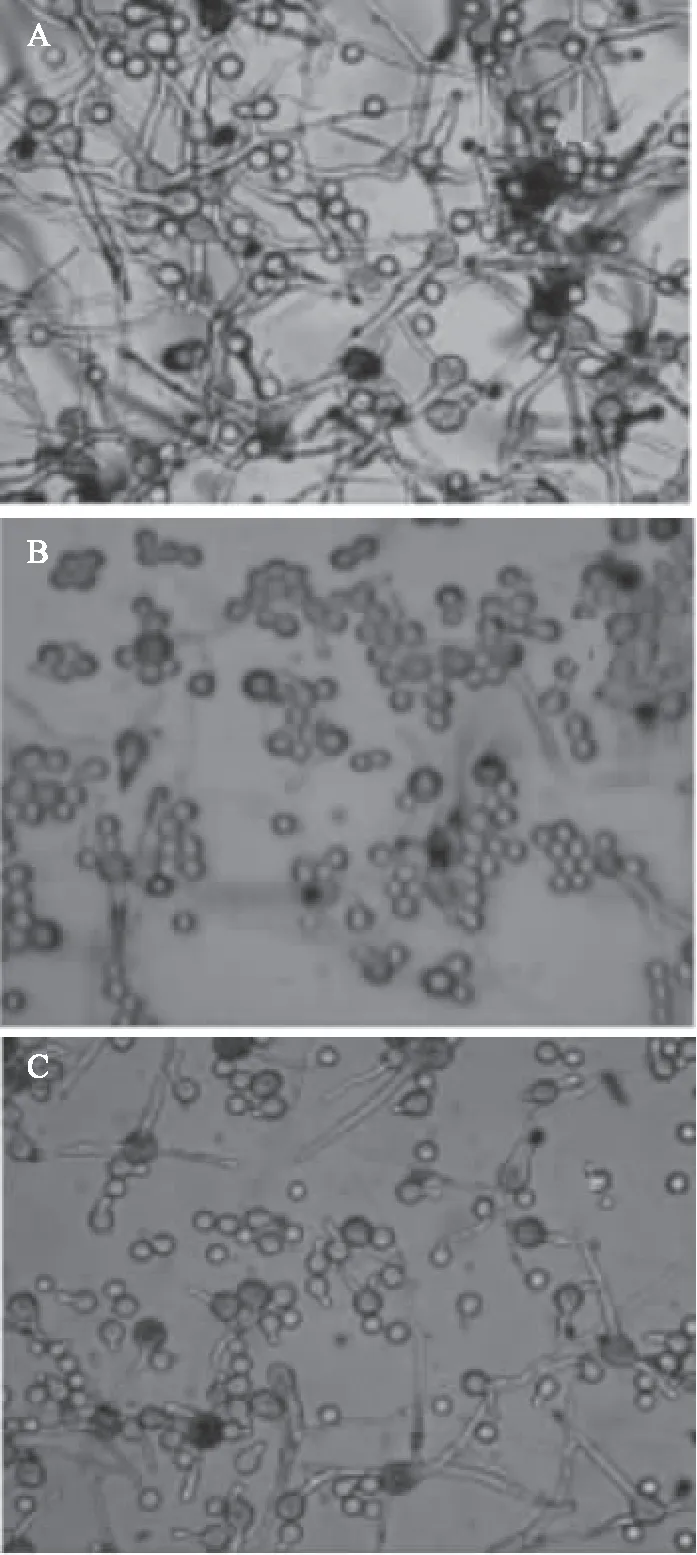
图6 拮抗菌JK-6和JK-32对白粉病孢子萌发抑制图Fig.6 Inhibition of spore germination of powdery mildew by antagonistic bacteria JK-6 and JK-32注:A:健康孢子24 h萌发图;B:浓度为108 CFU/mL的JK-6发酵液处理24 h孢子萌发图;C:浓度为108 CFU/mL的JK-32发酵液处理24 h孢子萌发图。
2.4 拮抗菌对白粉病菌菌丝的影响
使用显微镜观察被拮抗菌感染过的白粉病致病菌的菌丝结构,如图7所示,对比正常的菌丝,菌丝体在显微镜下都出现异常现象。图中A、D为健康菌丝,其中A是由一个单孢子萌发产生的菌丝体,菌丝健康且表面光滑、圆润;图B中菌丝在拮抗菌的作用下表面变的粗糙,图C中菌丝体异常膨大,图E中菌丝缠绕打结,图F中出现融断现象。这可能与拮抗菌在生长发育过程中代谢产生的酶或者抗菌类物质有关[24-28]。
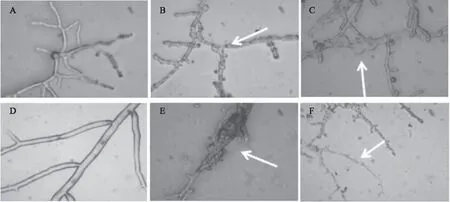
图7 拮抗菌对刺梨白粉病菌丝影响Fig.7 Antagonistic bacteria against powdery mildew mycelium注:A、D:健康菌丝;B、C、E、F:拮抗菌处理后发生畸变的菌丝。
2.5 拮抗菌的产酶情况探究结果
对拮抗菌JK-6和JK-32的四种抗性相关酶进行定性检测,结果如图8所示,拮抗菌JK-6和JK-32对酪蛋白、纤维素以及果胶有分解作用,且JK-6的能力较JK-32的强,JK-6和JK-32在几丁质培养基上没有显示透明圈,证明其未能产生相应的酶降解几丁质。
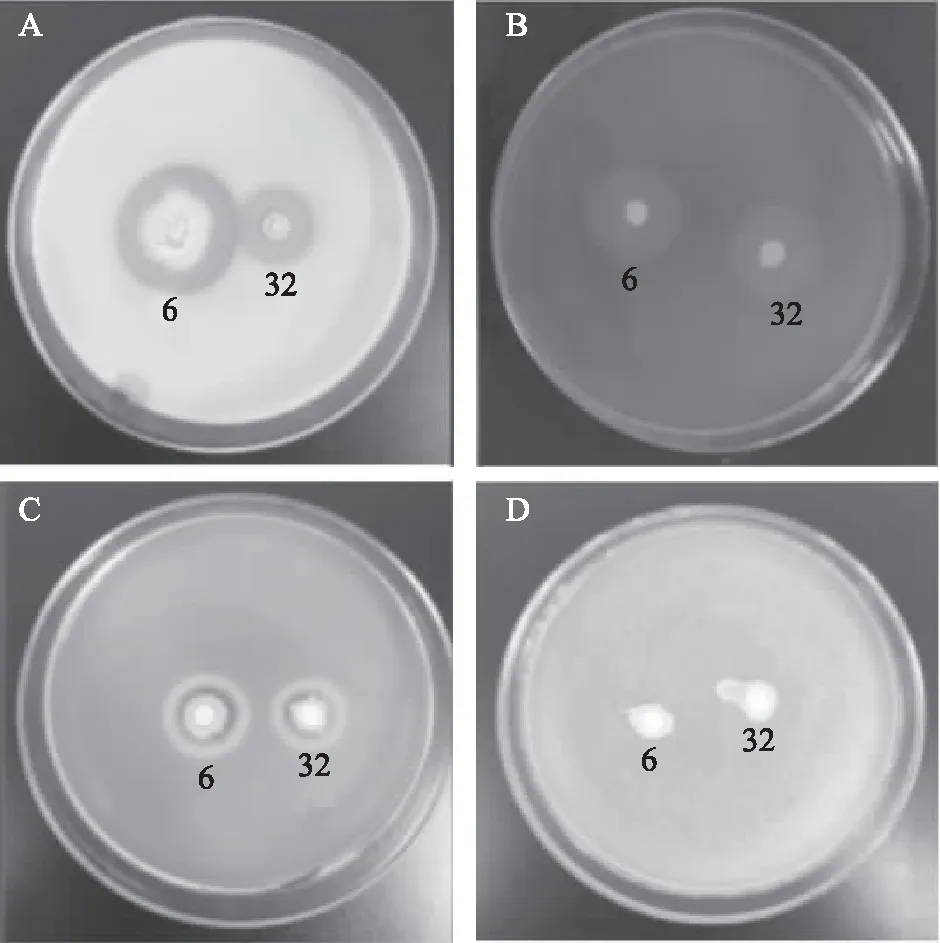
图8 拮抗菌JK-6和JK-32产酶情况Fig.8 Antagonistic bacteria JK-6 and JK-32 enzyme production situation注:A:蛋白酶抑菌圈;B:纤维素酶抑菌圈;C:果胶酶抑菌圈;D:几丁质培养基;6:拮抗菌JK-6;32:拮抗菌JK-32。
3 讨论
实验分离得到JK-6和JK-32两株拮抗菌,分别鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)和空气芽孢杆菌(Bacillusaerius)。拮抗菌JK-6和JK-32对刺梨白粉病病原菌的防病效果到了60%和57%,验证了JK-6和JK-32对刺梨白粉病病原菌有抑制作用,并进一步证明了拮抗菌JK-6和JK-32对病菌的孢子和菌丝均有抑制作用,同时证明了两株拮抗菌均能产生蛋白酶、纤维素酶、果胶酶。JK-6和JK-32都属于芽孢杆菌属,现有的研究表明,芽孢杆菌能够分泌多种抑菌物质,抑制病原菌的生长代谢[19]。
芽孢杆菌作为生物防治的主要细菌,对很多病菌具有拮抗作用,主要与其代谢产生的脂肽类物质、抗生素、挥发性物质以及水解酶类有关。Rahman等[20]发现芽孢杆菌作为生物防治剂代替了合成杀虫剂防治由核盘引起的白斑病;向亚萍等[21]报道芽孢杆菌的抑菌活性与其产脂肽类抗生素相关;Kumar V等[22]从发酵食品中分离得到一株高产细菌素的杆菌,具有很强的抗菌性能;Raza等[23]发现解淀粉芽孢杆菌产生的挥发性有机物对番茄青枯病病原菌有抑制作用;Yuting等[24]报道了一株芽孢杆菌的发酵产物对番茄早疫病病原菌的菌丝和孢子均有抑制作用。Gul等[25]报道枯草芽孢杆菌代谢产蛋白酶与其生物防治功能相关;GO等[26]研究发现芽孢杆菌S8具有角质分解和抗真菌活性;Brack C等[27]报道短小芽孢杆菌在代谢过程中能产生细菌分解酶并在柠檬酸杆菌溶菌过程起作用。Souza Fabiana等[28]发现解淀粉芽孢杆菌可作为纤维蛋白溶解酶的生产者,并有并有望成为治疗血管疾病的有力药物。本实验发现分离得到的拮抗菌具有产纤维素酶、果胶酶和蛋白酶的能力,这将对拮抗菌抑菌机制做进一步研究奠定了基础,同时也需要对发酵液中是否有抑菌活性物质进行继续探究,为今后实验做了铺垫。
4 结论
本实验从健康刺梨及其根系土壤分离得到两株拮抗菌JK-6和JK-32,通过进行形态学、生理生化和细菌16S rRNA基因序列分析,鉴定JK-6和JK-32两株拮抗菌分别为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、空气芽孢杆菌(Bacillusaerius);通过叶盘实验结果表明JK-6和JK-32对刺梨白粉病有防治效果,发酵原液防治效果到达了60%和57%;JK-6和JK-32的生长曲线绘制结果显示,两株菌都在在培养16~17 h后进入稳定期,20~21 h后进入衰亡期;JK-6和JK-32对白粉病孢子萌发有抑制作用,同时对菌丝有畸变效果;产酶实验结果表明,两株拮抗菌均可产生蛋白酶、纤维素酶和果胶酶。
