一种中温淀粉酶在解淀粉芽孢杆菌LT的重组表达
2018-12-10,,,,1,,
,, ,,1,,
(1.中国科学院上海高等研究院,绿色化学工程技术研究中心,上海 201210; 2.中国科学院大学,北京 100049; 3.上海科技大学生命科学学院,上海 201210)
α-淀粉酶根据最适作用温度的不同可分为低温、中温和高温淀粉酶三个类型,其中,来源于解淀粉芽孢杆菌的中温α-淀粉酶是目前应用广泛的一种淀粉液化酶。早在上世纪60年代,我国就已经实现了中温α-淀粉酶的工业化生产, 主要是由解淀粉芽孢杆菌BF7658及其突变菌株或重组菌株生产获得[1-2],主要应用于造纸、织造、淀粉加工等领域[3]。通过菌种优化提高酶的生化性能或菌株的生产能力,降低经济成本,一直都是研究淀粉酶的主要策略。近几十年来,由于耐高温淀粉酶市场需求的持续增长,国内对于中温淀粉酶的研究较少,其中,刘洋等[1]研究人员通过分子克隆的方法实现了淀粉酶编码基因amyQ(来源于B.amyloliquefaciensCICIM B2135)在E.coli和B.subtilis中的异源表达,而且通过多拷贝质粒pLY-amyQ的转化得到了新的重组菌株,并且在摇瓶水平上,将中温淀粉酶的分泌能力提高了50%。
芽孢杆菌具有自然界中广泛存在[4]、细胞壁中不含内毒素、能分泌大量胞外蛋白且易于分离等多种优良特性,因此,世界上大约50%的酶制剂产品的生产都依赖于芽孢杆菌的自身或者异源表达[5-6],其中以解淀粉芽孢杆菌和地衣芽孢杆菌为代表。解淀粉芽孢杆菌是获得食品工业酶生产许可的安全微生物之一[7],随着其模式菌株FZB42全基因组测序的完成[8],对其相关代谢机理研究已经进入分子层面。地衣芽孢杆菌与其他芽孢杆菌相比,多存在于较恶劣的环境中[9],蛋白分泌能力强,约为枯草芽孢杆菌的20倍,异源表达水平可达到20~25 g·L-1[10]。目前,这两种菌株由于外源DNA转化效率较低的限制而未得到充分的应用。相关研究表明外源DNA的转化可能受到菌株内存在的DNA限制修饰系统的影响[11],通过PubMed的解淀粉芽孢杆菌和测序得到的实验室1398菌株的基因数据分析,结果显示都存在一种Type IV R-M(Mrr)限制修饰系统,而在枯草芽孢杆菌的模式菌株168和164中却不存在。本研究将针对解淀粉芽孢杆菌转化的问题,通过分子生物学操作和甲基化修饰策略,将其改造为合适生产中温淀粉酶的菌株,并为其他芽孢杆菌的改造提供理论基础。
1 材料与方法
1.1 材料与仪器
菌株与质粒 见表1,芽孢杆菌菌株包括解淀粉芽孢杆菌1398和枯草芽孢杆菌164s以及地衣芽孢杆菌Jbac均为实验室分离或改造的实验菌株。其中,164s是实验室对模式枯草芽孢杆菌164进行感受态改造后获得的高转化率生产菌株。实验所用的引物及扩增的DNA产物名称见列表2。基因组DNA提取试剂盒、PCR清洁试剂盒、质粒小剂量提取试剂盒等 杭州爱思进生物技术有限公司;DNA聚合酶 PrimerStar、限制性内切酶DpnI Takara公司。

表1 菌株和质粒Table 1 Strains and plasmids
主要实验仪器有S1000TMPCR扩增仪、Gel DocTMXR+全自动凝胶成像仪、MicroPulser电转仪和Tanon EPS30电泳槽 伯乐生命医学产品(上海)有限责任公司;MLS-3780立式蒸汽灭菌器 日本三洋仪器公司;WFJ 2100紫外分光光度计 尤尼柯(上海)仪器有限公司;5430R高速冷冻离心机 艾本德生命科学仪器有限公司;ZSD-A1160A恒温培养箱、ZWY-2102C恒温摇床 上海智城分析仪器制造有限公司。
1.2 实验方法
1.2.1 培养基的配制 菌体活化培养等所用培养基均为LB培养基,LB培养基(g/L):氯化钠 10,胰蛋白胨10,酵母浸取物5,用去离子水定容。
芽孢杆菌电转培养基包括菌体富集培养基、电转洗涤培养基和复苏培养基三种,其中菌体富集培养基(g/L):磷酸氢二钾17.4,氯化钠 11.6,葡萄糖5,胰蛋白胨5,酵母浸取物1,柠檬酸钠0.3,七水硫酸镁 0.05,山梨醇91.1;电转洗涤培养基(g/L):山梨醇91.1,甘露醇91.1,海藻糖171.1,10%(V/V%)的甘油;复苏培养基(g/L):磷酸氢二钾17.4,氯化钠 11.6,葡萄糖5,胰蛋白胨5,酵母浸取物1,柠檬酸钠0.3,七水硫酸镁 0.05,山梨醇91.1,甘露醇69.5。发酵用淀粉酶生产培养基(g/L):75%的麦芽糖浆50,葡萄糖20,玉米浆20,磷酸二氢钾12,硫酸铵14,硫酸镁0.4,尿素2,酵母粉2;除电转洗涤培养基用双蒸水配制,其他培养基都用去离子水配制。
枯草芽孢杆菌164s诱导转化培养基为含1%(w/v)木糖的LB培养基。
用于大肠杆菌转化子筛选的氨苄青霉素(Amp)浓度为100 μg/mL,而用于芽孢杆菌转化子筛选的红霉素(Erm)浓度为10 μg/mL。
1.2.2 试剂和溶液配制 原碘液,分别称取碘(I2)11.0 g、碘化钾(KI)22.0 g,然后用少量的水使碘和碘化钾完全溶解,并用去离子水定容至500 mL,储存于棕色试剂瓶中待用;
稀碘液,称取碘化钾20 g用水溶解,然后用移液枪加入原碘液2.00 mL,并定容至500 mL,储存于棕色试剂瓶中待用;
20 g/L可溶性淀粉溶液,将85 ℃下烘2~3 h的可溶性淀粉10.000 g,倒入烧杯中,用水调制成浆状物,在电磁搅拌器下并加水约400 mL,加热沸腾2~3次至完全透明,冷却,定容至500 mL(此溶液需要当天配制);
磷酸缓冲液(pH=6.0)称取磷酸氢二钠(Na2HPO4·12H2O)45.23 g、柠檬酸(C6H8O7·H2O)8.07 g,用水溶解并定容至1000 mL。配好后用pH计测定并调节。
1.2.3 感受态的制备与转化 大肠杆菌的转化采用氯化钙法[13],而1398和Jbac在电击转化方法[14-15]上进行如下改良,主要表现在两个方面,一,将感受态制备中菌体洗涤用的无菌水换成具有高渗透压的海藻糖电转洗涤培养基;二,复苏过程中培养基同样使用高渗透性的山梨醇-甘露醇培养基。具体方法如下:
单菌落1398和Jbac接到3 mL LB试管中,37 ℃,200 r/min过夜培养10~12 h;取2.4 mL 菌液接到40 mL富集培养基的三角摇瓶(250 mL)中,37 ℃,200 r/min摇床培养直到OD600长到0.6~0.8时,取出置于冰上处理20 min,然后倒入无菌离心管(50 mL)中,4 ℃,6000 r/min离心8 min收集菌体,倒掉上清后,加入约30 mL预冷的电转洗涤培养基,并用移液枪轻轻吹打均匀,并轻微摇匀,继续4 ℃,6000 r/min离心8 min,去上清,重复此操作2~3次,用最后一次管壁残余的少许洗涤培养基吹打菌体,混匀,即为感受态细胞悬液,用提前预冷的枪头分装到1.5 mL Ep离心管中,每管60 μL感受态细胞悬液。加入1 μg质粒,混匀,冰上静置5 min,然后加入电转杯(2 mm),在设定电压为2.5 kV的电转化仪器上点击一次,迅速加入500 mL 复苏培养基,然后转移到Ep管中,37 ℃,200 r/min复苏3 h左右,涂到对应的抗性平板培养基。
164s的木糖诱导转化方法:将单克隆菌株164s转接到LB试管中,过夜培养8~12 h,吸取62 μL的木糖溶液加入到一支新鲜的LB试管中,37 ℃预热5 min,然后加入300 mL的164s菌液,37 ℃,200 r/min,培养3 h左右,即可形成感受态细胞,接着用2.0 mL的无菌Ep管分装,每管500 mL,加入1 μg质粒,并加入500 mL 新鲜LB培养基,混匀后,37 ℃,200 r/min培养2 h,涂布与之相对应抗性的LB平板,用以筛选阳性转化子。
1.2.4 质粒构建 表达GFP的质粒pMK4-1398P-gfp构建来自课题组前期实验[16]。在pMK4E的基础之上,本文通过合成两对引物P1/P2和P5/P6分别扩增出pMK4片段和erm(红霉素抗性基因)片段,然后通过Overlap PCR的方法得到pMK4E质粒,实现erm替换原来pMK4质粒中的cm(氯霉素抗性基因)片段。从课题组筛选的解淀粉芽孢杆菌LT的基因组上通过引物P3/P4扩增出中温淀粉酶dx片段,然后用P5/P6扩增出线性载体pMK4E片段,然后用一步克隆法[17]转化164s得到pMK4E-dx,构建流程如图1所示。
1.2.5 质粒转化实验 本研究将课题组以前构建的质粒pMK4-1398P-gfp[16]和pMK4E依次经过化学转化JM110和甲基化处理,并将500 ng甲基化处理的质粒分别转化解淀粉芽孢杆菌1398和地衣芽孢杆菌Jbac,并以164s中提取出的甲基化修饰质粒(pMK4-1398P-gfp和pMK4E)为对照,分别通过荧光显色和Erm抗性平板筛选阳性转化子。
为进一步验证这种方法,本研究通过overlap的方法构建了一个带有淀粉酶基因dx的重组质粒pMK4E-dx(如图1所示),通过转化164s菌株,得到了带有重组质粒的菌株,将164s中的重组质粒pMK4E-dx(164s来源)提取出来,分别转化大肠杆菌JM110和DH5α,得到未经过甲基化修饰的质粒pMK4E-dx(JM110来源)和甲基化修饰的质粒pMK4E-dx(DH5α来源),通过电击转化的方法将未甲基化的质粒pMK4E-dx和甲基化的质粒pMK4E-dx转入到解淀粉芽孢杆菌LT(实验室分离出来的一株解淀粉芽孢杆菌)中。
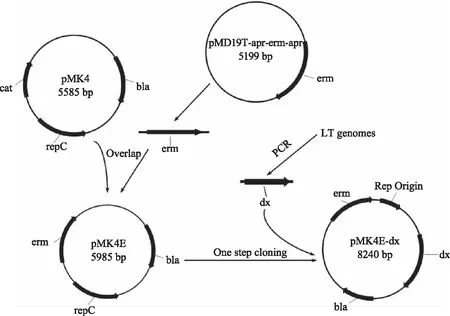
图1 质粒pMK4E-dx的构建过程Fig.1 Construction of plasmid pMK4E-dx注:bla,氨苄抗性基因(amp)片段;cat,氯霉素抗性基因(cm)片段。
1.2.6 中温淀粉酶摇瓶发酵实验 将LT-J1和LT-J2以及LT的单克隆菌株接入LB试管中,37 ℃,200 r/min培养10~12 h后,吸取1 mL菌液转接到100 mL(500 mL三角瓶)发酵培养基中,以LT菌株为对照组,37 ℃,200 r/min培养24 h,然后12000 r/min离心2 min,吸取上清即为粗酶液。
1.2.7 淀粉酶活测定方法 根据GB/T18932.16[18]规定,1 g固体酶粉(或1 mL液体酶),于60 ℃、pH6.0的条件下,1 h液化1 g可溶性淀粉,即为1个酶活力单位,以U/g(U/mL)表示。吸取可溶性淀粉20.0 mL于试管中,加入缓冲液5.00 mL,摇匀后,水浴锅中60 ℃恒温预热5 min;将发酵液稀释10、50、100倍,(使测得的酶活力在3.7~5.6 U/mL之间),加入稀释好的待测酶液1.00 mL,立即用秒表记录时间,准确反应5 min;立即吸取反应液1.00 mL于稀碘液5.00 mL中,摇匀,并以稀碘液做空白对照,倒入10 mm比色皿,用紫外分光光度计迅速测定其吸光度。根据吸光度查附表(见GB/T18932.16),可以得到待测酶液的酶活。
2 结果与分析
2.1 Jbac、1398菌株的基因组信息分析
对解淀粉芽孢杆菌1398、地衣芽孢杆菌Jbac和PubMed上BLAST的解淀粉芽孢杆菌进行基因数据进行分析比对(如图2所示),发现都存在一种限制修饰系统(R-M)—— Mrr(Methylated adenine recognition and restriction,Type IV)。当这些菌株的细胞摄取外源DNA进入细胞内后,由于质粒上的甲基化标记会被这些限制修饰系统识别,激活降解外源DNA的信号通路,从而导致外源DNA很难导入细胞内,因此导致了许多芽孢杆菌很难进行遗传操作的现状。

图2 三种不同芽孢杆菌修饰系统IV编码蛋白的序列比对Fig.2 The multialignment analysis of type IV modification enzymes’ peptide sequences in three different Bacillus strains注:图左侧分别以1398,B.Amyloliquefaciens,Jbac分别表示各自菌株中的IV型限制修饰系统相关基因。
2.2 pMK4-1398P-gfp转化地衣芽孢杆菌Jbac和解淀粉芽孢杆菌1398
经甲基化试剂处理的质粒转入解淀粉芽孢杆菌1398后,得到了4个转化子,转化地衣芽孢杆菌Jbac后,得到了6个转化子;作为对照,使用从枯草芽孢杆菌164s细胞中直接提取的相同质粒(未经甲基化酶处理)在转化1398或Jbac均未获转化子。转化子通过Colony PCR 验证,如图3(a)所示,Jbac转化子阳性率为100%,而解淀粉芽孢杆菌1398转化子通过荧光检验,结果如3(b)所示,出现荧光现象的表示为质粒转入成功,反之则表示没有转入,Colony PCR验证后,如图3(c)所示,阳性率为75%。
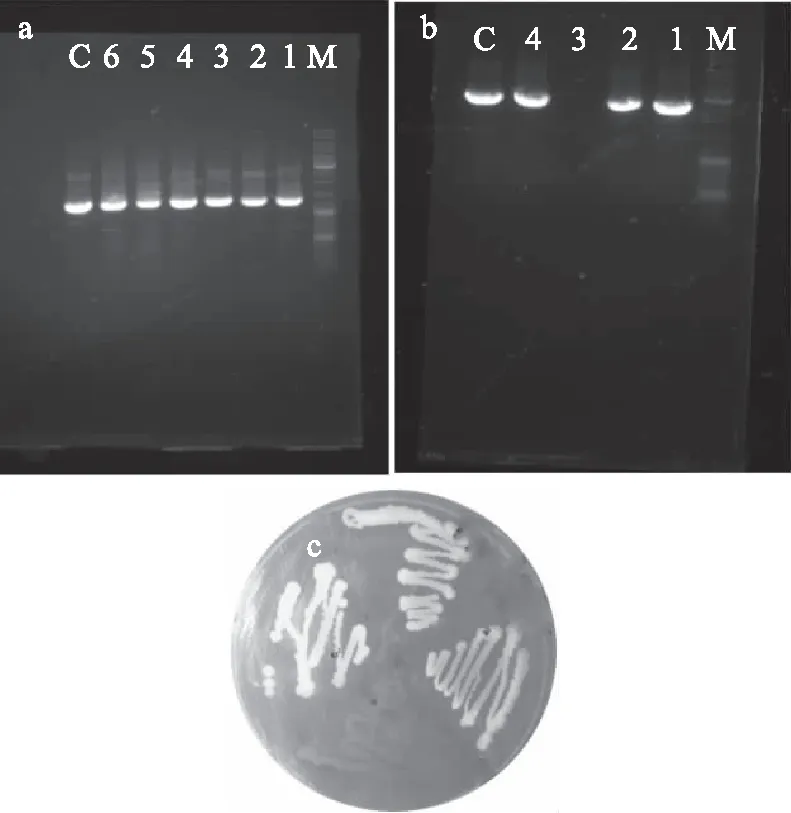
图3 分别转化pMK4E质粒和GFP表达质粒到地衣芽孢杆菌J.bac和解淀粉芽孢杆菌1398的转化结果Fig.3 Transformation of plasmid pMK4E and GFP-expressing plasmids into B.licheniformis J.bac and B. amyloliquefaciens 1398 respectively注:a,c分别为转化后PCR验证的电泳图,其中M表示Marker,C表示对照组control;图a中1~6表示挑选的阳性转化子的编号,目的条带Erm为1143 bp;b为菌落荧光图,颜色亮的表示有荧光,反之则没有。图c中1~4表示阳性转化子的编号,目的条带comk为2567 bp。
2.3 重组淀粉酶dx在解淀粉芽孢杆菌LT中的表达
以DH5α来源的pMK4E-dx质粒作为对照,其中转入未甲基化的质粒pMK4E-dx,得到是三个转化子,而转入DH5α来源的质粒都没有得到转化子,通过试管培养发现,三个转化子中只有两个能提取出质粒,这两株菌分别记为LT-J1、LT-J2。
将得到的两株菌进行摇瓶发酵并测定重组酶活,结果如图4所示,两株转入了重组表达中温淀粉酶DX的重组菌,其分泌表达的酶活大大高于原有宿主生产菌株,酶活分别达到145.9 U/mL(LT-J1)和153.6 U/mL(LT-J2),为原菌株发酵淀粉酶活的3.65和3.84倍,证实了新的策略成功地实现野生型芽孢杆菌的转化,提升了原有解淀粉芽孢杆菌LT的中温淀粉酶生产能力,这种新的转化策略不仅可以应用到对该菌后续的分子改造研究中,还可能会被应用到其它转化率低的野生型芽孢杆菌中。
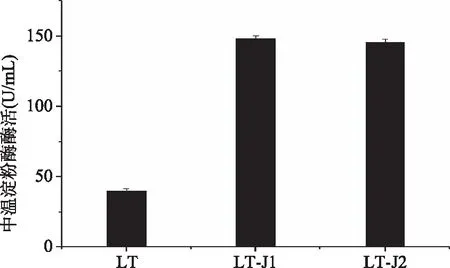
图4 中温淀粉酶dx在解淀粉芽孢杆菌LT中的表达Fig.4 Expression of midrange thermal stable amylase dx in Bacillus amyloliquefaciens注:LT:野生型的解淀粉芽孢杆菌;LT-J1、LT-J2:转入pMK4E-dx质粒的LT菌株。
3 结论
基于三株芽孢杆菌的基因组序列分析,发现细胞内存在相同的限制修饰系统——IV型限制修饰系统(Mrr),其携带的IV型DNA限制性内切酶是模式枯草芽孢杆菌168及164所没有的,因而可能是两种微生物转化效率特别低的原因之一。针对这一情况,我们分别用未甲基化的质粒和甲基化的质粒进行电转,并且优化了电转化的实验操作过程,结果表明,未经过甲基化修饰的外源DNA更容易转化到芽孢杆菌中,同时我们还利用新开发的转化方法,将构建的表达重组中温淀粉酶的质粒转入到解淀粉芽孢杆菌LT中,经发酵培养基摇瓶培养,测得LT-J1和LT-J2的酶活为145.9 U/mL和153.6 U/mL,是原生产菌株的3.65倍和3.84倍,为后续的中温淀粉酶工业生产菌株的工程改造及发酵优化奠定了很好的研究基础。
