地参结合酚提取物对α葡萄糖苷酶和胰脂肪酶的抑制作用
2018-12-10,
,
(大理大学公共卫生学院,云南大理 671000)
地参(LycopuslucidusTurcz.)唇形科地笋属,又名虫草参[1],中药名叫“泽兰”,药食兼用[2],含有人体所需的各种氨基酸、微量元素、糖类、等多种营养成分及多酚、皂苷和多糖等生物活性成分[3-4];且临床研究发现,地参有降血脂、降血糖、抗肿瘤、抗氧化和减肥等多种保健功能[5-9]。
α-葡萄糖苷酶是存在于小肠绒毛上皮细胞刷状缘膜上的寡糖水解酶,可使碳水化合物结构中的α-1,4糖苷键断裂将其水解为葡萄糖。通过抑制α-葡萄糖苷酶活性,可延缓或阻碍葡萄糖的生成或吸收,来降低餐后血糖峰值[10-12]。胰脂肪酶是脂肪在水解过程中的关键酶,通过抑制其水解膳食脂肪,减少食物脂肪因降解为单甘油酯、甘油二酯、甘油和脂肪酸而被人体吸收,从而达到预防肥胖的效果[13-15]。植物多酚对α-葡萄糖苷酶和胰脂肪酶具有显著的抑制作用,且来源广泛、毒副作用小[16-17]。黄菊华等[3]研究表明,地参多酚具有显著抗氧化活性。刘莉等[18-21]研究指出,植物多酚类物质能有效的抑制α-葡萄糖苷酶和胰脂肪酶的活性,但关于地参结合酚降糖降脂的研究尚未见报道。本文以地参结合酚提取物对体外消化酶的抑制率为指标,研究地参结合酚提取物对α-葡萄糖苷酶和胰脂肪酶的抑制作用,以期为地参的进一步加工利用与相关抗糖尿病和减肥功能食品开发提供理论基础。
1 材料与方法
1.1 材料与仪器
地参样品 分别于2016年11月16日(T1)、2016年12月15日(T2)和2017年1月14日(T3)三个采收期,采于云南省大理白族自治州剑川县沙溪镇的四联村(S1)和江尾村(S2)两个采收地,采集新鲜完整、无破损的地参原料,清洗,冷冻干燥(温度:-51 ℃),粉碎过60目筛,4 ℃贮藏备用;α-葡萄糖苷酶、胰脂肪酶、对硝基苯-α-D-半乳糖吡喃糖苷(PNPG)、4-甲基伞形酮油酸酯(4-MUO)等 购自Sigma公司;其余试剂 均为分析纯。
SK8210HP 超声波清洗器 上海科尼超声仪器有限公司;RE-5298 型旋转蒸发器 上海亚荣生化仪器厂;恒温水浴箱 金坛市大地自动化仪器厂;Scientz-ND 型系列真空冷冻干燥机 宁波新芝生物科技股份有限公司;WFJ 2000 型可见光分光光度计 上海尤尼科仪器有限公司;F96pro 荧光分光光度计 上海棱光技术有限公司;Agilent 1200 型高效液相色谱仪 美国Agilent公司。
1.2 实验方法
1.2.1 地参结合酚提取物的提取 参考Xu等[22]的方法,略作修改。准确称取地参粉末5 g,用80%的甲醇按料液比1∶20 (w/v),超声波(频率:59 kHz,温度:室温;时间:10 min)辅助提取3次,抽滤去除溶剂,残渣加入35 mL 4 mol/L NaOH溶液(含10 mmol/L乙二胺四乙酸二钠(EDTA-2Na)和1%抗坏血酸),室温暗室水解反应4 h,反应结束后,用6 mol/L HCl将pH调至1~2,真空抽滤,滤液用乙酸乙酯萃取5次(每次15 mL),合并乙酸乙酯相,35 ℃旋转蒸发除去乙酸乙酯。将浓缩液置于50 mL离心管,蒸馏水定容至15 mL,定义为地参结合酚粗提取物。
1.2.2 地参结合酚提取物的纯化 参照金莹等[23]的方法,略加修改。称取一定量已处理的X-5大孔树脂加入到地参结合酚粗提取液中,水浴振荡(25 ℃,120 r/min)24 h,抽滤,将吸附了酚类物质的大孔树脂置于50 mL离心管,加入15 mL 70%乙醇,水浴振荡(25 ℃,120 r/min)24 h,抽滤,滤液40 ℃旋转蒸发除去乙醇,浓缩液冷冻干燥(温度:-51 ℃),得地参结合酚提取物。
1.2.3 地参结合酚提取物酚含量的测定 参考陈磊等[24]的方法,略作修改。以没食子酸做标准曲线,得回归方程:y=0.0965x+0.0974(0~6.4 μg/mL),R2=0.9917。样品中酚含量测定结果以微克没食子酸等量每毫克提取物干重表示(μg GAE/mg)。
1.2.4 地参结合酚提取物的HPLC分析 参考高红兵等[25]的方法,并略作修改。采用高效液相色谱法(HPLC)对地参结合酚提取物的组成进行分析。Agilent ZORBAX SB-C 18色谱柱(250 mm×4.6 mm,5 μm),流速1.0 mL/min,柱温30 ℃,进样量10 μL;检测波长为320 nm。流动相A:100%色谱甲醇,流动相B:冰乙酸/色谱甲醇/超纯水溶液,1/10/89(v/v/v)。梯度洗脱程序如下:0~1 min:A 20%,1~16 min:A 20%升至38%,16~18 min:A 38%,18~30 min:A 38%升至60%,30~35 min:A 60%,35~40 min:A 60%降至20%,40~43 min:A 20%。
以咖啡酸和迷迭香酸做标准品,得咖啡酸回归方程为y=46.1790x+136.8550(10~50 μg/mL),R2=0.9940;迷迭香酸回归方程为y=20.67x-93.06(10~50 μg/mL),R2=0.9989。
1.2.5 地参结合酚提取物对α-葡萄糖苷酶的抑制作用 参考Kim等[26-27]的方法,略作修改。0.1 mL不同浓度(1、2、3、4、5 mg/mL)的样品与0.1 mLα-葡萄糖苷酶(1.25 U/mL)充分混匀,加入0.1 mL PNPG(1.5 mmol/mL,pH7.4),37 ℃水浴15 min,加入3 mL的碳酸钠溶(1 mol/L)终止反应,在400 nm处测定吸光度值。本底管和对照管中的PNPG和样品均用0.1 mL的磷酸盐缓冲液(10 mmol/L,pH7.4)代替。地参结合酚提取物对α-葡萄糖苷酶的抑制率用下式计算:
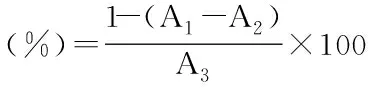
式中:A1为样品管的吸光度值;A2为本底管的吸光度值;A3为对照管的吸光度值。
1.2.6 地参结合酚提取物对胰脂肪酶的抑制作用 参考张兵[28]、Liang[29]等的方法,略作修改。取0.1 mL 4-MUO(0.1 mmol/L)、0.04 mL柠檬酸-磷酸氢二钠缓冲液(0.1 mol/L,pH7.4),与0.1 mL不同浓度(0.5、1、2、4、8 mg/mL)的样品充分混匀后,加入0.05 mL胰脂肪酶(0.05 U/mL),37 ℃水浴20 min,依次加入1 mL盐酸(0.1 mol/L)和2 mL柠檬酸钠(0.1 mol/L)终止反应。对照管中的样品用柠檬酸-磷酸氢二钠缓冲液代替,于激发波长365 nm,发射波长350 nm处测定荧光值。地参结合酚提取物对胰脂肪酶的抑制率用下式计算:
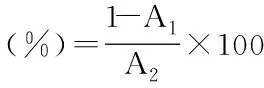
式中:A1为样品管的吸光度值;A2为对照管的吸光度值。
2 结果与分析
2.1 地参结合酚提取物的酚含量
地参结合酚提取物酚含量见表1。就S1采收的地参而言,三个采收期之间酚含量无显著性差异;就S2采收的地参而言,T2采收期酚含量显著高于T1和T3(p<0.05)。酚类化合物的合成代谢途径中涉及苯丙氨酸解氨酶(PAL)、酪氨酸氨基轻移酶(TAT)、肉桂酸-4-羟基化酶(C4H)、多酚氧化酶(PPO)等多种酶。有文献报道,辐照[30]、农药[31]、真菌和昆虫的攻击[32]、诱导子和低温应激[33]都会影响这些酶的合成或改变酶的活性,从而影响植物中酚类化合物的合成。地参结合酚的变化证实了采收期对多酚合成与代谢的影响,与郭琦等[34]的研究结果一致。
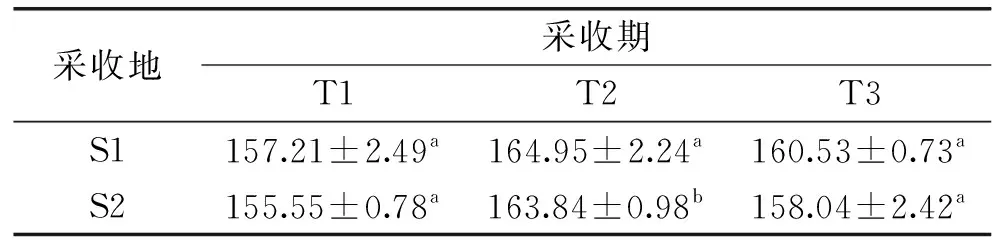
表1 地参结合酚提取物的酚含量(μg GAE/mg)Table 1 Total phenolic of bound phenolic from Lycopus lucidus Turcz.(μg GAE/mg)
2.2 地参结合酚提取物主要酚类化合物组成的分析
前期的研究结果显示,地参结合酚提取物中主要的酚类化合物为咖啡酸和迷迭香酸[35],因此选取了咖啡酸和迷迭香酸为指标成分。标准品及代表性地参结合酚提取物HPLC色谱图见图1。地参结合酚提取物中,咖啡酸和迷迭香酸的含量见表2。由表2可知,不同采收地和采收期的地参结合酚提取物中,咖啡酸和迷迭香酸的含量具有显著性差异。随着采收期的延后,S1采收的地参,其咖啡酸含量先下降了13.34%,再升高了13.63%,相反S2采收的地参,其咖啡酸含量先升高了77.48%,再下降了35.65%;在整个采收过程中,在S1采收的地参中迷迭香酸的含量下降了52.38%,而S2采收的地参中迷迭香酸的含量T3与T2相比,下降了7.08%。咖啡酸在植物体内通过一般的苯丙酸类途径合成,PAL是影响其合成的关键酶。迷迭香酸在植物体内的合成,首先是L-苯丙氨酸和L-酪氨酸分别在PAL、C4H、4-香豆酸辅酶A连接酶(4CL)和TAT的催化下,转化为4-香豆素基-辅酶A和4-羟基苯基丙酮酸;羟基苯基丙酮酸还原酶将4-羟基苯基丙酮酸转化为4-羟基苯基乳酸;4-香豆素基-辅酶A和4-羟基苯基乳酸在迷迭香酸合成酶作用下,形成酯键连接起来,同时释放辅酶A和生成4-香豆素基-4′-羟基苯基乳酸;4-香豆素基-4′-羟基苯基乳酸在细胞色素P 450依赖的单加氧酶作用下转变为迷迭香酸。由此可见,迷迭香酸在植物体内的合成与多种酶有关[36]。实验结果显示,同一采收地不同采收期地参的咖啡酸和迷迭香酸含量变化可归因于不同的酚类化合物具有不同的合成代谢途径。

表2 地参结合酚提取物中主要酚类化合物的含量(μg/mg EDW)Table 2 Content of main pehnolic compounds in bound phenolic from Lycopus lucidus Turcz.(μg/mg EDW)
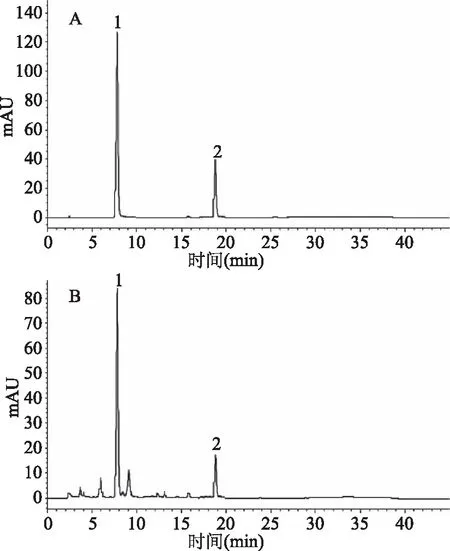
图1 酚酸标准品和代表性的地参结合酚提取物HPLC色谱图(320 nm)Fig.1 HPLC chromatograms of standards and representative bound phenolic from Lycopus lucidus Turcz.(320 nm)注:A:混合标准品;B:S1采收地T1采收期的地参结合酚提取物;峰1:咖啡酸;峰2:迷迭香酸。
2.3 地参结合酚提取物对α-葡萄糖苷酶的抑制作用
地参结合酚提取物对α-葡萄糖苷酶的抑制作用见表3。地参结合酚提取物对α-葡萄糖苷酶的抑制作用随质量浓度的升高而增强,呈良好的线性关系,相关系数均大于0.9。地参结合酚提取物对α-葡萄糖苷酶的抑制能力用IC50值表示(抑制率达到50%时所需提取物浓度),IC50值越小,表明其抑制能力越强。随着采收期的延后,S1采收的地参对α-葡萄糖苷酶抑制作用的IC50值先减小后增大,也即抑制作用先增强后减弱,T2采收期的抑制能力最强;S2采收的地参对α-葡萄糖苷酶抑制作用的IC50值先增大后减小,也即抑制作用先减弱再增强,且T1采收期的抑制作用最强。S1采收的地参对α-葡萄糖苷酶抑制作用的IC50值范围为2.0275~3.2581 mg/mL,S2采收的地参对α-葡萄糖苷酶抑制作用的IC50值范围为2.9535~3.7538 mg/mL,可以看出S1采收的地参对α-葡萄糖苷酶抑制作用强于S2采收地,这与提取物中的酚含量和酚类化合物单体组成不同有关。相关性分析结果显示,提取物中酚含量、咖啡酸和迷迭香酸的含量与其对α-葡萄糖苷酶的抑制作用没有相关性(r=-0.291,p=0.575;r=-0.009,p=0.986;r=0.114,p=0.830),表明非酚类成分或其他酚类化合物对α-葡萄糖苷酶的抑制作用也具有一定贡献。Kwon等[37]研究了不同种类茶叶和葡萄酒对α-淀粉酶和α-葡萄糖苷酶的抑制作用及其与酚类含量的关系,证实了其α-葡萄糖苷酶抑制活性与所含有的酚类物质有关。有研究报道,原儿茶酸、儿茶素、表儿茶素、咖啡酸、香豆酸、绿原酸等酚类物质都具有一定的α-葡萄糖苷酶抑制活性[37-38]。
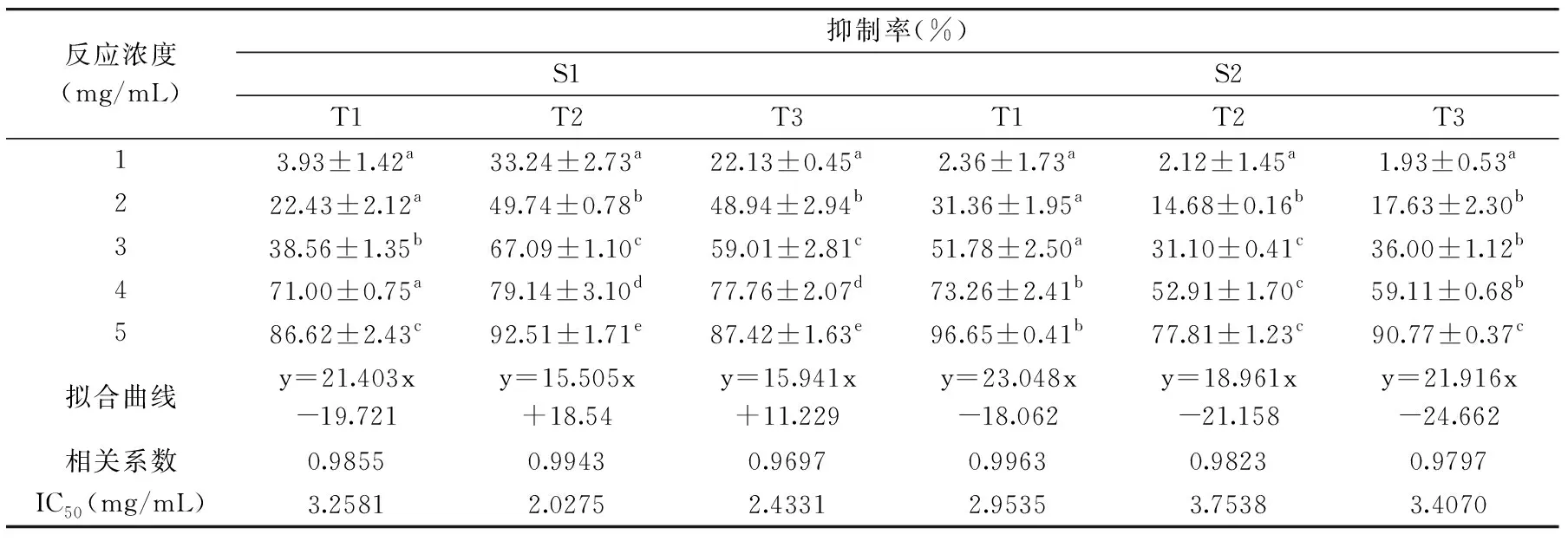
表3 地参结合酚提取物对α-葡萄糖苷酶的抑制作用Table 3 The inhibitory effect of bound phenol from Lycopus lucidus Turcz. on α-glucosidase
2.4 地参结合酚提取物对胰脂肪酶的抑制作用
地参结合酚提取物对胰脂肪酶的抑制作用见表4。地参结合酚提取物对胰脂肪酶的抑制作用随质量浓度的升高而增强,呈良好的对数曲线关系,相关系数均大于0.9。地参结合酚提取物对胰脂肪酶的抑制能力也用IC50值表示。随着采收期的延后,S1采收的地参对胰脂肪酶抑制作用的IC50值先减小后增大,也即抑制作用先增强后减弱;S2采收的地参对胰脂肪酶抑制作用的IC50值先增大后减小,也即抑制作用先减弱后增强。S1采收的地参对胰脂肪酶抑制作用的IC50值范围为1.4438~2.2076 mg/mL,S2采收的地参对胰脂肪酶抑制作用的IC50值范围为1.5791~3.1030 mg/mL,可以看出S1采收的地参对胰脂肪酶抑制作用强于S2采收地。相关性分析结果显示,酚含量、咖啡酸和迷迭香酸的含量与其对胰脂肪酶的抑制作用没有相关性(r=-0.222,p=0.673;r=-0.441,p=0.382;r=0.319,p=0.538),表明地参结合酚可能通过其主要成分或其各成分之间的协同作用,发挥其对胰脂肪酶的抑制作用。Bustanji等[39]在迷迭香中提取分离到迷迭香酸、没食子酸、咖啡酸和绿原酸,对其进行酶抑制实验,发现均能抑制胰脂肪酶的活性。Mcdougall等[40]研究发现,黄莓中的多酚能抑制胰脂肪酶活性。在本研究中,S1采收的地参结合酚单体含量较S2采收地的高,因此其对胰脂肪酶抑制作用强于S2采收地。
3 结论
以采自云南省剑川县沙溪镇两个不同采收地三个不同采收期地参样品为原料,对其酚含量及主要酚类化合物的组成进行了分析,并测定了其对α-葡萄糖苷酶和胰脂肪酶抑制作用。结果表明,地参结合酚提取物酚含量范围为155.55~164.95 μg GAE/mg,在整个采收期过程中,随采收期的延后呈现先增后降的变化趋势;地参结合酚提取物主要酚类化合物为咖啡酸(40.67~72.18 μg/mg EDW)和迷迭香酸(22.01~46.22 μg/mg EDW);地参结合酚提取物对α-葡萄糖苷酶和胰脂肪酶抑制作用的IC50值范围分别为2.0275~3.7538 mg/mL和1.4438~3.1030 mg/mL,研究结果为地参的开发与利用提供重要的理论依据。
