低温超微粉碎对豆渣蛋白结构及功能性质的影响
2018-12-10,,,,,,,,,*
, ,, , ,, ,,,*
(1.东北农业大学食品学院,黑龙江哈尔滨 150030; 2.黑龙江省北大荒绿色健康食品有限责任公司,黑龙江佳木斯 154002)
生物酶法制油作为一种新兴的“绿色、环保”提油技术,在提取油脂的同时,能高效地回收油料中其他价值组分,与传统工艺相比,在能耗、环境和安全卫生等方面具有显著优势,且具有操作条件温和、工序简单、低能耗、低污染等优点[1-4]。目前,国内外学者针对大豆水酶法的研究主要集中在其预处理方法、酶解工艺条件、乳状液破除、油脂释放机制及油脂品质研究等方面。目前,对于大豆加工过程副产物的研究主要集中在豆腐、豆浆残渣,而针对生物酶法制油豆渣的相关研究较少,对豆渣组分中蛋白结构、作用机理及潜在生物活性更是鲜有研究[5-8]。
超微粉碎及螺杆挤压改性处理技术是大豆加工副产物的深加工技术,超微粉碎处理使豆渣具有一般颗粒所没有的特殊理化性质,如良好的溶解性、分散性、吸附性、化学反应活性等[9-11]。有研究证实,超微粉碎能够促进大豆原料中蛋白质的提取[12]。Le等[13]研究了粒度对豌豆粉蛋白质提取率的影响,发现随着粉碎程度的降低,面粉的平均粒度增加,而豌豆粉提取的蛋白质量从73.6%下降到37.4%。Russin等[14]研究发现,不同研磨筛处理脱脂豆粉会导致其蛋白提取率不同,说明粒度对蛋白回收有明显影响。
综上所述,超微粉碎对植物蛋白分离、回收及理化性质影响显著,与其他方法相比,超微粉碎具有技术简单、低成本和可持续性的优势,但由于超微粉碎的高速剪切作用使得体系温度升高,而温度过高会导致蛋白结构功能变化,因此,为减小高温对蛋白构象的影响,本研究采用低温超微粉碎处理生物酶法制油的豆渣,应用二维及三维荧光光谱法分析不同处理条件下豆渣蛋白的结构变化,并通过豆渣蛋白界面性质、溶解性、粒度分析及ζ-电位对其功能性质进行表征,初步探究低温超微粉碎对生物酶法制油豆渣蛋白的作用机制,旨在通过低温超微粉碎这种简单处理方式提高豆渣蛋白品质,促进生物酶法副产物二次利用,填补该领域研究空缺,为生物酶法豆渣蛋白的分离、纯化及回收提供一定的理论指导。
1 材料与方法
1.1 材料与仪器
大豆 哈尔滨高科技(集团)股份有限公司;碱性蛋白酶Protex6L(8900 U/mL) 上海国药集团化学试剂有限公司;Lowry法测溶解度试剂盒 上海荔达生物科技有限公司;其它试剂 均为分析纯。
S22-2型恒温磁力搅拌器 上海司乐仪器有限公司;AL204型分析天平 梅特勒-托利多仪器(上海)有限公司;PHS-3C雷磁pH计 上海精科;SWFJ型超微粉碎机 广州市旭朗机械设备有限公司;TDL-408台式离心机 上海安亭科学仪器厂;HH-4型数显搅拌水浴锅 常州赛普实验仪器厂;DHG-9620A型鼓风干燥箱 上海一恒科学仪器有限公司;F-4500型荧光分光光度计 日本日立公司;Zetasizer Nano-ZS90型激光粒度仪 英国马尔文仪器有限公司。
1.2 实验方法
1.2.1 低酶体系酶法制油豆渣的制备 参照Li 等[15]的方法并进行适当修改,将大豆粉碎过60目筛,过筛后按料液比为1∶6 (m/V)加入200 g蒸馏水待搅拌均匀后放入55 ℃水浴锅内进行酶解,酶解条件为:酶解温度55 ℃、酶解时间2 h、pH维持在9.0、碱性蛋白酶Protex6L(8900 U/mL)添加量为0.5%,边搅拌边酶解,酶解结束后,取出并用1 mol/L HCl溶液调节水溶液pH至7,之后在100 ℃沸水中灭酶5 min,将灭酶后的溶液在4500 r/min,20 min条件下离心操作,豆渣在平板铺平后置入55 ℃鼓风烘箱待恒重后取出研磨即得所需酶法制油豆渣,即未处理豆渣。
1.2.2 低温超微粉碎处理豆渣 由于豆渣中的脂肪氧化后会产生异味并影响提取率[16],按照杨梦曦等[17]的处理方法除去脂肪。然后,采用超微粉碎机在-4 ℃下超微粉碎酶法制油豆渣(水分≤4%),粉碎时间30 s,出料粒度分别为100、200、300目,然后在55 ℃下烘干至质量恒定。常温超微粉碎豆渣样品条件为:温度25 ℃、出料粒度为200目。
1.2.3 豆渣蛋白的提取工艺 根据Petruccelli等[18]的方法。取150 g豆粉用正己烷以1∶6 (m/V)的比例混合脱脂3次得到脱脂豆粕,将脱脂豆粕按1∶10 (m/V)的质量比与水混合,用2 mol/L NaOH调节pH至8.5,45 ℃搅拌2 h后,将其悬浮液在4 ℃条件下10000×g离心20 min,取上清液再用2 mol/L HCl调节pH至豆渣蛋白等电点4.5。静置后在4 ℃条件下6000×g离心20 min,得蛋白沉淀水洗2次,最后取沉淀分散于水中并用2 mol/L NaOH调节pH至7.0。再在4 ℃条件下10000×g离心30 min,除去少量的不溶物,将此蛋白溶液冷冻干燥后研磨即得粉末状豆渣蛋白。
1.2.4 粒径分布及ζ-电位的测定 根据Tang等[19]的测定方法,利用进行粒径分布及ζ-电位测定。
1.2.5 乳化活性(EA)和乳化稳定性(ESI)的测定 乳化性能的测定根据Tang和Kinsella等[20-21]的方法取一定体积浓度为0.5%的蛋白质溶液,加入同体积的葵花籽油,以10000 r/min的速度高速搅拌1 min,之后分别在0、10 min 取样,用0.1%(m/v)SDS(十二烷基磺酸钠,pH7.0)稀释100倍,以SDS溶液为空白,测定 500 nm 处的吸光度值,以0 min的吸光度值(A0)表示EAI,乳化稳定性用ESI表示。
EAI=A0
式中:A0:0时刻的吸光值;ΔT:时间差(min);ΔA:ΔT内的吸光值差。
1.2.6 起泡性、泡沫稳定性的测定 根据Aewsiri等[22]的发泡性能测定方法,取50 mL 3%(m/v)豆渣蛋白悬浮液用高速分散器以10000 r/min的速度搅打1 min,用10 mL蒸馏水清洗刀具,洗液小心并入起泡液中,记录搅打前后的体积。起泡能力用体积增加的百分比表示。随后,将搅打起泡的样品静置10、20、30 min,记录不同时间段的泡沫体积,其中所有实验平均测量3次。
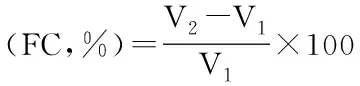
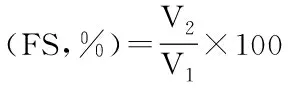
式中:FC:起泡能力(%);FS:起泡稳定性(%);V1:搅打前的体积mL);V2:搅打后的(mL)。
1.2.7 豆渣蛋白溶解性的测定 根据Messinger等[23]的方法加以改进。将豆渣蛋白溶于去离子水中,分别配成1%、2%、3%、4%(m/v)的豆渣蛋白溶液。精确称取10 mL豆渣蛋白溶液,在4500×g条件下离心15 min。上清液经适当稀释后,应用Lowry法测定上清液蛋白含量,以牛血清白蛋白为标准物绘制标准曲线,用凯氏定氮法测定样品总蛋白含量。

1.2.8 荧光光谱分析 根据Zhang等[24]的测定方法,使用荧光光谱仪测定样品的荧光光谱。配制50 mL,10 mg/mL的豆渣蛋白溶液,用磷酸盐缓冲溶液稀释100倍后,取适量稀释样品置于石英比色皿中测定。二维荧光测定参数为:扫描发射波长为300~500 nm之间,激发波长为280 nm,激发和发射狭缝均为5 nm;三维荧光光谱的连续扫描记录发射波长为200~500 nm。起始激发波长为200 nm,增长间隔为10 nm,扫描16条曲线。
1.3 数据处理
所有的实验至少进行3次试验,利用SPSS Statistics 22软件对数据进行ANOVA差异显著性分析,p<0.05为显著性差异。采用Origin 8.5软件进行数据分析,图表处理及图谱分析处理。
2 结果与分析
2.1 豆渣蛋白粒径及ζ-电位分析
不同处理方式对豆渣蛋白粒径分布、体积平均径D[4,3]及ζ-电位的影响如图1所示。与未处理条件相比,低温超微粉碎处理蛋白粒径降低至低至(24.06±0.02) μm,且ζ-电位绝对值增加至14.02±0.02,这是由于粒度降低导致蛋白比表面积增大,蛋白表面负电荷增加导致;与低温粉碎条件对比发现,常温超微粉碎条件下豆渣蛋白溶液体积平均径D[4,3]较高,ζ-电位绝对值低于低温超微处理方式,表明低温粉碎处理下豆渣蛋白溶液体系更加稳定。原因可能是,在常温粉碎条件下豆渣蛋白部分变性,蛋白结构解折叠,热聚集作用增强,从而生成大尺度聚集体,粒径增大,分子聚集作用增强,故ζ-电位绝对值降低,体系稳定性下降[25]。另外,在低温超微处理条件下,随着粉碎程度的不断增加,豆渣蛋白粒径先降低后升高,且ζ-电位绝对值呈先增加后降低的变化趋势,表明高速剪切力使得豆渣蛋白粒径不断减小,故ζ-电位绝对值增加;但粉碎程度超过200目后,ζ-电位绝对值降低且粒径增加,说明随着粉碎程度进一步加深,分子碰撞作用不再增加,过高剪切力作用使蛋白部分变性,粒子间极易相互吸引而发生聚集,体系稳定性下降。
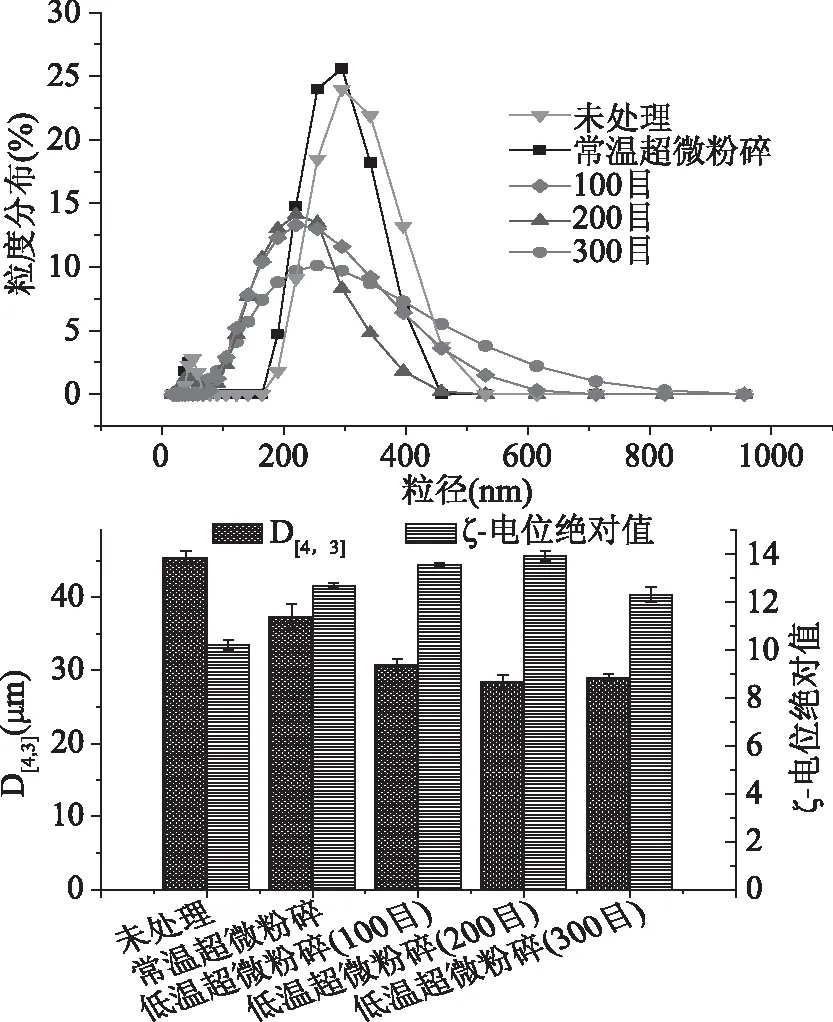
图1 处理方式对豆渣蛋白粒径分布、体积平均径D[4,3]及ζ-电位的影响Fig.1 Effect of different treatments on particle size distribution,volume mean diameter D[4,3]and zeta potential of soy dregs protein
2.2 豆渣蛋白界面性质分析
本研究测定不同处理条件下,豆渣蛋白的界面性质—起泡性(FC)、起泡稳定性(FS)、乳化活性(EA)和乳化稳定指数(ESI)。如图2所示,常温超微粉碎条件下豆渣蛋白界面性质不佳,原因可能是,常温粉碎条件下,高速剪切作用过程会产生巨大冲击力,从而对豆渣蛋白产生高温、高压作用,蛋白部分变性,蛋白分子间相互作用形成更多蛋白质聚集体,因此乳化性和起泡性相对较差[26]。此外,在低温粉碎条件下,随着粉碎目数的增加,豆渣蛋白乳化性及起泡性均呈现先上升后降低的变化趋势,这可能是由于,随着粉碎目数的不断增加,剪切力作用增强,分子间碰撞作用增强,蛋白质结构受到破坏,从而肽链得到进一步伸展,使包埋于蛋白内部的疏水性残基暴露,增加多肽链的交联,使它们进入油水界面,促使界面张力进一步降低,分子中所带的净电荷数量增加,通过分子间静电斥力阻止油滴聚合,从而提高了蛋白质在界面的吸附能力,表现为较高的乳化能力[27];当粉碎目数达到200目时,由于剪切力过高,使分子间碰撞作用停止,表面疏水性强,乳胶无法达到良好的亲水-疏水平衡。同时,Lee和Xiong等[28-29]研究表明,精磨粉碎处理后,蛋白质二级结构β-折叠构象的增加和β-转角结构减少,表明精磨粉碎后形成了更多的聚合和稳定的谷蛋白网络,证明超微粉碎能够使豆渣蛋白更趋向于有序结构,从而验证本研究中豆渣蛋白界面性质的这种变化趋势。
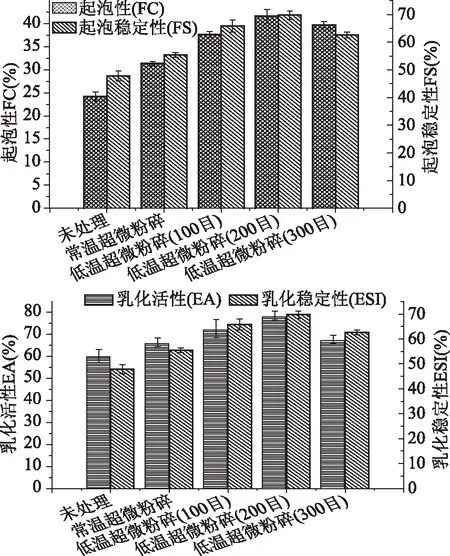
图2 不同处理方式对豆渣蛋白界面性质影响Fig.2 Effect of different treatments on interfacial properties of soy dregs protein
2.3 豆渣蛋白溶解性分析
不同处理方式下豆渣蛋白的溶解度变化如图3所示。与未处理组相比,常温及低温超微粉碎均表现出良好的界面性质,另外,对比发现在同一蛋白浓度下,低温超微粉碎处理后豆渣蛋白溶解度明显增高,并随着低温粉碎程度的加深,溶解度呈现先增加后降低的变化趋势。产生这种变化的原因是,超微粉碎过程中产生分子碰撞及高速剪切作用,豆渣蛋白表面电荷增加,促进蛋白溶解[2];同时,豆渣蛋白粒径减小,蛋白颗粒比表面积增加,利于蛋白与水的结合;但随着粉碎程度进一步加深,分子碰撞作用不再增加,过高剪切力作用使蛋白部分变性,豆渣蛋白可能通过氢键及二硫键作用发生聚合,形成不溶性的蛋白聚集体,从而使得蛋白质溶解度降低。另外,同一蛋白浓度下,常温超微粉碎蛋白溶解度低于低温处理方式,这可能是由于热处理使得豆渣蛋白中的7S和11S成分部分变性,蛋白结构发生解折叠,蛋白分子内输水性氨基酸暴露,导致分子间作用力下降,形成了不可溶性热聚集体[25]。随着蛋白浓度的增加,蛋白溶解度有所下降,这可能是由于,随着豆渣蛋白浓度的增加,蛋白质分子间的相互作用增强。
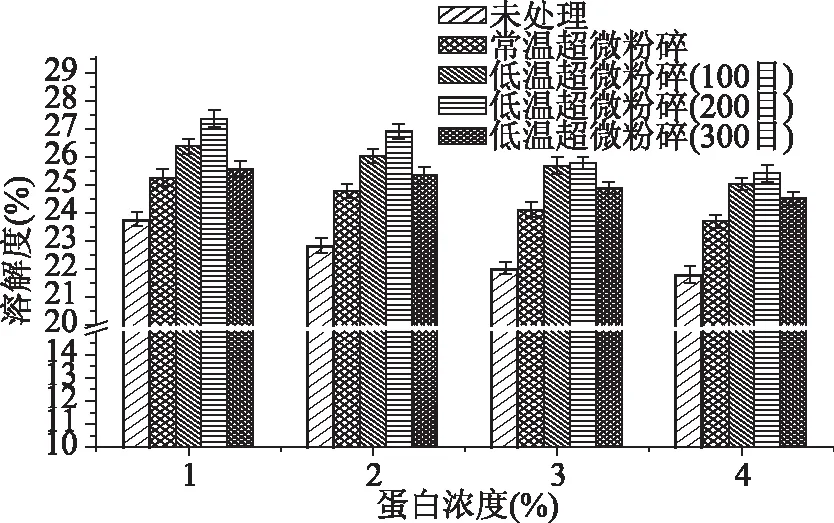
图3 不同处理方式对豆渣蛋白溶液溶解度的影响Fig.3 Effect of different treatments on the solubility of soy dregs protein
2.4 豆渣蛋白二维荧光光谱分析
从图4可以看出,常温超微粉碎处理下豆渣蛋白荧光强度明显降低,说明常温粉碎过程中分子碰撞对豆渣蛋白造成一定的温度效应,温度升高使部分蛋白变性,从而使蛋白的内源荧光产生猝灭作用,导致荧光强度降低。研究表明,大豆蛋白的荧光主要来自于Trp残基,且其荧光变化值可直接反应大豆蛋白中Trp残基本身及其周围环境变化[30]。当λmax大于330 nm时,表明Trp残基位于蛋白质分子外部的极性环境中[31],由此可知,本研究所测豆渣蛋白Trp残基分布趋向于蛋白分子外部环境。
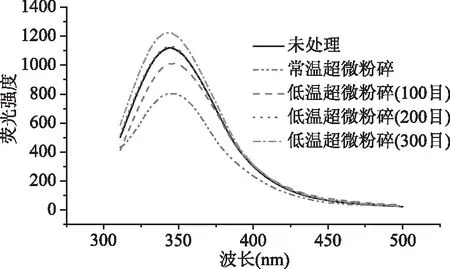
图4 不同处理条件下豆渣蛋白的荧光光谱Fig.4 The fluorescence quenching of soy dregs protein under different treatment
低温超微粉碎处理(100、200、300目)的豆渣蛋白的λmax分别为344.6、345.8及343.6 nm,与未处理组比较可知,低温超微粉碎处理下豆渣蛋白发生红移,随着粉碎程度加深,红移迁移量先增加后降低,并伴随荧光强度的增大,表明低温超微处理下豆渣蛋白Trp和Tyr的微环境发生改变,肽链结构舒展[31]。Režek Jambrak[32]和Li等[33]认为,在高速剪切作用过程中,空化气泡的快速形成和塌陷,将产生高度湍流条件、极高的压力和温度,从而导致蛋白质通过水解解折叠。而粉碎程度过大,豆渣蛋白分子间碰撞作用停止,氢键作用增大,分子间作用增强,豆渣蛋白荧光强度均降低,表明豆渣蛋白之间存在交互作用。
2.5 豆渣蛋白三维荧光光谱分析
三维荧光可以精确解析蛋白的结构信息[24]。如图5所示为不同处理条件下豆渣蛋白的三维荧光光谱图,并绘制相应的强度等高线图。其中Peak a(λex=λem)、Peak b(2λex=λem)分别为瑞利一级散射峰、二级散射峰;Peak 1为蛋白质Trp和Tyr残基的特征峰(λex=280 nm,λem=340 nm);此外Peak 2主要代表多肽链骨架结构的特征峰(λex=230 nm,λem=350 nm),这些都是荧光峰的典型特征峰[34]。
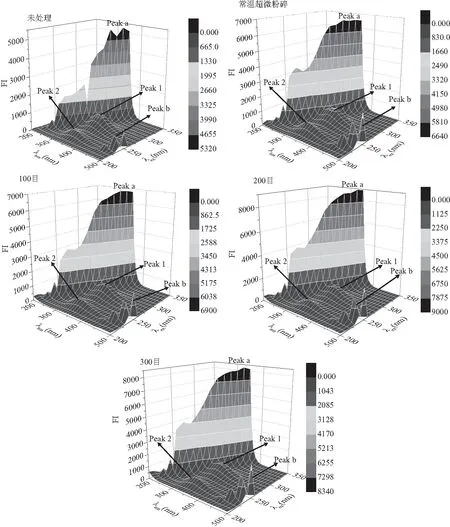
图5 豆渣蛋白体系三维荧光等高线图Fig.5 The 3D-dimensional fluorescence line figure of soy dregs protein
由图5可知,低温超微粉碎条件下豆渣蛋白的Peak a相对荧光强度高于其他处理方式,随着低温粉碎程度的不断加深,蛋白荧光强度呈现先上升后下降的变化趋势。研究指出,与未处理相比,常温及低温超微粉碎产生的高剪切作用使得蛋白粒径减小,比表面积增加,豆渣蛋白聚合程度增强,导致瑞利光散射作用增强,从而使得这两个散射峰的荧光强度增强[35]。高速剪切作用过程中对豆渣蛋白存在温度效应,温度升高使部分豆渣蛋白变性,蛋白结构发生解折叠,导致分子间作用力下降,故常温粉碎下豆渣蛋白Peak a峰处荧光强度低于低温处理条件。而对比低温超微粉碎100、200、300目可知,随着低温超微目数的增加豆渣蛋白的瑞利衍射峰a相对荧光强度均有提高,这可能是由于,分子碰撞作用增强使得豆渣蛋白形成部分大粒径的可溶性蛋白聚集体,增强光散射效果,表现出更强的瑞利衍射峰[36]。当粉碎目数达到200目后,这种分子碰撞停止,故粉碎程度继续加深,荧光强度反而下降。粉碎目数100、200、300目低温超微粉碎处理下豆渣蛋白的荧光特征峰1强度分别为853.6、905.0、900.5,由此可知,随着豆渣蛋白分子间碰撞作用增强,分子间的相互作用逐渐减弱,氢键作用逐渐减小,故荧光强度呈上升趋势变化;而当粉碎程度达到200目时,豆渣蛋白分子间碰撞作用停止,粉碎程度继续增加使得部分豆渣蛋白变性,蛋白结构发生解折叠,分子内疏水性氨基酸暴露。另发现,常温超微粉碎处理对豆渣蛋白交互作用的促进作用强于低温超微粉碎处理,这与高速剪切作用过程中对豆渣蛋白的温度效应有关。
此外,未处理下豆渣蛋白荧光特征峰2荧光强度为380.5,在常温及200目低温超微粉碎处理下豆渣蛋白特征峰2荧光强度分别提高至626.5、603.2。这是由于高剪切力处理下的豆渣蛋白疏水基团逐渐暴露所致。而低温超微粉碎作用下,豆渣蛋白特征峰2荧光强度均有所降低,表明豆渣蛋白分子间作用降低,促使“暴露”态疏水性氨基酸重新包埋在分子内部。
3 结论
本研究对比未处理、常温超微粉碎及低温超微粉碎(100、200、300目)下豆渣蛋白样品的粒径分布、体积平均粒径D[4,3]、ζ-电位绝对值、界面性质及溶解性等功能性质发现,在低温粉碎200目下,豆渣蛋白性质最佳;基于二维荧光光谱红移现象结合三维荧光特征峰强度变化证明,低温超微粉碎使豆渣蛋白结构发生解折叠,蛋白分子内疏水性氨基酸暴露,另外,高速剪切过程中的分子碰撞作用及温度效应变化有效支撑不同处理条件下豆渣蛋白的功能性变化。
