遮阴处理对茶树叶色表型及生化成分的影响
2018-12-10,,
,,
(1.贺州学院,广西贺州 542899; 2.福建农林大学安溪茶学院,福建泉州 362400; 3.福建农林大学园艺学院,福建福州 350002; 4.闽台特色作物病虫害生态防控协同创新中心,福建福州 350002; 5.福建省茶产业工程技术研究中心,福建福州 350002)
光照对花青素合成相关结构基因的影响已有大量研究[3-6]。研究表明,光照是影响月季花变色的重要环境因子,遮光阻碍了花青素的合成,降低了CHS基因的表达,导致花冠不能正常着色[7]。山川紫甘薯叶片的CHI基因受到光信号的诱导,光的强度越大,基因的表达量越高[8]。在强光诱导下,拟南芥中的F3H基因表达量上调;弱光下,该基因表达量下调[9]。目前,光照对紫叶茶树叶色表型的机理尚不清晰。
本试验通过对紫叶茶树进行遮阴处理,诱导叶色变异;测定不同处理下各样本中的叶绿素相对含量、茶多酚、儿茶素组分、黄酮总量及组分、总花青素苷的含量,分析其对叶色表型及生化成分的影响。这一问题的解答对解析光照调控紫叶茶树叶色表型及理化成分的含量有着理论价值。
1 材料与方法
1.1 材料与仪器
试验材料为武夷奇种C18 由福建省武夷山市茶叶研究所资源圃提供;花青素(纯度>97%)、山奈酚(纯度 97.7%)、杨梅素(纯度95%)、槲皮素(纯度 95%)标准品 美国ChromaDex公司;表没食子儿茶素(epigallocatechin,EGC,纯度>99%)、表儿茶素(epicatechin,EC,纯度>99%)、表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG,纯度>99%)、儿茶素(catechin,C,纯度>99%)、表儿茶素没食子酸酯(epicatechin gallate,ECG,纯度>99%)、没食子儿茶素没食子酸酯(gallocatechin gallate,GCG,纯度>99%)、咖啡碱(纯度>99%)标准品 美国Sigma公司;福林酚、磷酸、甲醇、碳酸钠、茚三酮、三氯化铝、磷酸氢二钠、磷酸二氢钾(分析纯)、甲醇、乙腈(色谱纯) 国药化学试剂有限公司。
FA1004型电子天平 北京赛多利斯天平有限公司;722S型可见分光光度机 北京瑞利分析仪器有限公司;e2695型高效液相色谱仪、2998型PDA检测器 美国Waters公司;植物粉碎机 天津泰斯特仪器有限公司;HH-4型数显恒温水浴锅 国华电器有限公司;TDL-40B离心机 北京亚力恩科学器材公司;DHG-9123A 型电热鼓风干燥箱 上海精宏实验设备有限公司;NF333型色差仪 Nippon Denshoku Industries Co. Ltd.,Japan。
1.2 实验方法
1.2.1 遮阴处理 试验在福建省武夷山市茶叶研究所资源圃中完成。2015年4月中旬,挑选生长发育良好、整齐一致、树形基本相似的植株27株,分为3组(每9株为1组,每重复3株),挂牌标记,并对其进行同一高度的修剪。待茶树芽头萌动之时,开始遮阴处理。根据前期研究结果设2个处理:分别用遮阴75%和60%的黑色遮阳网遮光,以全光照处理为对照。经过15 d的遮阴处理,取经遮阴处理和全光照处理(CK)的武夷奇种C18叶片(第一叶位),参考GB/T 8303-2013 《茶 磨碎试样的制备及其干物质含量测定》,采用120 ℃烘干固样,得到叶片粉末,分装于不同的自封袋,并做好标记。
1.2.2 叶色表型分析 用NF333型色差仪测定叶片CIEL*a*b*值,使用色差仪以光源C/2 °为条件测量叶片的颜色,取叶片正面,平置于干净的白纸上,将集光口对准叶片中部位置进行测量,最终取5个测量的平均值,数据经Excel 2007分析。
1.2.3 叶绿素相对含量的测定 对“武夷奇种C18”进行不同程度的遮阴处理,15 d后,用SPAD-502叶绿素仪测定鲜叶(第一叶位)叶绿素相对含量,分别在叶片的上、中、下部位测定,每个部位重复6次,结果取3个部位的平均值。
脑卒中是严重威胁人类生命健康的常见病之一,也是发病率、致残率、致死率极高的危险疾病,给病人及家庭造成严重的经济及精神负担[11]。家庭照顾者是脑卒中病人家庭康复照护主力,其优质的照护服务对脑卒中病人病情恢复和生活质量提高具有重要作用。但长时间的护理照顾会使照顾者产生巨大的精神压力,诱发照顾者各种负性情绪。陈军军[2]研究发现:脑卒中家庭照顾者中35.9%有抑郁症状,53.2%有焦虑症状,较高的照顾者负性情绪不仅不利于照顾者身心健康,还可引发照顾者流失率增高、照顾质量下降,甚至发生病人虐待现象。
1.2.4 花青素苷总量的测定
1.2.4.1 花青素标准曲线的绘制 准确配制质量浓度为0.50 mg/mL的花青素标准溶液,分别吸取0、0.1、0.2、0.3、0.4、0.5 mL置于6支10 mL具塞比色管中,各加入甲醇溶液至1.0 mL,然后加入6.0 mL正丁醇-盐酸溶液(体积比为95∶5)和0.2 mL质量分数为2%的硫酸铁铵溶液,摇匀后,置沸水浴中加热40 min,然后迅速冷却,在波长400~680 nm处进行扫描,确定其最大吸收波长657 nm,于最大吸收波长处测定花青素标准溶液吸光度,得到标准曲线方程。
1.2.4.2 叶片粉末花青素含量的测定 先用无水乙醇和浓盐酸配制0.1 mol·L-1的盐酸乙醇溶液,然后分别取不同处理叶片粉末各1.000 g,放入回流装置中,再加入20 mL的盐酸乙醇溶液,在60 ℃的水浴锅中浸提回流60 min。回流结束后,将提取液倒入25 mL的容量瓶中,定容到25 mL。以0.1 mol·L-1的盐酸乙醇溶液作为参比液,在分光光度计下测定提取液在530、657 nm的吸光值[10]。
1.2.4.3 花青素含量的计算 花青素含量(mg/g)=(OD530-0.25×OD657)/M
式中:OD530:花青素在530 nm波长下的光密度;OD657:花青素在657 nm波长下的光密度;M:取样质量。
1.2.5 叶片粉末茶多酚总量、儿茶素组分的测定 参照国标GB/T 8313-2008茶叶粉末中茶多酚和儿茶素类含量的检测方法。
1.2.6 叶片粉末黄酮总量及黄酮苷元的测定 黄酮总量测定采用三氯化铝比色法:称取1.2得到的茶叶粉末1.00 g于100 mL三角瓶中,加沸蒸馏水40 mL,置水浴锅中浸提30 min,过滤到50 mL容量瓶,加水定容,摇匀为供试液。吸取供试液0.5 mL,加1%三氯化铝溶液至10 mL,摇匀10 min后移入1 mL比色皿,用水代替茶汤作为空白试验,在波长420 nm处测其吸光度。
1.2.6.1 黄酮苷元的测定方法 参考李家华等[11]建立的液相色谱法。色谱柱:TSK gel ODS-80TM色谱柱(4.6 mm×250 mm,5 μm)。流动相:A相:0.2%磷酸水溶液;B相:100%甲醇。梯度从30%B到80% B,流速0.8 mL/min,55 min内完成,检出波长360 nm,柱温40 ℃,进样量10 μL,每一次完成后系统平衡10 min后再次进样。每个样品6次重复。
1.2.6.2 黄酮苷元标准液的制备 分别精密称取杨梅素、槲皮素和山柰酚对照品适量,加甲醇制成每1 mL含0.3 mg的溶液,作为对照品溶液。精密吸取3种对照品溶液1 mL置10 mL的容量瓶中,加甲醇至刻度,作为混合标准储备液溶液。分别取杨梅素、槲皮素和山柰酚对照品溶液用甲醇稀释得到0.06、0.12、0.18、0.24、0.3 mg/mL的系列标准使用液。用封口膜密封后置冰箱中冷藏备用。
1.2.6.3 黄酮苷元供试品溶液的制备 用水浴加热回流装置制备供试品溶液。将1.2.1得到的茶叶粉末,精确称取粉末1.00 g,加甲醇40 mL,盐酸4 mL,置于圆底烧瓶中回流水解1.5 h(85 ℃),过滤,滤液置50 mL容量瓶,用少许甲醇洗涤残渣及容器,洗涤液并入容量瓶中,加甲醇定容至刻度,摇匀,用微孔滤膜(0.45 μm)过滤,即得。
1.3 数据处理
本试验中各数据均为个独立重复试验的平均值±标准差。试验数据采用SPSS 20.0数据统计软件进行方差分析。
2 结果与分析
2.1 不同遮阴处理下紫叶茶树叶片的表型特征
“武夷奇种C18”在不同遮阴处理下,叶片的表型特征发生了变化(如表1)。用色差仪NF333 测定发现,+a*到-a*的转变意味着红紫色减退,绿色增强,-b*到+b*的变化代表了蓝色逐渐消退,黄色增强。与CK相比,75%遮阴叶片的红紫度减退,蓝度降低,即呈更弱的着色(如图1)。结果表明,光照越强,叶片的呈色越紫。这是由于,强光促使花青素合成途径的结构基因的表达上调,从而使花青素的含量增加。

表1 不同遮阴处理下叶片的表型特征Table 1 Phenotypic characteristics of leaves under different shading treatments
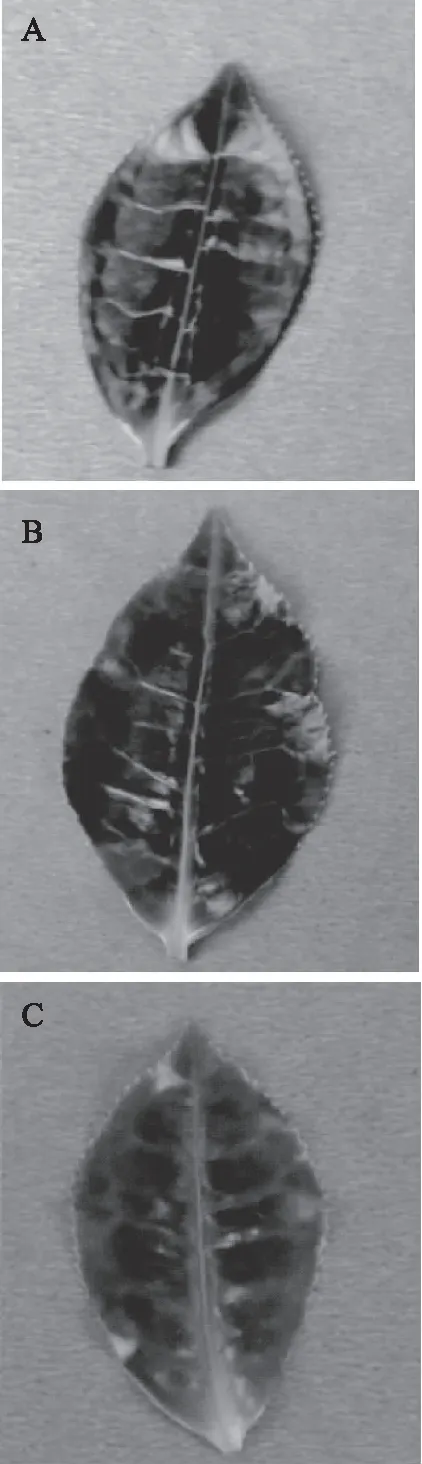
图1 不同遮阴处理下茶树叶片(第一叶位)Fig.1 Tea leaves(first leaf position) under different shading treatments注:A:CK;B:60%遮阴;C:75%遮阴。
2.2 不同遮阴处理对紫叶茶树叶片叶绿素相对含量的影响
“武夷奇种C18”在不同遮阴处理下,叶片的叶绿素相对含量发生了变化(如图2)。图2的检测结果表明,正常光照下,叶绿素相对含量较低,75%遮光下的叶绿素相对含量最高,不同遮阴处理下叶绿素相对含量差异达到显著水平(p<0.05)。

图2 不同遮阴处理对叶片叶绿素相对含量的影响Fig.2 Effect of different shading treatments on the relative content of chlorophyll in leaves注:不同小写字母表示差异显著(p<0.05);图3、图4、图6同。
2.3 不同遮阴处理对紫叶茶树叶片花青素苷总量的影响
为研究光照强弱对紫叶茶树叶片呈色的影响,设置不同遮阴处理,检测其花青素苷总含量(图3)。结果表明,光照越强,花青素苷总含量越高;光照越弱,花青素苷总含量越低。且不同遮阴处理下花青素苷总量差异达到极显著水平(p<0.01)。这一结果与观测到的叶片表型特征一致。这是由于,强光促使花青素合成途径的结构基因的表达上调,从而使花青素的含量增加。弱光则抑制花青素合成途径,结构基因表达下调,花青素含量降低。
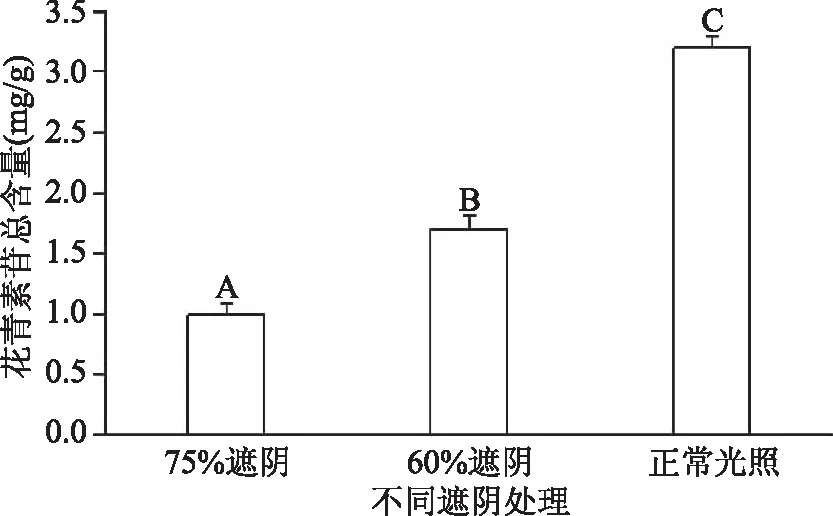
图3 不同遮阴处理对紫叶茶树叶片花青素苷总含量的影响Fig.3 Impact on the total content of anthocyanin purple leaf tea leaves of different shading treatments注:不同大写字母表示差异极显著(p<0.01)。
2.4 不同遮阴处理对茶树叶片茶多酚总量的影响
花青素苷是植物新陈代谢过程中产生的类黄酮物质,是类黄酮途径的一个分支途径。儿茶素属于黄烷醇类化合物,是茶叶中多酚类物质的主体成分。这些物质除了同属于类黄酮途径,还是茶叶当中的主要功能性成分,同时也能解析光照强弱对茶叶主要功能性成分含量的影响。
“武夷奇种C18”在不同遮阴处理下,叶片的茶多酚含量发生了变化(图4)。从图4可看出,未经过遮阴处理的CK组的茶多酚含量最高。与对照组相比,60%遮阴程度的处理组茶多酚含量减少了17.81%,75%遮阴处理组则减少了25.54%。且不同遮阴处理下茶多酚含量差异达到显著水平(p<0.05)。结果表明,光照较强,茶多酚含量较高;随着遮阴程度的加深,茶多酚含量减少。这与阎意辉等[12]研究遮阴处理对云抗10号茶树新梢的影响结果是一致的。

图4 不同遮阴处理对紫叶茶树叶片茶多酚含量的影响Fig.4 Effect of tea polyphenols purple leaf blades of different shading treatments
2.5 不同遮阴处理对茶树叶片儿茶素组分的影响
“武夷奇种C18”在不同遮阴处理下,叶片的茶多酚含量发生了变化(如图5和表2)。由图5和表2可知,在儿茶素组分中,未遮阴的CK与60%遮阴的酯型儿茶素的总量都要高于非酯型儿茶素,而75%遮阴处理则是非酯型儿茶素总量要略高于酯型儿茶素。从整体来看,EGCG含量较高,其次是EGC、EC与ECG的含量。从TC(总儿茶素)含量可看出,遮阴程度最高的75%遮阴的TC含量最低,为7.6%;未遮阴的CK组含量则最高,为10.91%;数值为遮阴程度居中的60%遮阴含量也位于两者之间,为8.65%。结果表明,光照较强,总儿茶素含量较高;随着遮阴程度的加深,总儿茶素含量减少。这是由于,弱光抑制儿茶素合成途径结构基因的表达,从而使总儿茶素含量减少。

表2 不同遮阴处理对紫叶茶树儿茶素组分含量的影响(%)Table 2 Effect of different shading treatments on content of purple leaf tea catechin component(%)
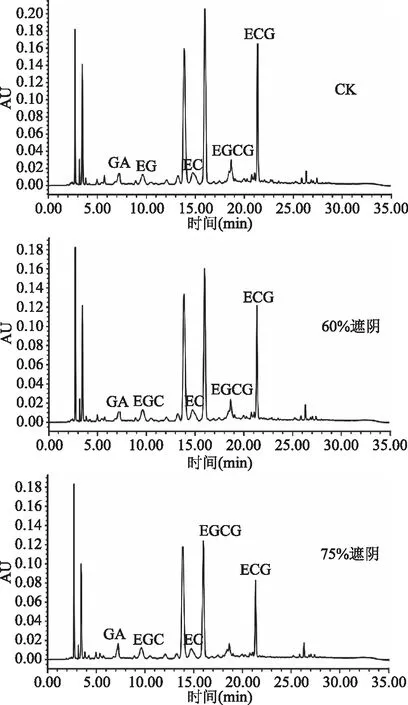
图5 不同遮阴处理下紫叶茶树儿茶素组分图Fig.5 Purple leaf tea catechin components of different shading treatments
2.6 不同遮阴处理对茶树叶片黄酮总量及组分的影响
“武夷奇种C18”在不同遮阴处理下,叶片的黄酮总量发生了变化。从图6可以看出,随着遮阴程度的加深,武夷奇种C18幼嫩新梢中的黄酮总量也呈下降趋势。且不同遮阴处理下黄酮总量差异达到显著水平(p<0.05)。与CK对照组相比,60%遮阴处理的减少了14.36%,75%遮阴处理的则减少了29.08%。结果表明:黄酮总量会随着遮阴程度加深而减少。这是由于弱光抑制黄酮合成途径结构基因的表达,从而使黄酮总量减少。

图6 不同处理对紫叶茶树黄酮苷总量的影响Fig.6 Different treatments on the total amount of purple leaf tea flavonoid glycosides
测定水解后不同处理下紫叶茶树中含量较高的3种黄酮苷元杨梅素、槲皮素、山奈酚(图7和表3),从图7和表3可以发现未遮阴的CK组的杨梅素、山奈酚、槲皮素等组分含量居于三组之最,遮阴程度最深的75%遮阴组的各组分含量则是三组最低的。结果表明,黄酮组分含量会随着遮阴程度加深而减少。这是由于,弱光抑制黄酮合成途径中FHT结构基因的表达,从而使杨梅素、山奈酚、槲皮素组分含量减少。

图7 不同遮阴处理下紫叶茶树黄酮组分图Fig.7 Purple leaf tea flavonoid component diagram under different shading treatments

表3 不同遮阴处理对紫叶茶树黄酮组分的影响(mg/g)Table 3 Effect of different shading treatments on purple leaf tea flavonoid component(mg/g)
3 讨论与结论
花青素是决定茶树叶片颜色的主要色素,属于茶树次生代谢产生的类黄酮化合物[13]。目前已知茶叶中主要含有3种花青素[14-17],花青素在细胞中合成,但在液泡中积累,产生的颜色从红到紫[18-20]。其中,矢车菊色素是紫红色;飞燕草色素和锦葵色素是紫色。在茶树叶片细胞中合成的花青素在液泡转运蛋白GST等转运因子作用下运输到液泡中[14]。最后在内因和外因共同作用下,茶树叶片呈现紫色或红紫色。迄今为止,花青素苷合成的关键结构基因已从茶树中分离获得[21-28]。光照对茶树花青素合成途径相关基因的影响已有报道。对新梢白化茶树品种“黄金芽”进行遮阴处理,结果抑制了CHS3基因的表达[29]。但是对于光照这个重要环境因子影响紫叶茶树叶色表型的机理尚不清晰。
本研究将紫叶茶树进行不同程度的遮阴处理,结果表明,伴随着遮阴程度的加深,紫叶茶树叶片中叶绿素相对含量呈逐渐上升的趋势,75%遮阴条件下叶绿素相对含量最高;而花青素苷含量呈现出下降的趋势,正常光照条件下(CK)总花青素苷含量最高。这与金鱼草、矮牵牛和非洲菊[30-32]等植物中的研究结果相似。这说明光照强弱和着色有着密切的关系,光照增强,叶片呈深紫色,即叶片能够正常着色;光照减弱,叶片呈淡紫色、绿色或呈白色,即叶片不能够正常着色,这可能受到共同的上游途径调控。随着遮阴程度的加深,紫叶茶树叶片中茶多酚、儿茶素组分、黄酮总量及组分都呈现出下降的趋势,正常光照条件下(CK)这些含量最高。这与阎意辉[12]等人的研究结果相似。
本研究解析了紫叶茶树叶片在不同遮阴处理下主要生化成分的变化:光照越强,茶多酚、儿茶素组分、黄酮总量、黄酮组分、总花青素苷的含量越高,反之,则越低。但要阐明光照调控紫叶茶树叶片中花青素苷合成与呈色的机理,还需要进行大量的工作。比如进一步研究紫叶茶树叶片中花青素苷合成途径对光信号响应的分子途径;通过比较不同光照条件下基因表达模式和花青素苷含量的差异,找出关键的结构基因;进一步克隆相关基因的启动子片段,为深入解析光照诱导紫叶茶树叶色变异的分子机理提供参考。
