富含蛋氨酸醇溶蛋白在产朊假丝酵母中的表达研究
2018-12-10其布日萨初拉苏少锋王蕴华刘红葵吴青海
其布日,萨初拉,苏少锋,高 娃,王蕴华,刘红葵,吴青海,呼 和
(内蒙古自治区农牧业科学院生物技术研究中心,内蒙古 呼和浩特 010031)
在绝大多数日粮情况下,蛋氨酸和赖氨酸是奶牛泌乳和乳蛋白合成的主要限制性氨基酸,在以玉米青贮为基础的日粮中,蛋氨酸是乳汁和乳蛋白合成的第一限制性氨基酸[1-2]。国内外研究表明,奶牛补充过瘤胃保护蛋氨酸能增加产奶量[3-9],提高乳中乳蛋白[10-11]、乳脂肪[8,11]及总固形物含量[12]。此外,蛋氨酸作为反刍动物的重要限制性氨基酸,在充分发挥动物生产潜能,降低粪、尿氮排放等方面起着巨大作用[13]。
产朊假丝酵母(Candida utilis,C.utilis)是国家卫生健康委员会规定的可用于保健食品的11种真菌菌种之一,其既有酵母菌的优良特性,又可应用于食品加工行业和畜牧业生产当中。酵母菌制剂的应用不仅可以节约生产成本,减少疾病发生,而且可以提高经济效益,有利于获得高品质的食品、畜牧产品以及口服药品等[14]。随着对产朊假丝酵母研究的深入,产朊假丝酵母表达系统也不断成熟。在抗性标记的选择方面,产朊假丝酵母基因组中存在一段L41基因,该基因属放线菌酮(cycloheximide,CYH)敏感性基因。研究表明,对L41基因第56位氨基酸密码子的一个碱基进行突变即可获得CYH抗性基因,这为构建产朊假丝酵母整合型表达载体提供了便利[15]。GAP-p(三磷酸甘油醛脱氢酶启动子)是一种组成型强启动子,已从产朊假丝酵母中成功克隆[16]。产朊假丝酵母没有稳定的附加质粒,因此,采用整合型载体将外源基因整合到染色体中是产朊假丝酵母引入外源基因的主要方式。使用重复序列(rDNA)作为整合载体同源位点是提高外源基因在酵母基因组中拷贝数的有效途径[17-18]。有学者研究表明,产朊假丝酵母是表达异源蛋白的有效宿主[19-20]。
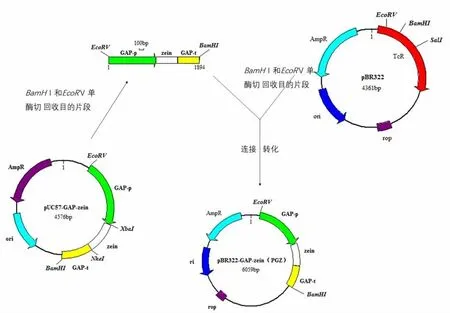
图1 重组质粒pBR322-GAP-zein(PGZ)构建技术路线
玉米胚乳中的玉米醇溶蛋白(zein)是天然存在的稳定型蛋白,富含含硫氨基酸(含有20%的蛋氨酸),其中以δ-10kD型玉米醇溶蛋白的含量最高,并且该蛋白在反刍动物的瘤胃中不被降解且具有肠溶性[21],可以巧妙地达到过瘤胃保护的目的。近年来,δ-10kD型玉米醇溶蛋白基因在植物中表达的研究报道较多[22-26],但在微生物中表达的研究报道较少[27-29],尤其尚未见在产朊假丝酵母中表达的研究报道。该研究采用同源重组技术将zein基因表达盒整合到产朊假丝酵母的染色体上,构建表达zein蛋白的产朊假丝酵母工程菌,为解决奶牛日粮中主要限制性氨基酸不平衡,改善奶牛蛋白饲料利用率,提高奶牛生产性能提供新思路。
1 材料与方法
1.1 试验材料
1.1.1 产朊假丝酵母菌株:购自中国工业微生物菌种保藏管理中心,编号为CICC 1769;大肠杆菌感受态细胞Trans-T1购自北京全式金生物有限公司;pMD19-T克隆载体购自宝生物工程(大连)有限公司。
1.1.2 培养基:YPD培养基,配方为1%酵母粉、2%蛋白胨、2%葡萄糖 (固体培养基琼脂含量为1.5%)。
1.1.3 主要试剂:山梨醇,购自北京索莱宝科技有限公司;山梨醇Buffer:用0.1 mol/L磷酸钠缓冲液(pH值=7.4)配制1.2 mol/L山梨醇溶液;0.1 mol/L磷酸钠缓冲液 (pH值=7.4)的配制:77.4 mL 0.1 mol/L Na2HPO4溶液+22.6 mL 0.1 mol/L NaH2PO4溶液;放线菌酮(CYH)购自Sigma-Aldrich公司;酵母转化试剂盒YeastmakerTMYeast Transformation System 2购自宝日医生物技术(北京)有限公司;Lyticase、质粒小提试剂盒、酵母基因组提取试剂盒购自天根生化科技(北京)有限公司;试验中用到的内切酶购自NEB(北京)有限公司。
1.2 试验方法
1.2.1 zein基因密码子的优化及表达盒的拼接合成:在NCBI中查找δ-10kD-醇溶蛋白基因序列、酵母3-磷酸甘油醛脱氢酶启动子(GAP-p)和终止子(GAP-t)序列,由基因合成公司(苏州金唯智生物科技有限公司)进行zein基因密码子偏爱性及相关参数的优化后,将启动子(GAP-p)和终止子(GAP-t)序列与优化过的zein基因序列进行拼接合成,然后在两端加入设计好的酶切位点,构建表达盒(GAP-p)-zein-(GAP-t)。
1.2.2 含有zein基因表达盒的整合载体的构建:提取含(GAP-p)-zein-(GAP-t)表达盒的 pUC57和pBR322质粒,分别用EcoRⅤ和BamHⅠ进行酶切,回收目的片段。用T4 DNA连接酶将片段进行连接,获得质粒 pBR322-GAP-zein(PGZ)(见图1),同时加入设计好的酶切位点,然后对重组质粒进行酶切和测序鉴定。
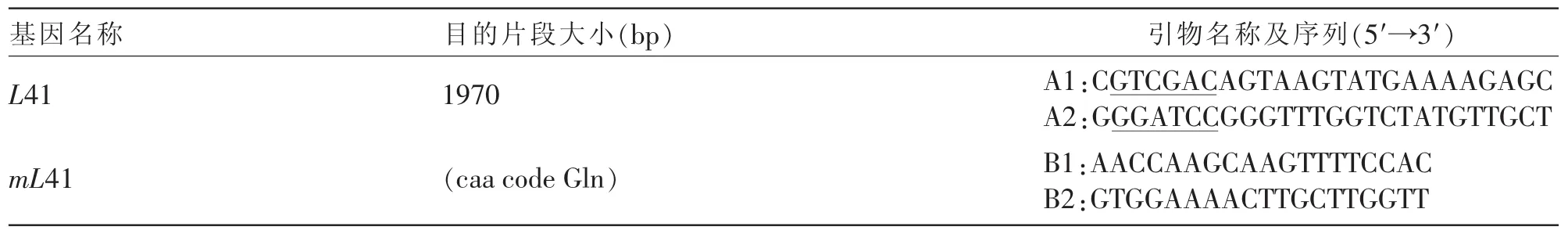
表1 PCR引物信息[30]
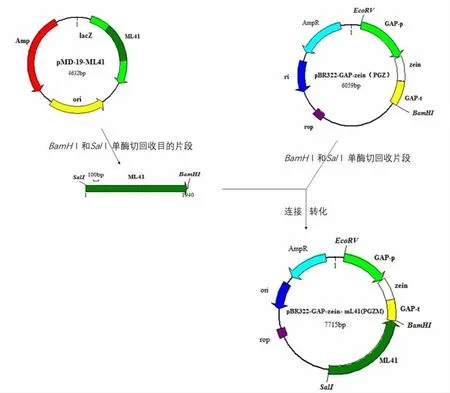
图2 重组质粒pBR322-GAP-zein-mL41(PGZM)构建技术路线
1.2.3 含有放线菌酮抗性基因的整合载体的构建
1.2.3.1 放线菌酮基因的点突变:复苏扩增产朊假丝酵母后提取其基因组,进行重叠PCR试验。以基因组为模板,以A1/B2,B1/A2为引物 (见表1)进行PCR扩增,对2组PCR产物进行胶回收,再以2组回收产物为模板进行PCR试验,PCR产物胶回收后进行加A反应,将目的基因与pMD19-T 载体进行连接[30],转化大肠杆菌后,筛选阳性克隆子,重组子培养扩增,提取质粒酶切鉴定后将阳性克隆子进行核苷酸序列测定 (由南京金斯瑞生物科技有限公司完成)。利用生物信息学软件将所得序列和NCBI发布的序列进行比对分析。
1.2.3.2 含有放线菌酮抗性基因的整合载体的构建:将目的基因载体pMD19-T-mL41质粒和pBR322-GAP-zein(PGZ)载体酶切,回收与纯化后,将目的基因mL41与载体pBR322-GAP-zein(PGZ)进行连接,构建pBR322-GAP-zein-mL41(PGZM)载体(见图2)。转化大肠杆菌后,筛选阳性克隆子,培养扩增,提取质粒酶切鉴定后,将阳性克隆子进行核苷酸序列测定。利用生物信息学软件将所得序列和NCBI发布的序列进行比对分析。
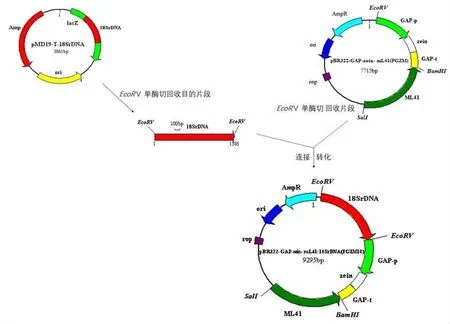
图3 重组质粒pBR322-GAP-zein-mL41-18S rDNA(PGZM18)构建技术路线
1.2.3.3 产朊假丝酵母放线菌酮抗性试验:用无水乙醇溶解放线菌酮(CYH),配制母液浓度为50 mg/mL的 CYH 溶液, 然后配制加入 5、10、15、20 μg/mL放线菌酮的YPD培养基,将产朊假丝酵母用0.9%生理盐水稀释104倍后进行涂布培养,观察菌落生长状况。
1.2.4 同源重组表达载体的构建:以产朊假丝酵母基因组为模板,扩增克隆18S rDNA序列[26],回收与纯化目的基因PCR产物,加A反应后与pMD19-T载体连接。将载体pBR322-GAP-zeinmL41和目的基因载体pMD19-T-18S rDNA质粒酶切后,进行回收与纯化,对载体进行去磷酸化处理,目的基因18S rDNA与载体pBR322-GAP-zein-mL41(PGZM)进行连接,构建 pBR322-GAP-zein-mL41-18S rDNA(PGZM18)载体(见图 3),对载体进行酶切和测序鉴定。
1.2.5 构建含zein基因的产朊假丝酵母基因工程菌:提取大肠杆菌中的酵母表达载体质粒PGZM18,用NcoⅠ进行单酶切,酶切产物胶回收,制备产朊假丝酵母感受态细胞,将酶切回收产物用LiAC试剂方法转化到产朊假丝酵母中,同源整合到染色体上。将转化子涂布到含有CYH的YPD平板上28℃培养3~5 d。将酵母重组子扩增培养后提取酵母基因组,用目的基因zein引物进行PCR鉴定和测序鉴定。
1.2.6 液相色谱法测定产朊假丝酵母工程菌中的蛋氨酸含量:将未转化目的基因的产朊假丝酵母与转化目的基因的产朊假丝酵母分别设为对照组和试验组,分别在YPD和含放线菌酮的YPD培养基中过夜培养后,离心菌液收集沉淀,用液相色谱仪测定2组样品中的蛋氨酸含量。
2 结果与分析
2.1 δ-10kD-醇溶蛋白基因(zein)序列的获得
将δ-10kD-醇溶蛋白基因(GenBank登录号:NM_001111585.1)原始序列进行优化。使用OPTIMWIZ和GENEWIZ软件提供的基因密码子优化工具进行分析。由图4可知,经OPTIMWIZ分析处理后,CAI从0.65提高至0.96;GC含量和不利的山峰被优化,mRNA的半衰期被延长;二级结构以及影响核糖体mRNA的绑定和稳定的结构也被移除。根据优化后的zein基因序列合成基因。
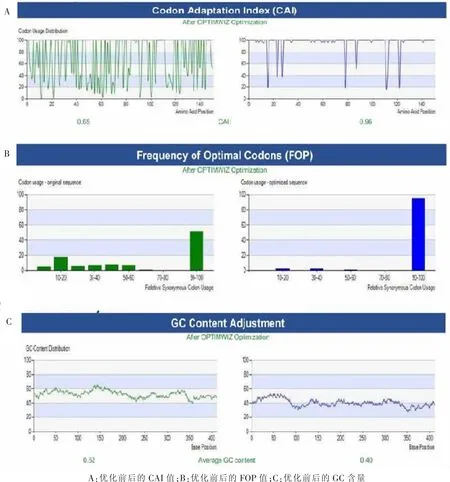
图4 zein基因密码子优化前后的CAI值、FOP值和GC含量
2.2 同源整合表达载体的构建和鉴定
分别对利用pUC57-GAP-zein和pBR322质粒构建的重组载体pBR322-GAP-zein(PGZ),利用 pBR322-GAP-zein(PGZ)和 pMD19-T-mL41 构建的重组载体pBR322-GAP-zein-mL41(PGZM),利用 pBR322-GAP-zein-mL41(PGZM)和 pMD19-T-18S rDNA构建的重组载体pBR322-GAP-zeinmL41-18S rDNA(PGZM18)进行酶切鉴定,并对回收后的目的片段进行测序鉴定,结果显示,同源整合表达载体构建成功(见图5)。
2.3 产朊假丝酵母放线菌酮抗性试验
设置3个平行试验组(A、B、C组),观察产朊假丝酵母菌对不同浓度放线菌酮的敏感性,确定其对放线菌酮的敏感浓度临界值。由表2可知,产朊假丝酵母菌抗放线菌酮敏感浓度临界值为20 μg/mL,以该浓度作为后续试验放线菌酮工作浓度。
2.4 产朊假丝酵母重组子鉴定
将构建成功的PGZM18表达载体同源重组到产朊假丝酵母的染色体上,获得含有目的基因zein的产朊假丝酵母菌株,然后提取重组酵母菌株基因组进行zein目的基因PCR鉴定和测序鉴定。结果显示,zein基因被成功整合到产朊假丝酵母染色体上(见图6),提示含zein基因的产朊假丝酵母基因工程菌构建成功。
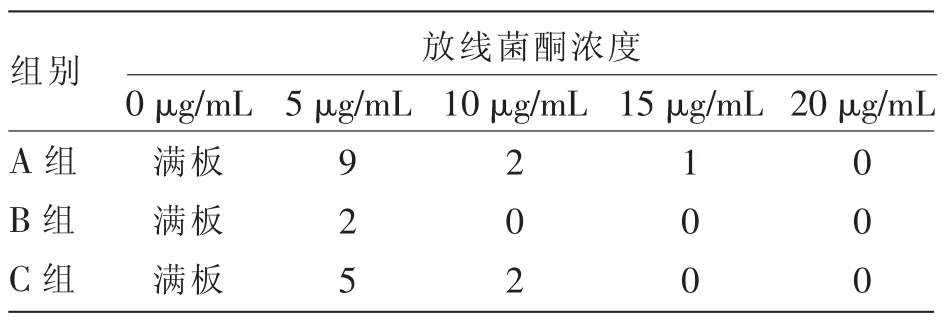
表2 不同放线菌酮浓度处理下酵母菌单菌落数量 个

图5 重组载体酶切鉴定结果
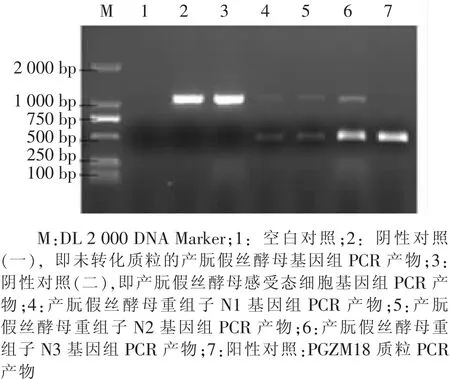
图6 酵母重组子PCR鉴定结果
2.5 基因工程产朊假丝酵母中的蛋氨酸含量测定
以未转化zein基因的产朊假丝酵母菌为对照组,以转化zein基因的重组产朊假丝酵母菌为试验组,测定并比较二者的蛋氨酸表达量。由图7及表3可知,试验组的蛋氨酸含量比对照组提高0.24 g/kg(17.14%)。
3 讨论
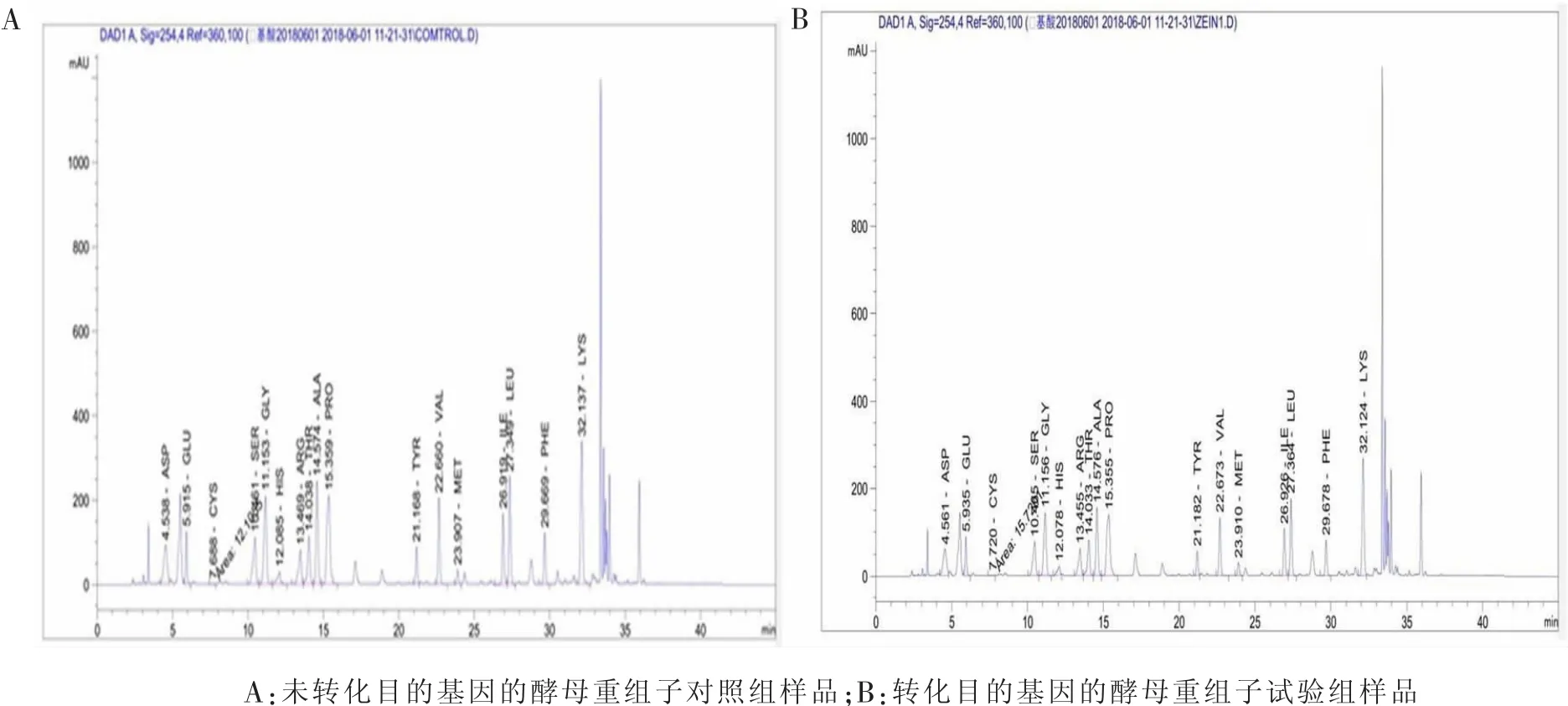
图7 液相色谱法测定氨基酸含量结果

表3 蛋氨酸含量测定结果 g/kg,%
该试验采用基因工程技术,将玉米δ-10kD-醇溶蛋白基因(zein),酵母的 GAP 启动子(GAP-p)、终止子(GAP-t)拼接合成表达框,以18S rDNA片段为整合介导区,应用放线菌酮(CYH)抗性基因作为筛选标记,结合pBR322质粒构建了同源整合表达载体,把zein基因同源重组整合到产朊假丝酵母染色体上,构建表达zein蛋白的产朊假丝酵母工程菌株。蛋氨酸含量测定结果显示,重组菌株比起始菌株提高了17.14%,接近枯草芽胞杆菌的蛋氨酸表达量[29],但是相较于重组产朊假丝酵母乙醇的产量 29.2 g/L[31]、异丙醇的产量 9.5 g/L[32]还有较大的差距。虽然构建的产朊假丝酵母工程菌产蛋氨酸量比较低,但也为下一步提高其蛋氨酸的产量研究打下了良好的基础。下一步应对产朊假丝酵母工程菌的关键调控基因进行系统的研究,包括提高启动子的强度、增加目的基因的拷贝数量、引入信号肽基因及转化方法等。
