甲状腺乳头状癌组织中CELF1表达及其功能研究
2018-12-07金沅武
金沅武,赵 媛
(山东省淄博矿业集团有限责任公司中心医院 肿瘤血液科,山东 淄博 255120)
乳头状癌(papillary thyroid carcinoma,PTC)是最为主要的甲状腺癌病理学类型,约占90%以上,具有多灶性生长及局部淋巴结转移的特点,是导致部分患者复发及预后不佳的主要因素[1]。CELF1也称为CUG连接蛋白1(CUG-binding protein 1,CUGBP1),是RNA连接蛋白CELF家族重要成员之一,在调控mRNA翻译、降解过程中发挥关键性作用[2],近年来研究发现其与恶性肿瘤发生、进展关系密切,与非小细胞肺癌患者不良预后有关[3],参与了膀胱癌BIU-87细胞增殖和侵袭过程[4]。本研究拟分析PTC组织中CELF1表达,并探讨其对PTC细胞增殖和侵袭能力的影响。
1 资料与方法
1.1 临床资料 选取2015年3月~2016年12月在我院择期行根治性手术治疗的PTC患者78例,纳入标准:①首发初次手术;②术前未接受任何治疗;③术后病理检查确诊为PTC。男29例,女49例,年龄30~65岁,平均年龄(47.8±10.4)岁。将手术中获得的PTC组织及癌旁组织用甲醛固定,石蜡包埋保存。本研究通过医院伦理委员会批准,所有患者或家属均知情同意。
1.2 主要试剂和设备 免疫组化试剂盒购自北京中杉金桥生物,兔抗人CELF1多克隆抗体购自美国Abcam,人PTC细胞株TPC-1购自上海拜力生物科技公司,DMEM培养基、胎牛血清购自美国Gibco公司,Lipofectamin 2000转染试剂盒、总RNA提取试剂盒(Trizol法)购自美国Invitrogen公司,CELF1干扰序列及对照序列均由上海吉玛制药技术有限公司设计合成,CELF1和内参引物由上海生工生物公司设计合成,CCK-8细胞增殖检测试剂盒购自上海拓然生物科技公司,Transwell小室、Matrigel基质胶购自美国BD公司,荧光定量PCR仪购自美国ABJ公司。
1.3 方法
1.3.1 免疫组化法检测PTC组织和癌旁组织中CELF1蛋白表达 取石蜡包埋组织,切片、脱水,浸入柠檬酸盐中高压抗原修复,用3%过氧化氢封闭。加入一抗兔抗人CUGBP1多克隆抗体(1∶800稀释),4℃过夜孵育,次日复温1 h,PBS冲洗3次,加入通用型二抗,室温下孵育60 min,PBS冲洗3次,二胺基联苯胺显色,苏木素复染,脱水、透明、封片。PBS代替一抗作为对照,光学显微镜观察。结果判定:高倍镜下随机取10个视野,按照半定量法对结果进行判定[5],①染色强度:0分无色;1分淡黄色;2分棕黄色;3分黄褐色;②阳性细胞比例:0分≤5%;1分6%~25%;2分26%~50%;3分51%~75%;4分>75%;③将两项评分相乘,≤1分为阴性(-),>1分为阳性(+)。
1.3.2 细胞培养及分组 用DMEM培养基(含10%胎牛血清)对TPC-1细胞进行培养,培养条件:5% CO2、饱和湿度、37℃恒温培养箱。取对数生长期细胞,胰酶消化,传代培养,待细胞融合度达80%左右时进行分组转染,①CELF1干扰序列组,转染CELF1基因的干扰序列:5′-GAGCCAACCUGUUCAUCUA-3′;②对照序列组,转染干扰序列的对照序列:5′-AAAGGACGGAGGACATTAT-3′;③空白组,不作任何处理。各组转染后继续培养,完成后续实验。
1.3.3 实时荧光定量PCR技术检测细胞中CELF1表达 转染后培养48 h时,取各组细胞,用Trizol试剂对总RNA提取,并分析总RNA浓度,以A260/A280 1.80~2.10为合格,将合格样品逆转录为cDNA,保存于-20℃备用。按照PCR试剂盒说明进行引物扩增,引物序列,CELF1,上游:5′-GCUUUGGUUUUGUAAGUUA-3′;下游:5′-GGCUUAAAGUGCAGCUCAA-3′;GAPDH,上游:5′-TGATGGTACATGACAAGGTGC-3′,下游:5′-ACAGTCCATGCCATCACTGC-3′。PCR条件:94℃ 5 min,94℃ 30 s,60℃ 30 s,70℃ 30 s,连续循环扩增38次,利用2-△△Ct获得各组细胞中CELF1 mRNA相对表达量。
1.3.4 CCK-8法检测细胞增殖能力 取各组转染培养48 h细胞,接种至96孔板,调整密度为2×103个/孔,每组设3个复孔,置于恒温培养箱中贴壁培养4 h。待细胞贴壁后,于培养12、24、48、72、96 h时,分别将CCK-8液10 μL加入各孔,恒温孵育培养3 h。用酶标仪取450 nm波长处测定吸光度A值。
1.3.5 克隆形成实验检测细胞增殖能力 取各组转染培养48 h细胞,制备单细胞悬液,取约500个细胞接种在培养皿中培养14 d至肉眼见到有克隆形成止。除去培养液,加入4%多聚甲醛,固定25 min,PBS冲洗3次,结晶紫染色25 min,用低倍显微镜观察,以超过50个细胞为1个克隆数,计算克隆形成率(%)=克隆数/接种细胞数×100%,重复实验3次。
1.3.6 Transwell小室检测细胞侵袭能力 将Matrigel基质胶稀释后平铺于Transwell小室,37℃风干后使用。将培养48 h细胞消化后,制备细胞悬液,取约2×105个细胞加入到小室上室,将含有20%胎牛血清的培养液约500 μL加入小室,放在恒温培养箱中孵育24 h。将小室取出,除去培养液,PBS冲洗2次,4%甲醛固定,用棉签将未穿膜的散落细胞去除,0.1%结晶紫染色25 min,用倒置显微镜观察。

2 结果
2.1 PTC组织和癌旁组织中CELF1蛋白表达 PTC组织中CELF1蛋白阳性表达率(75.64%)高于癌旁组织(38.46%),差异有统计学意义(χ2=22.002,P=0.000),见图1。
2.2 PTC组织中CELF1蛋白表达与临床病理特征相关性 PTC组织中CELF1蛋白表达与TNM分期、侵犯被膜和淋巴结转移有关(P<0.05),见表1。

A.PTC组织;B.癌旁组织,定位于细胞质,图片标尺为50 μm。
图1 PTC组织和癌旁组织中CELF1蛋白表达
表1 PTC组织中CELF1蛋白表达与临床病理特征的相关性[n(%)]

指标nCELF1蛋白表达+-χ2P年龄/岁 ≥454836(75.00)12(25.00) <453020(66.67)10(33.33)0.6330.426性别 男2921(72.41)8(27.59) 女4935(71.43)14(28.57)0.0090.926肿瘤直径/cm >21814(77.78)4(22.22) ≤26042(70.00)18(30.00)0.4140.520肿瘤数量 单个5843(74.14)15(25.86) 多个2013(65.00)7(35.00)0.6130.434TNM分期 Ⅰ^Ⅱ期5535(63.64)20(36.36) Ⅲ^Ⅳ期2321(91.30)2(8.70)6.1310.013侵犯被膜 是2119(90.48)2(9.52) 否5737(64.91)20(35.09)4.9530.026淋巴结转移 是4339(90.70)4(9.30) 否3517(48.57)18(51.43)16.9090.000
2.3 各组细胞中CELF1基因表达、细胞克隆形成率和细胞侵袭能力 与对照序列组和空白组相比,CELF1干扰序列组细胞中CELF1 mRNA相对表达量降低(P<0.05),见表2;与对照序列组和空白组比较,CELF1干扰序列组细胞克隆形成率降低(P<0.05),见表2、图2。与对照序列组和空白组比较,CELF1干扰序列组侵袭细胞数降低(P<0.05),见表2、图3。


组别CELF1 mRNA相对表达量细胞克隆形成率/%侵袭细胞数/个空白组2.17±0.1475.24±3.53124.96±8.04对照序列组2.20±0.0778.49±5.95122.36±6.07CELF1干扰序列组1.11±0.13ab20.78±4.23ab82.98±8.76abF163.436287.53755.867P0.0000.0000.000
注:与空白组比较,aP<0.05;与对照序列组比较,bP<0.05。
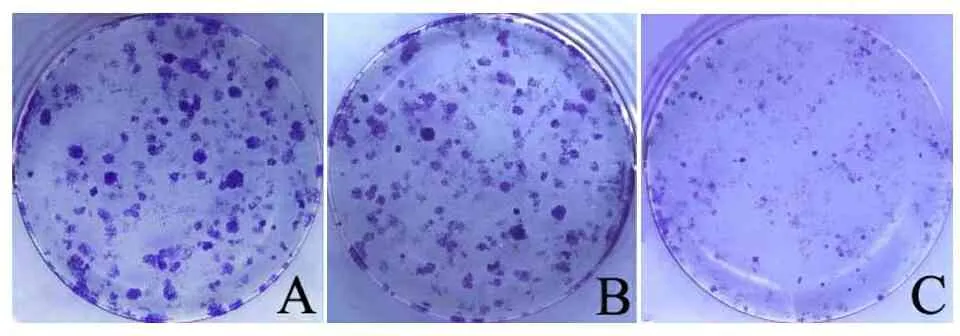
A.空白组;B.对照序列组;C.CELF1干扰序列组。
图2 克隆形成实验检测细胞增殖能力

A.空白组;B.对照序列组;C.CELF1干扰序列组。
图3 Transwell实验检测细胞侵袭能力
2.4 各组细胞增殖能力 与空白组和对照序列组比较 CELF1干扰序列组细胞24、48、72、96 h时吸光度A值均降低(P<0.05),见表3、4。


组别12 h24 h48 h72 h96 h空白组0.17±0.020.39±0.030.54±0.070.65±0.100.75±0.02对照序列组0.17±0.060.38±0.030.50±0.120.71±0.200.81±0.10CELF1干扰序列组0.14±0.020.25±0.08ab0.29±0.12ab0.38±0.07ab0.51±0.09ab
注:与空白组比较,aP<0.05;与对照序列组比较,bP<0.05。
表4 各组细胞不同时点吸光度A值重复测量方差分析
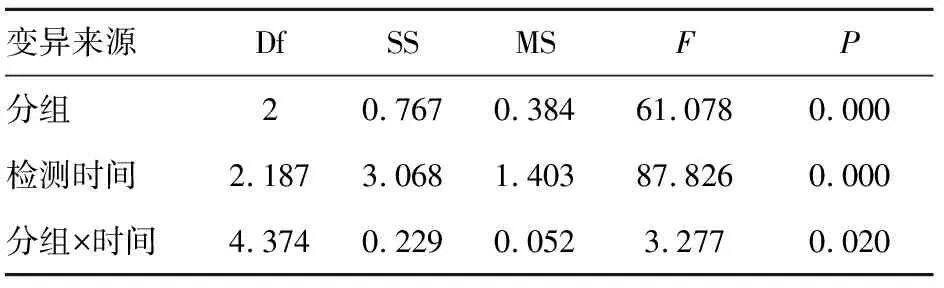
变异来源DfSSMSF P 分组20.7670.38461.0780.000检测时间2.1873.0681.40387.8260.000分组×时间4.3740.2290.0523.2770.020
注:Mauchly球形检验W=0.134,P=0.002,拒绝球形假设,需校正。
3 讨论
由于PTC发病隐匿,多数患者发现时可能已经存在颈淋巴结转移或远处侵犯[6],尽管PTC患者5年生存率达95%以上,但仍有部分患者由于肿瘤细胞侵袭力强、细胞分化程度低而预后不佳[7]。CELF1基因位于人染色体11p11上,最初发现在强直性肌营养不良发生中发挥重要作用[8],随着研究深入,发现其在恶性肿瘤发生中发挥重要作用,在肺癌[9]、口腔鳞癌[10]、胶质瘤[11]等多种恶性肿瘤组织中呈高表达,且与细胞增殖及侵袭力密切相关,亦有研究表明[12],CELF1高表达可作为预后不良的标志物。本研究结果显示,CELF1蛋白在PTC组织中呈高表达,可能参与了PTC发生过程,且与PTC进展及恶性转移过程有关。
特异性干扰PTC细胞中CELF1基因后,CELF1干扰序列组细胞中CELF1基因表达被成功抑制。有研究指出[13],CELF1高表达可促进胶质瘤细胞增殖及细胞周期改变。本研究结果显示,CELF1干扰序列组细胞24、48、72、96 h时吸光度A值均低于对照序列组和空白组,且克隆形成实验显示,CELF1干扰序列组细胞克隆形成率较对照序列组和空白组降低,这些结果说明沉默PTC细胞中CELF1基因可减少细胞增殖能力,提示CELF1基因高表达可能参了PTC细胞恶性增殖过程。本研究结果显示,CELF1干扰序列组侵袭细胞数均低于对照序列组和空白组,说明CELF1基因参与了PTC细胞侵袭过程,与细胞侵袭力相关。
综上所述,CELF1蛋白在PTC组织中呈高表达,特异性下调PTC细胞中CELF1基因表达可减少细胞增殖,抑制细胞侵袭力,有望为PTC临床防治提供新的基因靶位。
